Immunhistochemie und Immunzytochemie: Gewebebildgebung mittels Lichtmikroskopie
Überblick
Quelle: Michael S. Lee1 und Tonya J. Webb1
1 Department of Microbiology and Immunology, University of Maryland School of Medicine and the Marlene and Stewart Greenebaum Comprehensive Cancer Center, Baltimore, Maryland 21201
Immunhistochemie (IHC) und Immunzytochemie (ICC) sind Techniken, die verwendet werden, um die Expression und Lokalisierung spezifischer Antigene mit Antikörpern zu visualisieren. Die erste veröffentlichte Anwendung von IHC war 1941, als Albert Coons die Technik benutzte, um das Vorhandensein von Pneumokokken-Antigen in Gewebeabschnitten von Mäusen zu visualisieren, die mit Pneumokokken infiziert waren (1). Der Name, Immunhistochemie, leitet sich von den Wurzeln "immuno-" in Bezug auf Antikörper und "Histo-" in Bezug auf die gewebeabschnitte ab, die in IHC verwendet werden. Die Wurzel "Cyto-" in der Immunzytochemie unterstreicht den entscheidenden Unterschied zwischen ICC und IHC. Während IHC Teile des gesamten Gewebes verwendet, verwendet ICC Zellen, die aus Gewebe isoliert oder in Kultur gewachsen sind. Der Unterschied in den verwendeten Proben bedeutet, dass die Probenvorbereitung technisch zwischen IHC und ICC unterschiedlich ist, aber ansonsten sind die Protokolle für ICC und IHC identisch und man wird feststellen, dass die Begriffe häufig austauschbar verwendet werden.
Sowohl bei IHC als auch bei ICC werden Antikörper mit chemischen oder fluoreszierenden Tags, wie Peroxidase bzw. Rhodalin, verwendet, um die Verteilung jedes Antigens von Interesse durch spezifische Bindung des markierten Antikörpers an das Antigen zu visualisieren. Im Falle von IHC werden dünne Gewebescheiben auf einem Dia immobilisiert, um die Struktur des Gewebes zu erhalten, bevor es gebeizt wird, was die Visualisierung von Antigenen im Kontext ganzer Gewebe ermöglicht (Abbildung 1). Im Falle von ICC werden Zellen gleichmäßig auf einem Dia verteilt, bevor sie gefärbt werden, was die Visualisierung der Antigenverteilung innerhalb einzelner Zellen ermöglicht, aber nicht innerhalb der Struktur eines bestimmten Gewebes. Aufgrund der Ähnlichkeiten zwischen den beiden Protokollen wird sich dieses Protokoll auf IHC konzentrieren, um die zusätzlichen Komplexitäten der Probenvorbereitung im Zusammenhang mit IHC zu beheben.
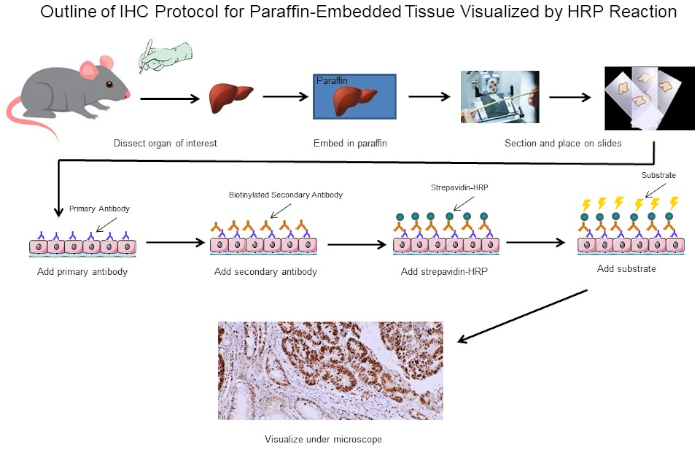
Abbildung 1: Gliederung des IHC-Protokolls. Visuelle Umriss eines IHC-Protokolls für paraffinintegriertes Gewebe, das von einer Maus seziert wurde. Dieses Protokoll verwendet einen biotinylierten Sekundärantikörper und Strepavidin-HRP, um die Position der Antikörperbindung zu visualisieren. Andere Optionen, wie fluoreszierend markierte Antikörper, sind ebenfalls möglich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die erste wichtige Entscheidung bei der Durchführung von IHC ist, wie die Gewebeabschnitte vorbereitet werden, um die Struktur des Gewebes während des gesamten Färbeprozesses zu erhalten. Die beiden wichtigsten Optionen sind formalin-feste Abschnitte von Paraffin-eingebettetem Gewebe oder frische Abschnitte von gefrorenem Gewebe. Es gibt keine einfache Antwort darauf, welche Methode verwendet werden soll, da es davon abhängt, welche nachgelagerte Analyse durchgeführt wird. Formalin-Fixierung von Paraffin eingebetteten Geweben wird im Allgemeinen gedacht, um Gewebemorphologie für eine optimale Bildgebung besser zu erhalten, während das Einfrieren von frischem Gewebe die Proteinfunktion für nachfolgende Assays außerhalb von IHC erhalten kann. Darüber hinaus haben sich frisch gefrorene Gewebeabschnitte als besser für die Genexpressionsanalyse geeignet erwiesen (2). Eine dritte Überlegung ist, ob die Antikörper für Ihr Antigen von Interesse für feste oder gefrorene Gewebeabschnitte geeignet sind, da einige Antikörper nur für eine bestimmte Art von Abschnitt optimiert wurden und möglicherweise nicht für andere arbeiten. Schließlich muss auch festgestellt werden, wie lange sie die Gewebeabschnitte lagern müssen, da frische gefrorene Proben bei -80°C aufbewahrt werden müssen und nicht länger als ein Jahr dauern dürfen, während feste Abschnitte viel länger bei Raumtemperatur gelagert werden können. Dies sind einige der wichtigsten Überlegungen, um zu bestimmen, ob formalin-feste Abschnitte von Paraffin-eingebettetem Gewebe oder frische Abschnitte von gefrorenem Gewebe verwendet werden sollen. Letztlich, wenn man genug Gewebe hat, kann es am besten sein, nur einige von beiden zu haben.
In diesem Experiment machten wir uns daran, festzustellen, ob die Cyclin-D1-Expression in vergrößerten Milz aus einem spontanen Mausmodell der Lymphomentwicklung erhöht wurde. Splenic-Gewebeproben wurden zuerst entweder von Wildtyp-Mäusen, transgenen Mäusen ohne Lymphom oder transgenen Mäusen, die spontan Lymphom entwickelt haben, isoliert. Die Milzgewebeproben wurden in Paraformaldehyd fixiert, in Paraffin eingebettet, geschnitten, mit einem Maus-Anti-Cyclin-D1-Primärantikörper, gefolgt von einem Pferde-Anti-Maus-Sekundärantikörper, gebeizt und mit 3,3-Diaminobenzidin (DAB) entwickelt. Die Abschnitte wurden dann in Harris Hematoxylin Solution gegenstainiert und dann wurden die Abschnitte bei 20-facher Vergrößerung abgebildet.
Reagenzien
Paraffin-Eingebettete Abschnitte
- 4% Paraformaldehyd (PFA)
- Ethanol (wasserfrei denaturiert, histologische Grade 100%, 95%, 80%, 75% und 50%). Verdünnung aus 100% Lagerbestand mit doppelt destilliertem Wasser (ddH2O)
- Xylol
- IHC-kompatible Glasrutsche, um sicherzustellen, dass der Gewebeabschnitt während des gesamten Verfahrens befestigt bleibt. IHC-kompatible Glasschieber haben eine spezielle Beschichtung und sind bei mehreren Händlern erhältlich. Wenn Sie ICC ausführen, verwenden Sie eine kammergekammerte Folie. Kammerrutschen ermöglichen es, Zellen in den Kammern auszusäen und in den Inkubator zu legen, bis zellennahe an der Rutsche befestigt sind und die richtige Konfluenz erreichen, an der die Kammern entfernt werden können und die Färbung auf die gleiche Weise wie IHC verlaufen kann.
- paraffin
- 0,3% Wasserstoffperoxid (H2O2)/Methanol: Zur Zubereitung 1 ml 30% H2O2 bis 99 ml Methanol hinzufügen. Bei -20°C lagern
- Antigen-Abrufpuffer: IHC-Citratpuffer pH 6,0
Frische gefrorene Abschnitte
- Optimale Schnitttemperatur (OCT) Einbettverbindung
- Optimale Fixierung: 4% PFA oder Aceton, das auf -20°C abgekühlt wurde
Färbung
- Sperrpuffer: Sollte vom Benutzer bestimmt werden. Ein Beispiel ist Pferdeserum in 1X PBS verdünnt
- Verdünnter Primärantikörper: siehe Herstellerspezifikationen
- Verdünnter biotinylatierter Sekundärantikörper: siehe Herstellerspezifikationen
- Verdünnte Avidin-Horseradish Peroxidase (HRP): Nur zur Peroxidase-Visualisierung. Siehe Herstellerspezifikationen.
- DAB oder ein anderes kompatibles Substrat
- Counterstain (optional)
- Ethanol (wasserfrei denaturiert, histologische Qualität 100% und 95%)
- Xylol
- Organo/Limonene Mount
Verfahren
1. Präparation von Zellen für die Immunzytochemie
- Saatzellen von Interesse auf kammerförmigen Dias oder kammerförmigen Decklippen durch Zugabe von 0,5 ml Zellsuspension zu den Brunnen einer 24 Brunnenkulturplatte.
Hinweis: Einige Zellen können Wachstum auf behandelten Coverlips erfordern, wie z. B. Mit Polylysin behandelte Abdeckungen. Die optimalen Behandlungsbedingungen sollten vom Anwender in Abhängigkeit vom verwendeten Zelltyp bestimmt werden. - Legen Sie die Platte in einen befeuchteten CO2-Inkubator und lassen Sie die Zellen bei 37°C bis 50-70% Konflukation wachsen.
- Sobald die Zellen eine optimale Koninfluenza erreicht haben, entfernen Sie die Kulturmedien aus jedem Brunnen und fixieren Sie die Zellen, indem Sie sie in 0,5 ml von 4% PFA (in 1X PBS) inkubieren und 20 min bei Raumtemperatur inkubieren.
- Entfernen Sie die Fixierung und waschen Sie die Brunnen dreimal mit 1 ml 1X PBS.
- Als nächstes permeabilisieren Sie die Zellen, indem Sie 0,5 ml von 0,1% Triton-X-100 in 1X PBS zu jedem Brunnen hinzufügen und 15 min bei Raumtemperatur inkubieren.
- Den Permeabilisationspuffer absaugen und die Brunnen dreimal mit 1 ml 1X PBS waschen.
- Die Zellen auf Denlips sind nun fixiert und permeabilisiert. Gehen Sie mit dem Färbungsverfahren für das folgende Immunohistochemie Beispiel gezeigt - mit der Ausnahme, dass die Inkubationen innerhalb der Brunnen der 24 Well-Platte statt direkt auf einem Gewebeabschnitt Dia durchgeführt werden sollte.
2. Vorbereitung von Formalin-Fixed, Paraffin-Embedded-Abschnitten für die Färbung
- Erhalten Sie vorbereitete formalinfixierte, paraffineingebettete Gewebeabschnitte.
Deparaffinisierung
- Tauchen Sie die Dias in 100% Xylol 2 mal für 5 min jeder.
Rehydration
- Tauchen Sie die Dias in 100% Ethanol 2 mal für jeweils 3 min ein.
- Tauchen Sie die Dias in 95% Ethanol für 3 min ein.
- Tauchen Sie die Dias in 70% Ethanol für 3 min ein.
- Tauchen Sie die Dias in 50% Ethanol für 3 min ein.
Blockieren der aktivitäten der endogene Peroxidase
- Inkubieren Sie die Dias in 100 ml von 0,3% H2O2 für 30 min bei Raumtemperatur.
- Waschen Sie die Dias mit 1X PBS 2 mal für je 5 min.
Antigen Retrieval
- Tauchen Sie die Dias in den IHC-Citratpuffer (pH 6) ein und kochen Sie sie 20 min hoch.
- Geweberutschen sind nun zur Färbung bereit.
3. Vorbereitung von frisch gefrorenen, OTC-eingebetteten Abschnitten für die Färbung
- Legen Sie 5 mm frisch isoliertes Gewebe in eine Form und fügen Sie OCT hinzu, bis der Abschnitt vollständig abgedeckt ist.
- Tauchen Sie den Gewebeblock langsam in flüssigen Stickstoff ein, bis er vollständig eingefroren ist. Die Probe kann nun bis zu einem Jahr bei -80°C gelagert werden.
- Sobald sie zum Schnitt bereit sind, übertragen Sie den gefrorenen Gewebeblock in einen Kryostat und lassen Sie das gesamte Setup auf -20°C kommen.
- Schneiden Sie 5-10 m dicke Gewebeabschnitte mit einem Kryostat und verwenden Sie Pinsel, um Abschnitte direkt auf IHC-kompatible Glasschlitten zu platzieren.
- Lassen Sie Die Dias über Nacht bei Raumtemperatur trocknen. Die Dias können auch bei -80°C gelagert werden.
- Tauchen Sie die Dias in 250 ml von 4% PFA für 15 min bei Raumtemperatur ein, um die Dias vor der Färbung zu fixieren. Die optimale Fixierungsmethode sollte vom Benutzer bestimmt werden.
- Tauchen Sie die Dias in 250 ml 1X PBS 2 mal für 5 min pro Stück ein.
- Tauchen Sie die Dias in 250 ml von 0,3%H2O2 für 30 min bei Raumtemperatur ein, um jede endogene Peroxidaseaktivität zu blockieren.
- Tauchen Sie die Dias in 250 ml 1X PBS 2 mal für 5 min pro Stück ein.
- Die Dias sind nun zur Färbung bereit.
4. Färbung
- Kreisen Sie das Gewebe mit einer hydrophoben Barriere mit einem Barrierestift.
Blockieren
- Mit einer Pipette 100 l Sperrpuffer (Pferdeserum in 1X PBS verdünnt) - über den Abschnitt für 1 Stunde bei Raumtemperatur.
- Entfernen Sie den Blockierpuffer mit einer Pipette.
Primäre Antikörper-Inkubation
- Inkubieren Sie das eingekreiste Gewebe mit 100 l verdünnter Primärantikörperlösung (Maus antihumanes Cyclin D1 verdünnt 1:100 im Sperrpuffer) 30 min bei Raumtemperatur.
- Entleeren Sie den primären Antikörper von jedem Schlitten und waschen Sie die Dias mit 1X PBS 2 mal für jeweils 5 min.
Sekundäre Antikörperinkubation
- Inkubieren Sie die Probe mit 100 l verdünntem biotinylierten Sekundärantikörper (biotinyliertes Pferd Antimaus-IgG verdünnt 1:200) für 30 min bei Raumtemperatur.
- Entfernen Sie den sekundären Antikörper, indem Sie die Abschnitte abtropfen lassen und mit 1X PBS 2 mal für jeweils 5 min waschen.
Farbentwicklung
- Visualisierung mit HRP: Add 100 l Avidin-Biotin-Komplex (ABC) Reagenz und inkubieren die Abschnitte in dunkel in für 30 min bei Raumtemperatur
Hinweis: Fluoreszierend markierte Antikörper können auch mit einem geeigneten Mikroskop verwendet und visualisiert werden. - Waschen Sie die Dias mit 1X PBS 2 mal für je 5 min.
- Entwickeln Sie die Dias, indem Sie die Abschnitte in 100 l DAB für bis zu 5 min inkubieren.
- Stoppen Sie die Entwicklung, indem Sie destilliertes Wasser (dH2O) für 5 min bei Raumtemperatur hinzufügen.
Gegenfärbung (falls gewünscht)
- Tauchen Sie die Dias kurz in Harris Hematoxylin Solution (oder 0,5% Methylgrün in 0,1M Natriumacetat (pH 4,2)) für 10 min.
- Spülen Sie den Gegenfleck ab, indem Sie rutschen in dH2O zweimal für jeweils 5 min waschen.
austrocknung
- Tauchen Sie die Dias in 95% Ethanol 2 mal für 5 min jeder.
- Tauchen Sie die Dias in 100% Ethanol 2 mal für 5 min jeder.
- Tauchen Sie die Dias in 100% Xylol 2 mal für 5 min jeder.
- Blot die Dias mit einem Papiertuch.
Montage- und Deckbedeckungsapplikation
- Fügen Sie den Dias einen Tropfen Montagemedien wie Organo-Limonene Mount hinzu und legen Sie einen Deckzettel über die Abschnitte.
Mikroskopische Analyse
- Beobachten Sie die gebeizten Abschnitte unter einem geeigneten Mikroskop für die Analyse. Hier wurde ein Standard-Lichtmikroskop zur Beobachtung und eine montierte Digitalkamera zur Bildgebung eingesetzt.
Ergebnisse
IHC und ICC haben eine breite Palette von Anwendungen. Eine Verwendung von IHC besteht beispielsweise darin, die Expression von Onkogenen in spontanen Mausmodellen der Tumorentwicklung zu untersuchen. In Abbildung 2haben wir festgestellt, ob die Cyclin-D1-Expression in vergrößerten Milz in einem spontanen Mausmodell der Lymphomentwicklung erhöht wurde. Splenic-Gewebeproben wurden in Paraformaldehyd fixiert, in Paraffin eingebettet, geschnitten, mit einem Anti-Cyclin-D1-Antikörper gebeizt (verdünnt 1:200 im Sperrpuffer), und dann wurden die Abschnitte mit 20-facher Vergrößerung abgebildet. Cyclin D1-exemittierte Zellen werden durch die rötlich-braune Farbe vor dem blauen Gewebehintergrund angezeigt. Diese Ergebnisse deuten darauf hin, dass die Cyclin-D1-Expression in vergrößerten Milz verstärkt wurde, was auf eine Korrelation zwischen der Krebsentwicklung und der Cyclin-D1-Expression in diesem Modell hindeutet.
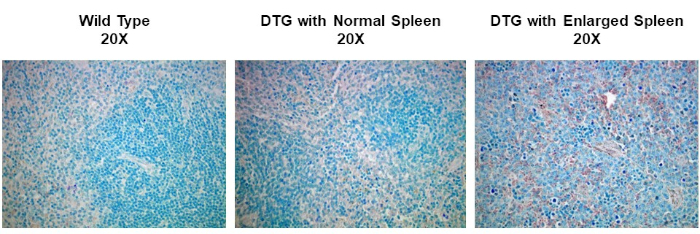
Abbildung 2: Splenic Cyclin D1 Expression in einem Spontaneous Double Transgenic (DTG) Mausmodell des Lymphoms. Ein Bild von Milzgewebe, das mit einem Anti-Cyclin D1-Primärantikörper gefärbt, mit Methylgrün gegengefärbt und mit einem biotinylierten Sekundärantikörper und ABC-Reagenz visualisiert wird, das mit DAB-Substrat aktiviert wird. Die rötlich-braune Farbe stellt Stellen dar, an denen der Antikörper gebunden ist und auf das Vorhandensein von Cyclin D1 hinweist, die Tumorzellen innerhalb der Struktur des Milzgewebes exemiten, das blau eingefleckt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Anwendung und Zusammenfassung
Immunhistochemie (IHC) und Immunzytochemie (ICC) sind Techniken, die verwendet werden, um die Expression und Lokalisierung spezifischer Antigene mit Antikörpern zu visualisieren. Gewebe werden zuerst in dünne Abschnitte geschnitten, die die Gewebemorphologie erhalten, und auf einem Dia platziert. Die Antikörper werden dann hinzugefügt und binden das Antigen von Interesse und sind mit einem spezifischen Tag ausgestattet, mit dem sie unter dem Mikroskop visualisiert werden können. So kann durch dieses Grundkonzept die Verteilung von Antigenen im Kontext der Gewebestruktur visualisiert und untersucht werden. Obwohl das übergreifende Konzept einfach ist, gibt es mehrere verschiedene Ansätze und Variationen, die entwickelt wurden, die sowohl die Komplexität als auch die Nützlichkeit dieser Techniken erhöhen. In diesem Papier wurde das Grundkonzept des IHC und des IStGH, die wichtigsten Entscheidungen, die bei der Anwendung dieser Techniken berücksichtigt werden müssen, sowie ein detailliertes Schritt-für-Schritt-Protokoll behandelt. Die von IHC und ICC produzierten Bilder sind in der Regel das Endprodukt und können veröffentlicht werden, um offensichtliche Unterschiede in den Mengen oder der Verteilung der Färbung zwischen verschiedenen Bedingungen hervorzuheben.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Immunhistochemie und Immunzytochemie: Gewebebildgebung mittels Lichtmikroskopie
Immunology
79.1K Ansichten

Durchflusszytometrie und fluoreszenzaktivierte Zellsortierung (FACS): Isolierung von B-Lymphozyten
Immunology
93.2K Ansichten

Magnetaktivierte Zellsortierung (MACS): Isolierung von T-Lymphozyten
Immunology
23.1K Ansichten

ELISA-Test: Indirekt, Sandwich und kompetitiv
Immunology
239.3K Ansichten

ELISPOT-Assay: Nachweis von IFN-γ-sezernierenden Splenozyten
Immunology
28.8K Ansichten

Antikörper-Generierung: Herstellung monoklonaler Antikörper mit Hybridomen
Immunology
43.6K Ansichten

Immunfluoreszenzmikroskopie: Immunfluoreszenzfärbung paraffin-embedded Tissue Sections
Immunology
54.0K Ansichten

Konfokale Fluoreszenzmikroskopie: Eine Technik zur Bestimmung der Lokalisierung von Proteinen in Maus-Fibroblasten
Immunology
43.4K Ansichten

Immunprecipitation-basierte Techniken: Reinigung endogener Proteine mit Agarose-Perlen
Immunology
87.8K Ansichten

Zellzyklusanalyse: Bewertung der Proliferation von CD4- und CD8-T-Zellen nach Stimulation mit CFSE-Färbung und Durchflusszytometrie
Immunology
24.3K Ansichten

Adoptivzelltransfer: Spendermaus-Splenozyten einer Host-Maus einführen und Erfolg über FACS bewerten
Immunology
22.6K Ansichten

Assay für Zelltod: Chrom Release Assay der zytotoxischen Fähigkeit
Immunology
151.5K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten