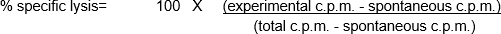Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Panoramica
Fonte: Frances V. Sjaastad1,2, Whitney Swanson2,3e Thomas S. Griffith1,2,3,4
1 Programma di laurea in microbiologia, immunologia e biologia del cancro, Università del Minnesota, Minneapolis, MN 55455
2 Centro di Immunologia, Università del Minnesota, Minneapolis, MN 55455
3 Dipartimento di Urologia, Università del Minnesota, Minneapolis, MN 55455
4 Masonic Cancer Center, Università del Minnesota, Minneapolis, MN 55455
Una delle funzioni principali delle cellule del sistema immunitario è quella di rimuovere le cellule bersaglio che sono state infettate da virus o hanno subito la trasformazione in una cellula tumorale. I saggi in vitro per misurare la capacità citotossica delle cellule immunitarie sono stati un punto fermo nei laboratori per molti anni. Questi saggi sono stati utilizzati per determinare la capacità delle cellule T, delle cellule NK o di qualsiasi altra cellula immunitaria di uccidere le cellule bersaglio in modo antigene-specifico o non specifico. I ligandi di morte (ad esempio, ligando fas o TRAIL), le citochine (ad esempio, IFNg o TNF) o i granuli citotossici (ad esempio, perforina / granzima B) espressi dalle cellule emotrici sono alcuni modi in cui la morte delle cellule bersaglio può essere indotta. Con l'esplosione della ricerca sull'immunoterapia tumorale negli ultimi anni, c'è un crescente interesse nella ricerca di agenti per aumentare l'attività citotossica delle cellule immunitarie per migliorare i risultati dei pazienti. Al contrario, alcune malattie sono caratterizzate dall'attività esuberante dell'attività citotossica delle cellule immunitarie, con conseguenti sforzi per identificare gli agenti per temperare queste risposte. Pertanto, avere un test in cui l'utente può facilmente integrare qualsiasi numero di diverse cellule emotrici, cellule bersaglio e / o modificatori di risposta nel progetto sperimentale può servire come mezzo prezioso per valutare rapidamente la capacità citotossica delle cellule emotrici e / o la reattività della cellula bersaglio.
Questi saggi in vitro comportano la miscelazione di diverse popolazioni cellulari, oltre a utilizzare un numero relativamente basso di cellule emotrici e bersaglio. Pertanto, una necessità del test è quella di etichettare le cellule bersaglio in un modo che possa essere facilmente rilevato e quantizzato, consentendo all'utente di determinare quindi la "lisi specifica percentuale" mediata dalle cellule emotrici. La radioattività - in particolare, il cromo 51 (51Cr) sotto forma di Na251CrO4- è un modo economico per etichettare rapidamente e in modo non specifico le proteine cellulari all'interno delle cellule bersaglio (1). La breve etichettatura e i tempi totali del test riducono il potenziale di cambiamenti significativi nel numero e/o nel fenotipo delle cellule bersaglio, che potrebbero influenzare l'esito del test. Dopo la perdita dell'integrità della membrana delle cellule bersaglio a causa dell'attività citotossica delle cellule emotrici, le 51proteine cellulari marcate con Cr all'interno delle cellule bersaglio vengono rilasciate nel surnatante di coltura, diventando disponibili per la quantificazione. Come con qualsiasi test che esamina la funzione delle cellule immunitarie in vitro, ci sono una serie di considerazioni importanti da considerare per migliorare le prestazioni dell'esperimento. Una delle caratteristiche più critiche è quella di utilizzare cellule emocromatrici sane (per la massima attività citotossica) e target (per la massima reattività e la minima morte spontanea /rilascio di 51Cr). È necessario il contatto tra effettore e cellula bersaglio (che porta all'uso comune di piastre a 96 pozzi a fondo tondo per incoraggiare il contatto cellula-cellula) (2). Infine, l'analisi dei dati dipende dall'inclusione di popolazioni di cellule bersaglio di controllo positive e negative.
Il seguente protocollo delineerà i passaggi per l'esecuzione di un test standard di rilascio di 51Cr per misurare la capacità citotossica di una popolazione di cellule emotrici, sebbene sia stata recentemente sviluppata una versione non radiativa che utilizza Europium. 51 anni Cr è un potente emettitore di radiazioni γ. Di conseguenza, l'uso di questo test richiede un'adeguata formazione sulla sicurezza delle radiazioni, uno spazio di laboratorio dedicato, un contatore gamma e lo smaltimento di campioni radioattivi.
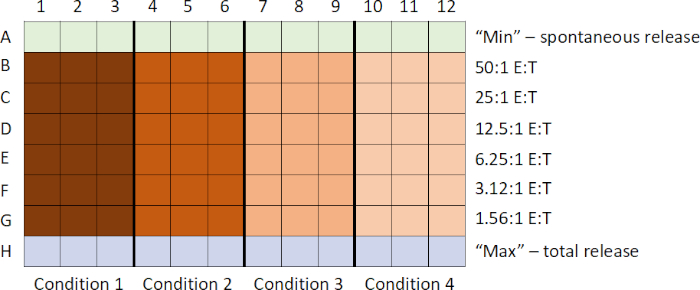
La sequenza generale degli eventi in questo test sono: 1) preparare 51bersagli etichettati con Cr; 2) preparare le cellule emotrici e aggiungerle alla piastra mentre le cellule bersaglio sono etichettate; 3) aggiungere bersagli etichettati alla piastra; 4) piastra di incubazione; 5) raccogliere supernatanti; e 6) analizzare i dati dopo aver eseguito i campioni sul contatore. I campioni sono comunemente preparati in triplice copia e quindi mediati per tenere conto di eventuali sottili differenze di pipettaggio.
Un DPI adeguato è importante per questo test. In particolare, l'utente deve indossare un camice da laboratorio e guanti. Gli occhiali di sicurezza possono essere richiesti in base al laboratorio o all'istituzione. Ci dovrebbe essere un'ampia schermatura al piombo per la conservazione sicura e l'uso del 51Cr durante tutte le fasi. Infine, ci dovrebbero essere spazi di laboratorio dedicati e attrezzature riservate all'utilizzo di 51Cr, compresa tutta la segnaletica appropriata per indicare dove vengono conservati i campioni con 51Cr e un contatore Geiger dotato di sonda gamma per esaminare lo spazio per possibili contaminazioni.
In questo esercizio di laboratorio, determineremo la capacità delle cellule mononucleate del sangue periferico umano (PBMC) (CpG stimolate vs. non stimolate) di uccidere le cellule di melanoma, utilizzando la linea cellulare del melanoma umano WM793 come modello e il test di rilascio del cromo.
Procedura
Panoramica della procedura
Il tipico test 51Cr-release per misurare la morte cellulare prevede i seguenti passaggi:
- Innanzitutto, le cellule bersaglio sono etichettate con Na2[51Cr]O4. Questo li distingue dalle cellule emotrici nel test.
- Mentre le cellule bersaglio vengono etichettate, le cellule emotrici vengono raccolte e, utilizzando la tecnica di diluizione seriale, viene generata una titolazione decrescente d
Risultati
In questo esempio, le cellule emotrici stimolate con CpG (Figura 1, cerchi neri)hanno ucciso le cellule bersaglio in modo più efficace, poiché il rapporto tra cellule emotrici e cellule bersaglio è aumentato. Questo aumento non è stato osservato nelle PBMC non stimolate (cerchi bianchi), indicando che la stimolazione CpG è necessaria per l'aumento osservato della lisi delle cellule bersaglio.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
Applicazione e Riepilogo
Il test qui descritto ha una notevole flessibilità, in quanto è possibile utilizzare una varietà di cellule emotrici e bersaglio a seconda della domanda posta. Ad esempio, la specificità delle cellule emotrici può essere determinata utilizzando diverse cellule bersaglio o il meccanismo di uccisione delle cellule emotrici può essere determinato utilizzando cellule carenti di proteine specifiche o utilizzando inibitori specifici della proteina. Un problema importante con il test di rilascio di 51Cr è il p...
Riferimenti
- Brunner, K. T., Mauel, J., Cerottini, J. C. and Chapuis. B. Quantitative assay of the lytic action of immune lymphoid cells on 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology, 14 (2):181-196, (1968).
- Kemp, T. J., B. D. Elzey, and T. S. Griffith. Plasmacytoid dendritic cell-derived IFN-alpha induces TNF-related apoptosis-inducing ligand/Apo-2L-mediated antitumor activity by human monocytes following CpG oligodeoxynucleotide stimulation. The Journal of Immunology, 171 (1): 212-218, (2003).
Vai a...
Video da questa raccolta:

Now Playing
Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Immunology
151.4K Visualizzazioni

Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Immunology
93.0K Visualizzazioni

Magnetic Activated Cell Sorting (MACS): isolamento dei linfociti T timici
Immunology
22.9K Visualizzazioni

Saggi ELISA: indiretti, sandwich e competitivi
Immunology
238.4K Visualizzazioni

EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Immunology
28.5K Visualizzazioni

Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Immunology
78.9K Visualizzazioni

Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Immunology
43.6K Visualizzazioni

Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Immunology
53.9K Visualizzazioni

Microscopia a fluorescenza confocale: una tecnica per determinare la localizzazione delle proteine nei fibroblasti di topo
Immunology
43.2K Visualizzazioni

Tecniche basate sull'immuno-precipitazione: purificazione di proteine endogene con l'impiego di microsfere di agarosio
Immunology
87.7K Visualizzazioni

Analisi del ciclo cellulare: valutazione della proliferazione delle cellule T CD8 e CD4 in seguito a stimolazione tramite colorazione CFSE e citometria a flusso
Immunology
24.2K Visualizzazioni

Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Immunology
22.3K Visualizzazioni