Un soluto es un componente de una solución que normalmente está presente en una concentración mucho menor que el solvente. Las concentraciones de soluto se describen a menudo con términos cualitativos como diluido (de concentración relativamente baja) y concentrado (de concentración relativamente alta).
Las concentraciones pueden evaluarse cuantitativamente utilizando una amplia variedad de unidades de medición, cada una de ellas conveniente para aplicaciones particulares. La molaridad (M) es una unidad de concentración útil para muchas aplicaciones químicas. La molaridad se define como la cantidad de soluto en número de moles dividida por el volumen de la solución en litros:

Debido a que los volúmenes de solución varían con la temperatura, las concentraciones molares también variarán. Cuando se expresa como molaridad, la concentración de una solución con números idénticos de especies de soluto y solvente será diferente a diferentes temperaturas debido a la contracción/expansión de la solución. Más apropiadas para los cálculos que implican muchas propiedades coligativas son las unidades de concentración basadas en moles cuyos valores no dependen de la temperatura. Dos de estas unidades son la fracción molar (introducida en el capítulo anterior sobre gases) y la molalidad.
La fracción molar, χA, de un componente es la relación entre su cantidad molar y el número total de moles de todos los componentes de la solución:
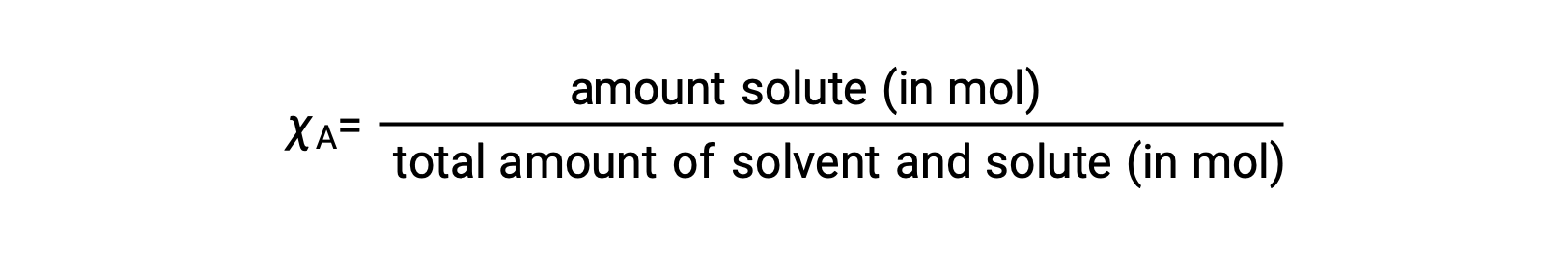
Por esta definición, la suma de fracciones molares para todos los componentes de la solución (el disolvente y todos los solutos) es igual a uno.
La molalidad es una unidad de concentración definida como la relación entre el número de moles de soluto y la masa del disolvente en kilogramos:
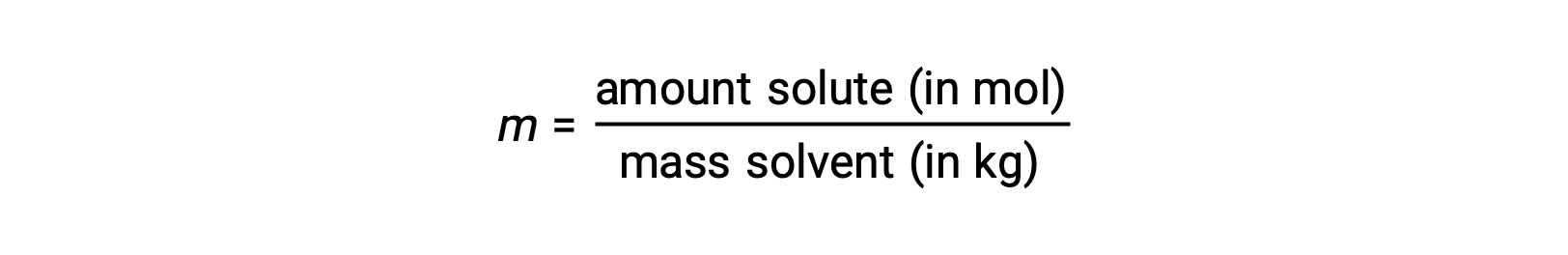
Puesto que estas unidades se calculan utilizando sólo masas y cantidades molares, no varían con la temperatura y, por lo tanto, son más adecuadas para aplicaciones que requieren concentraciones independientes de la temperatura.
Este texto es adaptado de Openstax, Química 2e, Sección 11.4: Propiedades Colligativas.
Del capítulo 12:

Now Playing
12.7 : Expresando la concentración de las Soluciones
Soluciones y coloides
57.9K Vistas

12.1 : Formación de las Soluciones
Soluciones y coloides
30.8K Vistas

12.2 : Las Fuerzas Intermoleculares en las Soluciones
Soluciones y coloides
32.6K Vistas

12.3 : Entalpía de Solución
Soluciones y coloides
24.4K Vistas

12.4 : Soluciones Acuosas y Calores de Hidratación
Soluciones y coloides
14.1K Vistas

12.5 : Equilibrio y Saturación de las Soluciones
Soluciones y coloides
18.1K Vistas

12.6 : Propiedades Físicas que Afectan la Solubilidad
Soluciones y coloides
22.2K Vistas

12.8 : Reducción de la Presión de Vapor
Soluciones y coloides
25.6K Vistas

12.9 : Soluciones Ideales
Soluciones y coloides
18.8K Vistas

12.10 : Descenso del punto de Congelamiento y Elevación del Punto de Ebullición
Soluciones y coloides
33.7K Vistas

12.11 : Ósmosis y Presión Osmótica de las Soluciones
Soluciones y coloides
38.6K Vistas

12.12 : Electrolitos: Factor de van't Hoff
Soluciones y coloides
32.4K Vistas

12.13 : Coloides
Soluciones y coloides
17.2K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados