12.7 : Exprimer la concentration d'une solution
Un soluté est un constituant d'une solution généralement présent à une concentration beaucoup plus faible que le solvant. Les concentrations en soluté sont souvent décrites avec des termes qualitatifs tels que dilué (de concentration relativement faible) et concentré (de concentration relativement élevée).
Les concentrations peuvent être évaluées de façon quantitative à l'aide d'une grande variété d'unités de mesure, chacune convenant à des applications particulières. La molarité (M) est une unité de concentration utile pour de nombreuses applications en chimie. La molarité est définie comme la quantité de soluté, en nombre de moles, divisée par le volume de la solution en litres :

Comme les volumes de solution varient en fonction de la température, les concentrations molaires varient également. Lorsqu'elle est exprimée en molarité, la concentration d'une solution ayant des nombres identiques d'espèces de soluté et de solvant sera différente à différentes températures en raison de la contraction/dilatation de la solution. Les unités de concentration molaire dont les valeurs ne dépendent pas de la température sont plus appropriées pour les calculs impliquant de nombreuses propriétés colligatives. Deux de ces unités sont la fraction molaire (présentée dans le chapitre précédent sur les gaz) et la molalité.
La fraction molaire, χA, d'un constituant est le rapport entre sa quantité molaire et le nombre total de moles de tous les constituants de la solution :
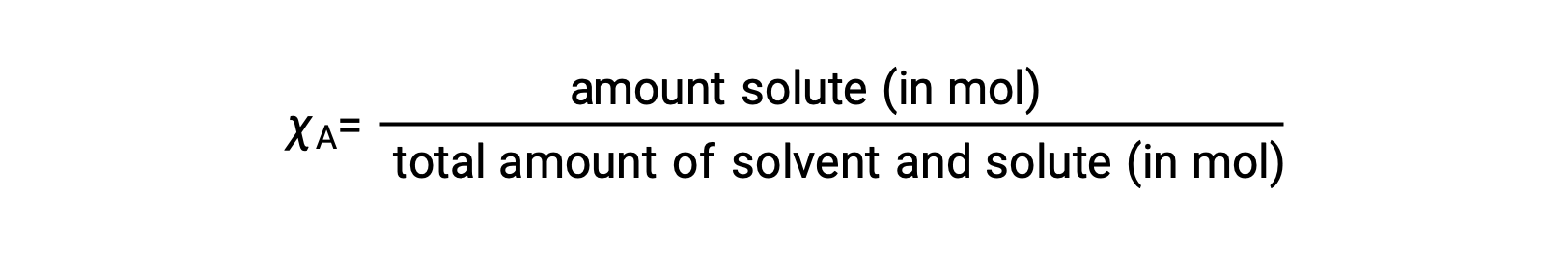
À partir de cette définition, la somme des fractions molaires pour tous les constituants de la solution (le solvant et tous les solutés) est égale à un.
La molalité est une unité de concentration définie comme étant le rapport entre le nombre de moles de soluté et la masse du solvant en kilogrammes :
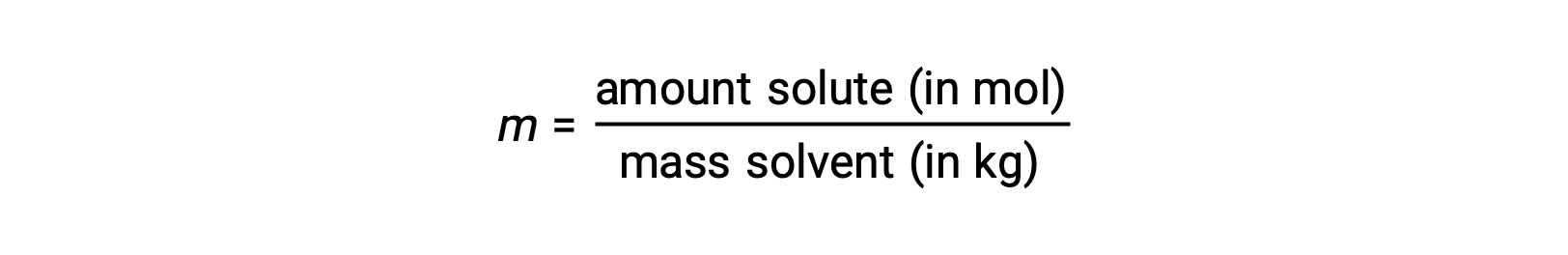
Comme ces unités sont calculées en utilisant uniquement des masses et des quantités molaires, elles ne varient pas en fonction de la température et sont donc mieux adaptées aux applications nécessitant des concentrations indépendantes de la température.
Ce texte est adapté de Openstax, Chimie 2e, Section 11.4 : Propriétés colligatives.
Du chapitre 12:

Now Playing
12.7 : Exprimer la concentration d'une solution
Solutions et colloïdes
58.3K Vues

12.1 : Formation de la solution
Solutions et colloïdes
31.3K Vues

12.2 : Forces intermoléculaires dans les solutions
Solutions et colloïdes
33.1K Vues

12.3 : Enthalpie de solution
Solutions et colloïdes
24.7K Vues

12.4 : Solutions aqueuses et enthalpie d'hydratation
Solutions et colloïdes
14.3K Vues

12.5 : Équilibre et saturation de la solution
Solutions et colloïdes
18.5K Vues

12.6 : Propriétés physiques affectant la solubilité
Solutions et colloïdes
22.4K Vues

12.8 : Abaissement de la pression de vapeur saturante
Solutions et colloïdes
26.0K Vues

12.9 : Solutions idéales
Solutions et colloïdes
19.2K Vues

12.10 : La loi de l'ébulliométrie et la loi de la cryométrie
Solutions et colloïdes
34.2K Vues

12.11 : Osmose et pression osmotique des solutions
Solutions et colloïdes
39.1K Vues

12.12 : Électrolytes : facteur de van 't Hoff
Solutions et colloïdes
32.9K Vues

12.13 : Colloïdes
Solutions et colloïdes
17.3K Vues