En comparación con el agua pura, la solubilidad de un compuesto iónico es menor en soluciones acuosas que contienen un ion común (uno también producido por disolución del compuesto iónico). Este es un ejemplo de un fenómeno conocido como el efecto del ion común, que es una consecuencia de la ley de acción de masas que puede explicarse utilizando el principio de Le Châtelier. Considere la disolución del yoduro de plata:
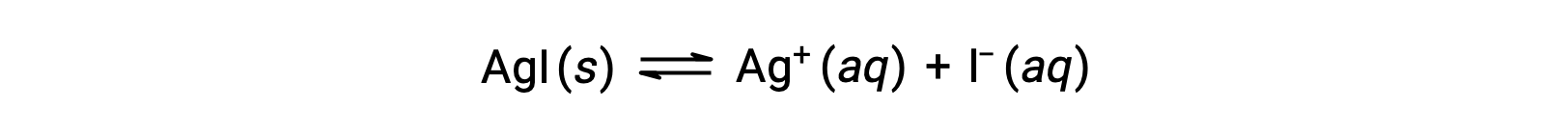
Este equilibrio de solubilidad puede ser desplazado hacia la izquierda por la adición de iones de plata (I) o yoduro, resultando en la precipitación del AgI y en concentraciones bajas de Ag+ y I− disueltos. En soluciones que ya contienen cualquiera de estos iones, se puede disolver menos AgI que en soluciones sin estos iones.
Este efecto también puede explicarse en términos de acción de masas, tal como se representa en la expresión del producto de solubilidad:
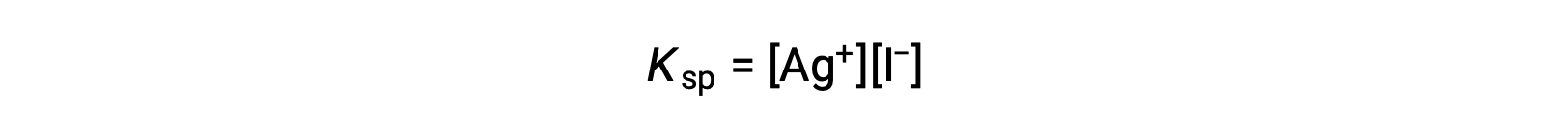
El producto matemático de las molaridades de los iones de plata (I) y yoduro es constante en una mezcla en equilibrio independientemente de la fuente de los iones, por lo que un aumento de la concentración de un ion debe equilibrarse con una disminución proporcional en el otro.
Efecto del ion común sobre la solubilidad
El ion común afecta la solubilidad del compuesto en una solución. Por ejemplo, el Mg(OH)2 sólido se disocia en iones Mg2+ y OH− de la siguiente manera;
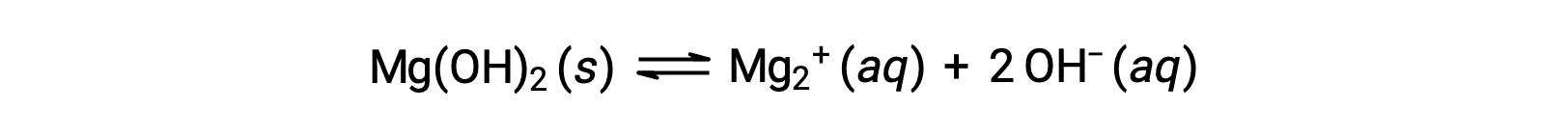
Si se MgCl2 a una solución saturada de Mg(OH)2, la reacción se desplaza hacia la izquierda para aliviar la tensión producida por el ion Mg2+ adicional, de acuerdo con el principio de Le Chࢲtelier. En términos cuantitativos, el Mg2+ añadido hace que el cociente de reacción sea mayor que el producto de solubilidad (Q > Ksp), y se forma Mg(OH)2 hasta que el cociente de reacción vuelva a ser igual a Ksp. En el nuevo equilibrio, [OH−] es menor y [Mg2+] es mayor que en la solución de Mg(OH)2 en agua pura.
Si se añade KOH a una solución saturada de Mg(OH)2, la reacción se desplaza hacia la izquierda para aliviar la tensión del ion OH− adicional. Se forma Mg(OH)2 hasta que el cociente de reacción vuelve a ser igual a Ksp. En el nuevo equilibrio, [OH−] es mayor y [Mg2+] es menor que en la solución de Mg(OH)2 en agua pura.
Este texto es adaptado de Openstax, Química 2e, Sección 15.1: Precipitación y Disolución.
Del capítulo 16:

Now Playing
16.1 : Efecto del Ion Común
Equilibrio ácido-base y de solubilidad
40.3K Vistas

16.2 : Amortiguadores
Equilibrio ácido-base y de solubilidad
162.6K Vistas

16.3 : Ecuación de Henderson-Hasselbalch
Equilibrio ácido-base y de solubilidad
67.3K Vistas

16.4 : Calculando los Cambios de pH en una Solución Amortiguadora
Equilibrio ácido-base y de solubilidad
52.0K Vistas

16.5 : Efectividad de un Amortiguador
Equilibrio ácido-base y de solubilidad
47.9K Vistas

16.6 : Cálculos de Titulación: Ácido Fuerte - Base Fuerte
Equilibrio ácido-base y de solubilidad
28.3K Vistas

16.7 : Cálculos de Titulación: Ácido Débil - Base Débil
Equilibrio ácido-base y de solubilidad
42.8K Vistas

16.8 : Indicadores
Equilibrio ácido-base y de solubilidad
47.3K Vistas

16.9 : Titulación de un Ácido Poliprótico
Equilibrio ácido-base y de solubilidad
95.2K Vistas

16.10 : Equilibrio de Solubilidad
Equilibrio ácido-base y de solubilidad
50.3K Vistas

16.11 : Factores que Afectan la Solubilidad
Equilibrio ácido-base y de solubilidad
32.6K Vistas

16.12 : Formación de Iones Complejos
Equilibrio ácido-base y de solubilidad
22.8K Vistas

16.13 : Precipitación Iónica
Equilibrio ácido-base y de solubilidad
27.2K Vistas

16.14 : Análisis Cualitativo
Equilibrio ácido-base y de solubilidad
19.3K Vistas

16.15 : Curvas de Titulación Ácido-Base
Equilibrio ácido-base y de solubilidad
124.4K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados