Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La transfección de ADN de músculos esqueléticos de mamíferos con En Vivo La electroporación
En este artículo
Resumen
Se describen los procedimientos detallados para la transfección eficiente de ADN plásmido en las fibras de los músculos del pie de ratones vivos utilizando electroporación y la visualización posterior de la expresión de proteínas mediante microscopía de fluorescencia.
Resumen
Un creciente interés en la biología de las células es la de expresar las formas transgénicamente modificada de proteínas esenciales (por ejemplo, construye marcados con fluorescencia y / o variantes mutantes) con el fin de investigar su distribución endógena y la relevancia funcional. Un enfoque interesante que se ha implementado para cumplir con este objetivo en las células completamente diferenciadas es la
Protocolo
Procedimientos experimentales en el electroporación in vivo de los músculos y FDB IO
- Antes de iniciar el protocolo de electroporación in vivo, los plásmidos de expresión de mamíferos debe ser amplificada para producir la concentración en el rango de 2.5 mg de plásmido Nota / l de TE:. Habitualmente usamos kits comerciales de amplificación y seguir los procedimientos del fabricante. Plásmidos comerciales expresión que lleva el trabajo de promotor CMV muy bien en el músculo esquelético en transfecciones vivo.
- Alícuota del volumen necesario (10-20 l) de la solución de plásmido y guardarlo en dos tubos de 0,5 ml Eppendorf (una para cada pie del ratón).
- Prepare una solución que contiene 2 mg / ml de hialuronidasa en Tyrode estéril.
- El uso de un cuadro de anestesia, profundamente anestesiar a un ratón con un 4% de isoflurano en O2 con un gas aprobada máquina de anestesia. Colocar el animal sobre una almohadilla térmica (37 ° C) y mantener la anestesia utilizando una máscara de roedores. Monitor de la profundidad de la anestesia por reflejo dedo sujetador.
- Bajo observación con un microscopio de disección, se inyectan 10 l de la solución de hialuronidasa en los bandoleros de un pie del ratón con un 1 "de largo 33 aguja estéril. Penetrar en la piel en un punto cercano al talón del pie y avanzar la aguja por vía subcutánea a la base de los dedos de ~ 1 / 4 ".
- Repita el procedimiento con el otro pie, si así lo desea.
- Desconecte la anestesia y el lugar del ratón en una jaula. Permite que se recupere completamente de la anestesia.
- Después de una hora, anestesiar al animal por segunda vez y colocarlo sobre el cojín eléctrico. Siguiendo el mismo procedimiento descrito para la solución de hialuronidasa, inyectar un total de 20-50 g de ADN plásmido (dependiendo del tamaño de la construcción del plásmido). El volumen de inyección total debe ser inferior a 20 l / pie. Nota: cuando L μ 15-20 es necesario, es recomendable cerrar la piel en el punto de entrada de la aguja con el tejido-cola.
- Desconecte la anestesia y el lugar del ratón en una jaula. Permite que se recupere completamente de la anestesia y esperar 10-15 min.
- Anestesiar al animal, por tercera vez y colocarlo sobre el cojín eléctrico.
- Seleccione una pata del animal. Coloque un chapado en oro la acupuntura con agujas debajo de la piel en el talón, y una segunda en la base de los dedos del pie. Los electrodos están paralelos entre sí y perpendiculares al eje longitudinal del pie.
- Conectar la cabeza de las agujas (electrodos) en el estimulador eléctrico con micro-clip conectores. Electroporar los músculos mediante la aplicación de pulsos de 20, 20 ms de duración / cada uno, a 1Hz. Dependiendo de la separación de los electrodos, la amplitud de los pulsos de tensión "se ajusta (mediante el control con un osciloscopio) para producir un campo eléctrico de aproximadamente 100 Nota V / cm. No hay contracciones en respuesta a los estímulos se debe observar si el nivel de la anestesia es la adecuada.
- Si lo desea, repita el procedimiento anterior en el pie contralateral del animal.
- Devolver el animal a la jaula y una vez recuperado de la anestesia mantenerlo en observación. Nota: si el procedimiento fue normal, el animal debe recobrar la movilidad total dentro de 30 minutos y después está listo para ser enviado de vuelta a la sala de animales en el vivero. Las inyecciones de hialuronidasa y el ADN de los bandoleros no tienen notables efectos adversos en los animales. Una vez recuperado de la anestesia, los ratones son capaces de deambular normalmente alrededor de la jaula. Como precaución adicional, añada al agua de bebida de los animales Carprofen en 0,0027 mg / ml durante 2 días como analgésico.
- Expresión de la proteína se puede probar 2-8 días después de la transfección. Sin embargo, la expresión sostenida de muchas proteínas se ha observado desde hace meses.
NOTA: Todos los animales procedimientos fueron aprobados por el Comité Rector de la UCLA de Investigación de Animales a lo dispuesto por la Ley de Bienestar Animal y la Política de PHS en Cuidado Humano y Uso de Animales de Laboratorio.
Los resultados representativos:
La correcta aplicación de la electroporación in vivo en los procedimientos descritos anteriormente deben resultar en la transfección eficaz de los plásmidos en los músculos y FDB IO. Sin embargo, la eficacia de la expresión de las variantes de la proteína transgénica dependerá del plásmido, el tamaño y la complejidad de las proteínas, las propiedades funcionales de las proteínas, y una serie de otras variables fuera de nuestro control. Como se ilustra en la Figura 1 para un músculo FDB electroporated en la presencia de un plásmido comercial (PMR-mCherry), que codifica para la proteína mCherry, la mayoría de las fibras musculares son transfectadas con el protocolo como lo demuestra el hecho de la mayoría de ellos muestra fluorescencia roja. Esto no excluye la posibilidad de que las fibras individuales tienen diferentes grados de expresión de la proteína, o que no son pocas fibras transfectadas a las 3. Hay que be indicó que la expresión eficiente de grandes cantidades de proteínas fluorescentes como mCherry, EGFP, ECFP y EYFP, no altera la excitabilidad de las fibras musculares y las propiedades de excitación-contracción de acoplamiento. De hecho, son indistinguibles de las de los músculos farsa transfectadas (resultados no mostrados).
Enfoques prácticos para verificar la expresión localizada de proteínas marcadas con fluorescencia en las fibras del músculo esquelético.
La localización intracelular de la di novo expresado proteínas transgénicas es evaluada en forma rutinaria por la adquisición simultánea, utilizando el TPLSM, imágenes fluorescentes de las respectivas etiquetas y las imágenes de los marcadores bien definidos de las estructuras celulares. El más típico de estos últimos son los siguientes: a) la generación de segundo armónico (SHG) las imágenes que surgen de la anisotropía de la miosina sarcomérica A las bandas (con centro en la M-lines) 9,10 y, b) di-8-ANEPPS fluorescencia imágenes, que se puede obtener, mediante el etiquetado y la superficie transversal tubular (T-túbulo) sistema de membranas de las fibras musculares con este dye11 potenciométrica impermeant. En las imágenes de fluorescencia de las fibras musculares teñidas con di-8-ANEPPS, el T-túbulos aparecen como bandas estrechas de la fluorescencia orientada aproximadamente ortogonal al eje longitudinal de la fibra. Estas bandas están desigualmente espaciados unos de otros: ellos están separados por una distancia larga que se extiende a través de la M-líneas, y uno corto que se extiende sobre los 11 Z-line.
Expresión y localización de la α-actinina-EGFP en las fibras del músculo esquelético.
Un ejemplo de la expresión de una variante de etiquetado de la proteína muscular estructural α-actinina se muestra en la Figura 2. Esta proteína es conocida por ser un componente importante de la línea Z y, como tal, se utiliza habitualmente como marcador de este structure12. Transfectadas músculos FDB y IO con el plásmido pEGFPN1-α-actinin1 codificación para el consumo humano (no músculo) α-actinina marcados en la terminal C con EGFP. Seis días después de la transfección, se encontró que, según la evaluación de la distribución EGFP fluorescencia, α-actinina es principalmente expresada en bandas estrechas igualmente espaciados a lo largo del eje de la fibra. Una sola banda por sarcómero se ve (Figuras 2A y 2D). La colocalización de estas bandas con la Z-líneas se demuestra al comparar la distribución de EGFP fluorescencia con el grupo de autoayuda (Figura 2B) y di-8 ANEPPS (Figura 2E) imágenes. Como lo demuestra la superposición de imágenes (Figura 2 C), α-actinina-EGFP bandas se alternan con las bandas de los grupos de autoayuda, lo que indica que se encuentra a medio camino entre dos consecutivos M-bandas, coincidiendo con la ubicación de Z-líneas. En las fibras musculares transfectadas teñidas con di-8-ANEPPS, α-actinina-EGFP bandas se ven centrados entre cada par de túbulos T (Figura 2F) que se sabe que el flanco de la Z-líneas (es decir, separados por una distancia más corta), lo que indica que transgénicas α-actinina se dirige a la línea Z.
Expresión de DHPRα1s etiquetados en la N-terminal con EGFP
La eficiencia de transfección del músculo con pEGFPC1.1-DHPR 1s α se verifica en las imágenes TPLSM (por ejemplo, la Figura 3A) que muestra que la mayoría de las fibras expresan EGFP-DHPRα1s (una proteína de transmembrana). La característica más prominente de fibras transfectadas es el patrón de doble banda de EGFP fluorescencia (Figuras 3A y 3B), como sería el caso si esta proteína se dirigió a la T-túbulos. También se puede observar en la Figura 3 que, si bien las diferentes fibras mostrar varios niveles de intensidad de fluorescencia, el patrón de bandas de fluorescencia de una fibra individual parece mantenerse homogénea a lo largo de la fibra. A mayor aumento (Figura 3 B), se puede ver claramente que el espaciado desigual entre las bandas es similar a la observada en las fibras teñidas di-8-ANEPPS (por ejemplo, la Figura 2E). La superposición de imágenes (Figura 3B y 3E) muestran que las bandas de los grupos de autoayuda se encuentran dentro de la distancia más grande entre EGFP-DHPRα1s bandas, lo que corrobora que esta proteína se encuentra en la T-túbulos. Adicional FRET mediciones con el anión lipofílico no fluorescente DPA (datos no mostrados) demuestran una vez más que el resto de EGFP se encuentra dentro de unos pocos nanómetros de la pared interna de las membranas de los túbulos T '.
Localización y la evaluación funcional de la expresión de EYFP-clc1
Fibras transfectadas con pEYFP-CLc1, que codifica una construcción EYFP de etiquetado (en el N-terminal) de la canal de los músculos esqueléticos de cloruro (CLc1), pantalla de bandas EYFP de fluorescencia (Figura 4) con un patrón similar al observado para EGFP-DHPRα1s 'expresión (Figura 3) y que corresponde a la disposición de los túbulos T-tal como se ilustra con la tinción de di-8-ANEPPS (Figura 2E). Como era de esperar, la superposición de EYFP-clc1 (Figura 4) y las imágenes de los grupos de autoayuda (Figura 4) como se muestra en la plantilla (Figura 4C), muestran que las bandas de los grupos de autoayuda se centran en el espacio grande of EYFP entre bandas de fluorescencia.
Con el fin de evaluar si la expresión de EYFP-clc1 resulta en un aumento significativo en la conductancia de descanso de las fibras musculares, como se espera de la sobreexpresión de los canales de cloruro funcionales, las fibras musculares disociadas enzimáticamente del músculo FDB transfectadas y estudió sus propiedades electrofisiológicas utilizando una de dos microelectrodos montaje experimental descrito previamente 6,11,13. La Figura 5 muestra los resultados de dos fibras: una expresión de grandes cantidades de EYFP-clc1 según la evaluación global de las mediciones de intensidad de fluorescencia en un microscopio de fluorescencia estándar (no se muestra), y el otro es un control no transfectadas. El registro de la tensión en la Figura 5 (obtenida de la fibra muscular expresar EYFP-CLc1) demuestra que debido a la conductancia de descanso excesivo, la fibra casi no excitables. Pulsos de corriente de estímulo de hasta 400nA (0,5 ms) necesario para ser utilizado con el fin de obtener una respuesta activa muy pequeña (no rebasar los límites y Figura 5). Después de la sustitución de la solución de Tyrode externo a uno que contiene 500 mM de bloqueador del canal de cloruro de sodio 9-ACA, 200 nA pulsos actuales eran suficientes para provocar un potencial de acción (Figura 5), aunque mucho más lento y más amplio que los registrados en la fibra de control ( Figura 5C). Como era de esperar, además de 9-ACA tenía efectos mínimos sobre esta fibra control (Figura 5D).
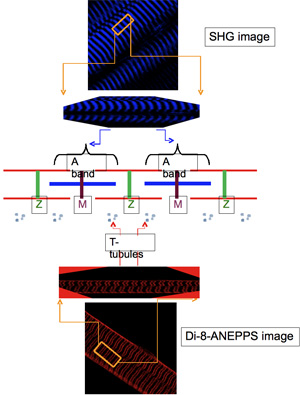
Figura 1. Transfección eficiencia del método de electroporación in vivo. Campo claro (A) y fluorescencia (B) imágenes de un músculo FDB transfectadas con PMR-mCherry. Días después de que el protocolo de electroporación: 12 días. Por favor, haga clic aquí para una versión ampliada de la figura 1.

Figura 2. Expresión y la orientación de α-actinina-EGFP en las fibras de FDB. Paneles A y B son EGFP fluorescencia y las imágenes de los grupos de autoayuda, respectivamente, de una fibra que expresan α-actinina-EGFP. Grupo C es una superposición de las imágenes A y B. Paneles D y E son las imágenes de fluorescencia de otra fibra que expresan α-actinina-EGFP y se tiñeron con di-8-ANEPPS, respectivamente. Grupo F es la superposición de imágenes en D y E. Días después de la electroporación protocolo: 6 días.

Figura 3. Expresión y la orientación de EGFP-DHPRα1s en las fibras de FDB. Grupo A, EGFP imagen de fluorescencia de un grupo de fibras que expresan EGFP-DHPRα1s. Grupo B es una ampliación de la plaza en el panel A fin de mostrar mejor el patrón de bandas de la expresión de la proteína. Grupo C es la imagen de los grupos de autoayuda correspondiente a la imagen en el panel A. Grupo D es la superposición de las imágenes A y C. Grupo E es una ampliación de la zona indicada en el panel D. Días después de que el protocolo de electroporación: 20 días.
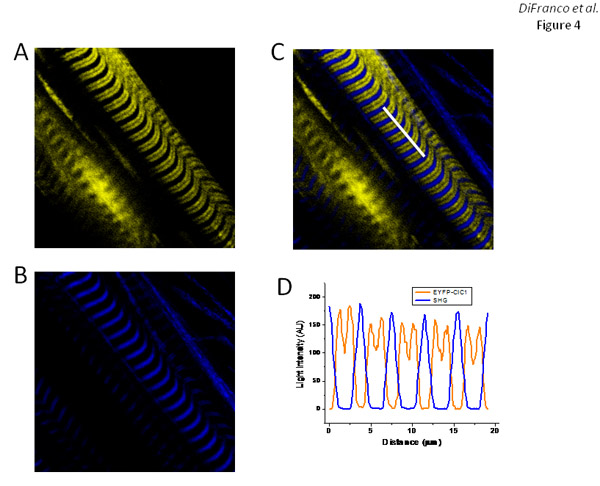
Figura 4. Expresión y la orientación de EYFP-clc1 en las fibras de FDB. Los grupos A y B son EYFP fluorescencia y las imágenes de SHG, respectivamente, de las fibras de expresar EYFP-CLc1. Grupo C es la superposición de las imágenes de los grupos A y B. Grupo D es un perfil de intensidad medido a lo largo de la línea blanca destaca en la imagen en el panel C. Días después de protocolo de electroporación: 7 días.
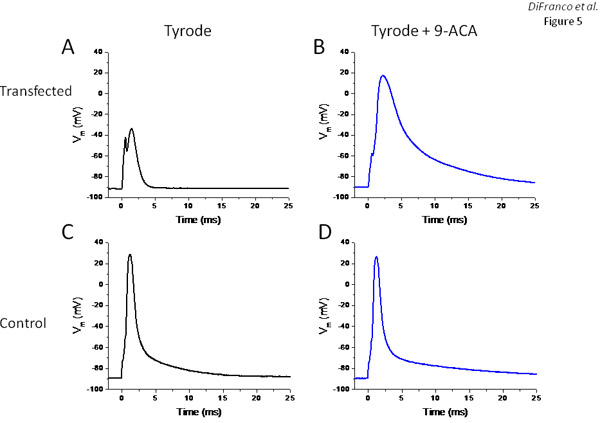
Figura 5. Fibras electrofisiológicos evaluación transgénicos que expresan EYFP-CLc1. Paneles A y B son los registros de tensión de una fibra de expresar EYFP-clc1 en respuesta a los pulsos de corriente antes y después del tratamiento con 9-ACA, respectivamente. Los paneles C y D son los registros de tensión (potenciales de acción) suscitó en respuesta a los pulsos de corriente en una fibra no transfectadas antes y después del tratamiento con 9-ACA, respectivamente.
Discusión
Se describe aquí los pasos detallados que deben seguirse para alcanzar la transfección eficaz de los plásmidos de ADN en las fibras del músculo esquelético en la electroporación in vivo. Las principales ventajas de nuestro enfoque es la simplicidad de implementación, y su mínima invasividad que se traduce en riesgo insignificante para la salud de los animales. En realidad, el anteriormente descrito protocolos de electroporación no implican mucho más que dos inyecciones subcutáneas por pie, s...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Agradecemos al Dr. T. Otis, del Departamento de Neurobiología de la UCLA, para compartir las instalaciones TPLSM con nosotros, el Dr. C. Fahlke, Instituto de Fisiología de la RWTH Aachen, Alemania, por la generosa donación del plásmido pEYFP-CLc1, y el Sr. . R. Serrano para soporte técnico. Este trabajo fue apoyado por subvenciones del NIH / NIAMS AR047664 subvenciones y AR54816.
Referencias
- Muangmoonchai, R., Wong, S., Smirlis, D., Phillips, I., Shephard, E. Transfection of liver in vivo by biolistic particle delivery. Molecular Biotechnology. 20 (2), 145-151 (2002).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Voltage-dependent dynamic FRET signals from the transverse tubules in mammalian skeletal muscle fibers. J Gen Physiol. 130 (6), 581-600 (2007).
- DiFranco, M., Neco, P., Capote, J., Meera, P., Vergara, J. L. Quantitative evaluation of mammalian skeletal muscle as a heterologous protein expression system. Protein Expression and Purification. 47 (1), 281-288 (2006).
- Meera, P., Dodson, P. D., Karakossian, M. H., Otis, T. S. Expression of GFP-tagged neuronal glutamate transporters in cerebellar Purkinje neurons. Neuropharmacology. 49 (6), 883-889 (2005).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Dynamic FRET Signals between DPA and the {alpha}1s and {beta}1a Subunits of the DHPR of Mammalian Skeletal Muscle. Biophys. J. 94, 2633-2633 (2008).
- Woods, C. E., Novo, D., DiFranco, M., Capote, J., Vergara, J. L. Propagation in the transverse tubular system and voltage dependence of calcium release in normal and mdx mouse muscle fibres. J Physiol. 568 (Pt 3), 867-880 (2005).
- DiFranco, M., Woods, C. E., Capote, J., Vergara, J. L. Dystrophic skeletal muscle fibers display alterations at the level of calcium microdomains. Proc Natl Acad Sci U S A. 105 (38), 14698-14703 (2008).
- Lueck, J. D., Mankodi, A., Swanson, M. S., Thornton, C. A., Dirksen, R. T. Muscle Chloride Channel Dysfunction in Two Mouse Models of Myotonic Dystrophy. J. Gen. Physiol. 129 (1), 79-94 (2007).
- Zipfel, W. R. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second harmonic generation. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7075-7080 (2003).
- Plotnikov, S. V., Millard, A. C., Campagnola, P. J., Mohler, W. A. Characterization of the Myosin-Based Source for Second-Harmonic Generation from Muscle Sarcomeres. Biophys J. 90 (2), 693-703 (2006).
- DiFranco, M., Capote, J., Vergara, J. L. Optical imaging and functional characterization of the transverse tubular system of mammalian muscle fibers using the potentiometric indicator di-8-ANEPPS. J Membr Biol. 208 (2), 141-153 (2005).
- Mills, M. Differential expression of the actin-binding proteins, {{alpha}}-actinin-2 and -3, in different species: implications for the evolution of functional redundancy. Hum. Mol. Genet. 10 (13), 1335-1346 (2001).
- Woods, C. E., Novo, D., DiFranco, M., Vergara, J. L. The action potential-evoked sarcoplasmic reticulum calcium release is impaired in mdx mouse muscle fibres. J Physiol. 557 (Pt 1), 59-75 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados