Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Трансфекция ДНК млекопитающих скелетных мышц использованием В Vivo Электропорация
В этой статье
Резюме
Мы описываем подробные процедуры для эффективной трансфекции ДНК плазмиды в волокнах мышц стопы живых мышах электропорации и последующей визуализации экспрессии белка с помощью флуоресцентной микроскопии.
Аннотация
Растущий интерес к клеточной биологии заключается в выражении transgenically изменение формы необходимых белков (например, флуоресцентной меткой конструкций и / или мутантных вариантов) с целью изучения их распределения эндогенных и функциональной значимости. Интересный подход, который был реализован для выполнения этой задачи в полностью дифференцированных клеток
протокол
Экспериментальные процедуры в естественных условиях электропорации FDB и IO мышцы
- Перед запуском в протоколах естественных электропорация, млекопитающих плазмид выражение должно быть усилено для получения концентрации в диапазоне до 2-5 мкг плазмиды / мкл ТЕ. Примечание: Мы обычно используют коммерческие наборы усиления и следовать процедурам производителя. Коммерческая плазмид выражение проведения работ ЦМВ промоутер очень хорошо в скелетных мышцах в естественных условиях трансфекции.
- Алиготе необходимого объема (10-20 мкл) плазмиды решение и сохранить его в два 0,5 мл Eppendorf трубки (по одному для каждой подножия мыши).
- Приготовьте раствор, содержащий 2 мг / мл гиалуронидазы в стерильных Tyrode.
- Использование обезболивающих окно, глубоко анестезию мыши, используя 4% изофлуран в O2 с утвержденным газовой машины анестезии. Место животное на грелку (37 ° С) и поддержания анестезии с использованием маски грызунов лицо. Монитор анестезии глубину ног рефлекс крайнем случае.
- Под наблюдение с рассечение микроскоп, вводят 10 мкл гиалуронидазы раствора под Сапоги одну ногу из мыши, используя один "длинный 33 калибр стерильной иглой. Проникают в кожу в точке, близкой к пятке стопы и заранее иглу подкожно к основанию пальцев в течение ~ 1 / 4 ".
- Повторите эту процедуру с другой ногой, если он того пожелает.
- Отключите анестезии и место мыши в клетке. Позвольте ему полностью восстановиться от анестезии.
- Через час анестезию животного во второй раз и поместите его на грелку. Следуя той же процедуре, описанной в растворе гиалуронидазы, вводить в общей сложности 20-50 мкг плазмидной ДНК (в зависимости от размера плазмиды построить). Общий объем инъекции должна быть не менее 20 мкл / фут. Примечание: при 15-20 L μ необходимо, желательно, чтобы закрыть кожу на точку входа иглы с тканями-клея.
- Отключите анестезии и место мыши в клетке. Позвольте ему полностью восстановиться от анестезии и подождать 10-15 мин.
- Анестезию животного в третий раз и поместите его на грелку.
- Выберите одну ногу животного. Разместите один позолоченный акупунктуры иглы под кожу на пятках, и второй у основания пальцев. Электроды ориентированы параллельно друг другу и перпендикулярно длинной оси стопы.
- Подключите глава иглы (электроды) к электрическим стимулятором с использованием микро-клип разъемы. Electroporate мышцы, применяя 20 импульсов, 20 мс по продолжительности / каждая, в 1 Гц. В зависимости от расстояния между электродами, амплитуда напряжения импульсов "корректируется (путем контроля с помощью осциллографа) с получением электрического поля ~ 100 В / см. Примечание: Нет сокращения в ответ на стимулы должны быть соблюдены, если уровень анестезия является адекватной.
- При желании, повторите описанные выше процедуры в контралатеральной ноги животного.
- Вернуться животных в клетку и один раз полностью оправился от наркоза поддерживать его под наблюдением. Обратите внимание: если процедура шло нормально, животное должно полностью восстановить подвижность в течение 30 минут, а потом готов быть отправлены обратно в комнату животных вивария. Инъекции гиалуронидазы и ДНК в сапоги не имеют заметных отрицательных последствий для животных. Как только оправился от наркоза, мыши способны иноходью обычно вокруг клетки. В качестве дополнительной меры предосторожности, добавить к питьевой воде животных Carprofen на 0,0027 мг / мл в течение 2 дней в качестве обезболивающего средства.
- Белки выражение может быть проанализированы 2-8 дней после трансфекции. Тем не менее, устойчивое выражение многих белков наблюдался в течение нескольких месяцев.
ПРИМЕЧАНИЕ: Все животные процедуры были одобрены Комитетом животных исследований Калифорнийского университета канцлера, как это предусмотрено Законом о защите животных и PHS политики на гуманное лечение и использования лабораторных животных.
Представитель Результаты:
Правильная реализация в естественных условиях электропорации процедуры, описанные выше, должны привести к эффективной трансфекции плазмиды в FDB и IO мышц. Тем не менее, эффективность выражение трансгенных вариантов белка, будет зависеть от плазмиды, размера и сложности белок, функциональные свойства белка, а также ряд других факторов вне нашего контроля. Как показано на рисунке 1 для мышц FDB электропорации в присутствии коммерческого плазмиды (PMR-mCherry) кодирования для белка mCherry, большинство из мышечные волокна, трансфицированных наш протокол, как свидетельствует тот факт, большинство из них дисплей красной флуоресценции. Это не исключает возможности того, что отдельные волокна имеют разную степень экспрессии белка, или несколько волокон не трансфицированных на всех 3. Следует бэлектронной отметить, что эффективное выражение большого количества флуоресцентных белков, таких как mCherry, EGFP, ECFP и EYFP, не наносит ущерба мышечных волокон возбудимость и возбуждение-сокращение сцепные свойства. На самом деле они ничем не отличаются от тех, в фиктивный трансфицированных мышцы (результаты не показаны).
Практические подходы используются для проверки локализованной выражение флуоресцентно с метками белков в скелетных мышечных волокон.
Внутриклеточной локализации ди заново выразил трансгенных белков обычно оценивается одновременное приобретение, использование TPLSM, флуоресцентные изображения соответствующих тегов и образы четко определенных маркеров клеточных структур. Наиболее типичные из этих последних являются: а) генерации второй гармоники (ГВГ) образов, которые возникают из-миозина анизотропии саркомерных полос (с центром в М-линии) и 9,10, б) ди-8-ANEPPS флуоресценции изображений, которые могут быть получены путем маркировки поверхности и поперечного трубчатые (Т-трубочки) системы мембраны мышечных волокон с этим impermeant потенциометрического dye11. В флуоресцентные изображения мышечных волокон окрашивали ди-8-ANEPPS, Т-трубочки выглядят как узкие полосы флуоресценции ориентированных приблизительно ортогонально продольной оси волокна. Эти полосы неравномерно расположенных друг от друга: они отделены друг от друга на большие расстояния, которая охватывает через М-линии, и короткий, растянутый на Z-линии 11.
Выражение и локализации α-актинина-EGFP в скелетных мышечных волокон.
Примером выражения с тегами вариант структурного белка мышц α-актинина показано на рисунке 2. Этот белок, как известно, основной компонент Z-линии и, как таковой, обычно используется в качестве маркера этого structure12. Мы трансфицированных FDB и IO мышцы плазмиды pEGFPN1-α-actinin1 кодировки для человека (не мышцы) α-актинина меткой на терминале C с EGFP. Через шесть дней после трансфекции, мы обнаружили, что, по оценке EGFP флуоресценции распределения α-актинина в основном выражается в узких полос, равномерно распределенных вдоль оси волокна. Одной полосой в саркомера видно (рис. 2А и 2D). Колокализации этих полос с Z-линиями показано, сравнивая распределение флуоресценции EGFP с SHG (рис. 2B) и ди-8-ANEPPS (рис. 2E) изображений. Как показали накладываемое изображение (рис. 2С), α-актинина-EGFP полосы чередуются с полосами ГВГ, указывая, что они расположены на полпути между двумя последовательными М-группы, совпадающие с расположением Z-линий. В трансфекции мышечных волокон, окрашенных с ди-8-ANEPPS, α-актинина-EGFP полосы видны по центру между каждой парой Т-трубочки (рис. 2F), который, как известно, фланг Z-линии (то есть, разделенные короткой дистанции), таким образом, указывая, что трансгенные α-актинина предназначен для Z-линии.
Выражение DHPRα1s меткой на N-конце с EGFP
Эффективность трансфекции мышц pEGFPC1.1-DHPR α 1s проверяется TPLSM изображений (например, рис 3А) показывают, что большинство волокна выразить EGFP-DHPRα1s (трансмембранный белок). Наиболее характерной особенностью трансфицированных волокон дважды полосчатые структуры EGFP флуоресценции (рис. 3A и 3B) как и следовало ожидать, если этот белок был нацелен на Т-трубочек. Это можно наблюдать и на рисунке 3 видно, что в то время как различные волокна отображать различные уровни интенсивности флуоресценции, полосчатые флуоресценции структуре отдельного волокна, кажется, сохранится однородный вдоль волокон. При большем увеличении (рис. 3В), это может быть хорошо видно, что неравномерное расстояние между полосами же, наблюдается в волокнах окрашенных ди-8-ANEPPS (например, рис 2E). Наложение изображений (рис. 3B & 3E) показывают, что ГВГ полосы расположены в пределах больших расстояния между EGFP-DHPRα1s полос, подтверждающие, что этот белок находится в Т-трубочек. Дополнительная FRET измерения с не-люминесцентные липофильный анион DPA-(данные не приведены) далее продемонстрировать, что фрагмент EGFP находится в пределах нескольких нанометров внутренней листовку мембраны Т-канальцев.
Локализация и функциональной оценки выражение EYFP-ClC1
Волокна, трансфицированных pEYFP-ClC1, который кодирует EYFP с метками построить (на N-терминал) из скелетных мышц канала хлорида (ClC1), дисплей EYFP полос флуоресценции (рис. 4А) с рисунком же, наблюдается EGFP-DHPRα1s 'выражение (рис. 3А) и соответствующее Т-трубочки расположение, как показано с ди-8-ANEPPS окрашивания (рис. 2Е). Как и ожидалось, наложение EYFP-ClC1 (рис. 4а) и ГВГ изображения (рисунок 4B), как показано в покрытии (рис. 4С), показывают, что ГВГ полосы с центром в большой интервал ое между EYFP полосы флуоресценции.
Для того, чтобы оценить, является ли выражение EYFP-ClC1 приводит к значительному увеличению отдыха проводимость мышечных волокон, как и ожидалось с гиперэкспрессией функциональных каналов хлорида, мы ферментативно диссоциированных мышечных волокон из трансфицированных мышц FDB и изучили их электрофизиологические свойства использованием двух микроэлектродов экспериментальной установки описаны ранее 6,11,13. На рисунке 5 показаны результаты двух волокон: одна выразив большое количество EYFP-ClC1 как оценено от глобального измерения интенсивности флуоресценции в стандартном флуоресцентного микроскопа (не показаны), а другой не-трансфицированных контроля. Напряжение запись на рисунке 5А (полученные из мышечных волокон выражения EYFP-ClC1) показывает, что из-за чрезмерного отдыха проводимости, волокна практически не возбудимый. Импульсы тока стимула до 400nA (0.5 мс), которые необходимы для использования в целях получения очень небольшой активный ответ (не перегибать палку, рис 5А). После замены внешнего решения Tyrode одному содержащей 500 мкМ блокатор канала хлорида 9-АСА, 200 нА импульсов тока было достаточно, чтобы вызвать потенциал действия (рис. 5Б), хотя и гораздо медленнее и более широкие, чем те, записанных в управление волокна ( Рис 5C). Как и ожидалось, добавление 9-АСА было минимальное воздействие на этот контроль волокна (рис. 5D).
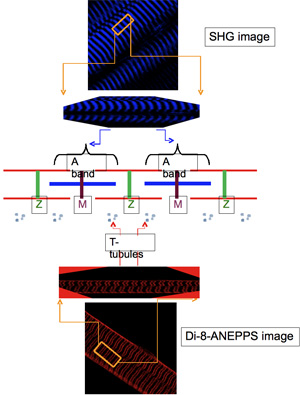
Рисунок 1. Трансфекция эффективность в естественных условиях электропорации метод. Светлое (А) и флуоресценции (б) изображений мышц FDB трансфицированных PMR-mCherry. Через несколько дней после электропорации протокола: 12 дней. Пожалуйста, нажмите здесь для увеличения фигуры 1.

Рисунок 2. Выражение и адресности α-актинина-EGFP в волокнах FDB. Панели и В EGFP флуоресценции и генерации второй гармоники изображения, соответственно, волокна выражения α-актинина-EGFP. Группа С наложением изображений в А и В. панели D и Е являются флуоресцентные изображения другого волокна выражения α-актинина-EGFP и окрашивали ди-8-ANEPPS, соответственно. Группа F является наложение изображений в D и Е. Через несколько дней после электропорации протокола: 6 дней.

Рисунок 3. Выражение и адресности EGFP-DHPRα1s в FDB волокон. Группа, EGFP флуоресценции образ группы волокон выражения EGFP-DHPRα1s. Группа B является расширение площади панели для того, чтобы лучше показать полосчатые структуры экспрессии белка. Группа С ГВГ образ, соответствующий изображению на панели А. Panel D является наложение изображений и C. группы Е является расширение зоны, указанные в панели дней после электропорации Д. протокола: 20 дней.
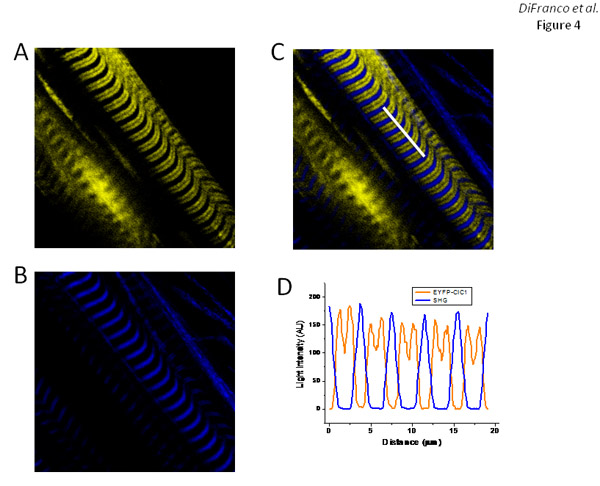
Рисунок 4. Выражение и адресности EYFP-ClC1 в FDB волокон. Панели и В EYFP флуоресценции и генерации второй гармоники изображения, соответственно, волокон выражения EYFP-ClC1. Группа С наложением изображения в панелях и Б. Panel D является профиль интенсивности измеряется вдоль белой линии выделяются изображения в панели дней после электропорации С. протокола: 7 дней.
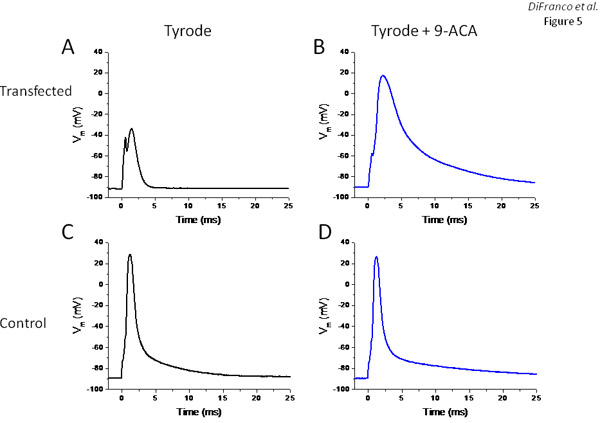
Рисунок 5. Электрофизиологические волокна оценки выражения трансгенных EYFP-ClC1. Панели и Б напряжения записи из волокна выражения EYFP-ClC1 в ответ на импульсы тока до и после лечения с 9-АСА, соответственно. Панели C и D. напряжения записей (потенциалы действия) вызвало в ответ на импульсы тока в не-трансфицированных волокно до и после лечения с 9-АСА, соответственно.
Обсуждение
Мы описываем здесь подробные шаги, которые следует соблюдать, чтобы достичь эффективной трансфекции ДНК плазмиды в скелетные мышечные волокна путем в естественных условиях электропорации. Основные преимущества нашего подхода являются простота реализации и ее минимальная инваз...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы благодарим д-р Т. Отис, Департамент нейробиологии, UCLA, для обмена TPLSM объекта с нами, д-р К. Fahlke, Институт физиологии, Аахена, Германия, за добрые пожертвования pEYFP-ClC1 плазмиды, и г-н . Р. Серрано для технической поддержки. Эта работа была поддержана грантами NIH / NIAMS гранты AR047664 и AR54816.
Ссылки
- Muangmoonchai, R., Wong, S., Smirlis, D., Phillips, I., Shephard, E. Transfection of liver in vivo by biolistic particle delivery. Molecular Biotechnology. 20 (2), 145-151 (2002).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Voltage-dependent dynamic FRET signals from the transverse tubules in mammalian skeletal muscle fibers. J Gen Physiol. 130 (6), 581-600 (2007).
- DiFranco, M., Neco, P., Capote, J., Meera, P., Vergara, J. L. Quantitative evaluation of mammalian skeletal muscle as a heterologous protein expression system. Protein Expression and Purification. 47 (1), 281-288 (2006).
- Meera, P., Dodson, P. D., Karakossian, M. H., Otis, T. S. Expression of GFP-tagged neuronal glutamate transporters in cerebellar Purkinje neurons. Neuropharmacology. 49 (6), 883-889 (2005).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Dynamic FRET Signals between DPA and the {alpha}1s and {beta}1a Subunits of the DHPR of Mammalian Skeletal Muscle. Biophys. J. 94, 2633-2633 (2008).
- Woods, C. E., Novo, D., DiFranco, M., Capote, J., Vergara, J. L. Propagation in the transverse tubular system and voltage dependence of calcium release in normal and mdx mouse muscle fibres. J Physiol. 568 (Pt 3), 867-880 (2005).
- DiFranco, M., Woods, C. E., Capote, J., Vergara, J. L. Dystrophic skeletal muscle fibers display alterations at the level of calcium microdomains. Proc Natl Acad Sci U S A. 105 (38), 14698-14703 (2008).
- Lueck, J. D., Mankodi, A., Swanson, M. S., Thornton, C. A., Dirksen, R. T. Muscle Chloride Channel Dysfunction in Two Mouse Models of Myotonic Dystrophy. J. Gen. Physiol. 129 (1), 79-94 (2007).
- Zipfel, W. R. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second harmonic generation. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7075-7080 (2003).
- Plotnikov, S. V., Millard, A. C., Campagnola, P. J., Mohler, W. A. Characterization of the Myosin-Based Source for Second-Harmonic Generation from Muscle Sarcomeres. Biophys J. 90 (2), 693-703 (2006).
- DiFranco, M., Capote, J., Vergara, J. L. Optical imaging and functional characterization of the transverse tubular system of mammalian muscle fibers using the potentiometric indicator di-8-ANEPPS. J Membr Biol. 208 (2), 141-153 (2005).
- Mills, M. Differential expression of the actin-binding proteins, {{alpha}}-actinin-2 and -3, in different species: implications for the evolution of functional redundancy. Hum. Mol. Genet. 10 (13), 1335-1346 (2001).
- Woods, C. E., Novo, D., DiFranco, M., Vergara, J. L. The action potential-evoked sarcoplasmic reticulum calcium release is impaired in mdx mouse muscle fibres. J Physiol. 557 (Pt 1), 59-75 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены