このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
使用して哺乳類の骨格筋のDNAトランスフェクションインビボでのエレクトロポレーション
要約
我々は、エレクトロポレーションと蛍光顕微鏡を用いたタンパク質発現のその後の可視化を使用して、生きたマウスの足の筋肉の繊維へのプラスミドDNAの効率的なトランスフェクションのための詳細な手順を説明します。
要約
細胞生物学への関心の高まりは、内因性の分布と機能的関連性を調べるために必須のタンパク質(例えば、蛍光標識の構造及び/または突然変異体)の遺伝子導入によって修飾された形態を発現させることである。完全に分化した細胞ではこの目的を達成するために実装されている面白いアプローチです
プロトコル
FDBとIO筋肉の in vivoエレクトロポレーションのための実験手順
- 生体内エレクトロポレーションプロトコルで開始する前に、哺乳動物発現プラスミドはTEの添加/プラスミド2から5μgまでの範囲で濃度を得るために増幅する必要があります注:我々は日常的に商業的な増幅キットを使用すると、メーカーの手順に従う。 in vivoでトランスフェクションの骨格筋で非常によく、CMVプロモーターの仕事を運ぶ商業発現プラスミド。
- 分注し、必要なプラスミド溶液の量(10〜20μl)を二0.5ミリリットルエッペンドルフチューブ(マウスの左右の足用)に保存します。
- 無菌タイロードで2 mg / mlのヒアルロニダーゼを含有する溶液を準備します。
- 麻酔ボックスを使用して、深く承認されたガス麻酔器とO2のイソフルランの4%を使用して、マウスを麻酔。加熱パッド(37 ° C)に動物を配置し、齧歯類の顔のマスクを使用して麻酔を維持する。つま先のピンチの反射によって麻酔深度をモニターする。
- 解剖顕微鏡で観察下、1"長い33ゲージ滅菌針を用いてマウスの片足の足蹠の下ヒアルロニダーゼ溶液10μLを注入する。足のかかとに近い時点で皮膚に浸透すると〜1 / 4"のための足の指の基部に向かって皮下注射針を進める。
- 所望であれば他の足で手順を繰り返します。
- 麻酔を外し、ケージの中にマウスを置きます。それは完全に麻酔から回復することができます。
- 一時間後、二度目の動物を麻酔し、加熱パッド上に置きます。ヒアルロニダーゼ溶液について説明したのと同じ手順に続いて、プラスミドDNA(プラスミド構築体のサイズに応じて)の20〜50μgの合計を注入する。総注入量は、20未満μL/フィートにする必要があります注:15〜20μLが必要な場合に、それは組織接着剤とニードルのエントリポイントで皮膚を閉じることをお勧めします 。
- 麻酔を外し、ケージの中にマウスを置きます。それは完全に麻酔から回復し、10〜15分間を待つことができます。
- 三度目の動物を麻酔し、加熱パッド上に置きます。
- 動物の片足を選択してください。片足は金メッキ鍼のかかとの皮膚の下に針、そしてつま先の底部の二番目。電極は足の長軸に互いに平行に配向し、垂直である。
- マイクロクリップコネクタを使用して電気刺激装置に針(電極)のヘッドを接続します。 1Hzで、20パルス、持続時間/各20ミリ秒を適用することにより、筋肉をエレクトロ。電極の間隔に応じて、パルスは電圧振幅は、〜100 V / cmの電界を生成する(オシロスコープで監視することで)調整されます注:。刺激に対する応答のない収縮は、のレベルなら認めてはならない麻酔で十分です。
- その必要に応じて、動物の反対の足で上記の手順を繰り返します。
- そのケージに動物を返し、一度、完全に麻酔から回復した観察の下でそれを維持する。注:この手順が正常に行けば、動物は30分以内に完全な移動性を取り戻し、その後ビバリウムでの動物の部屋に戻って送信する準備ができているはず。足蹠におけるヒアルロニダーゼとDNAの注射は、動物に顕著な悪影響はありません。一度麻酔から回復、マウスがケージの周りには通常アンブルすることができます。追加の予防措置として、鎮痛剤として2日間、0.0027 mg / mlの時の動物のカルプロフェンの飲料水に加える。
- タンパク質発現は2-8日間トランスフェクション後に測定することができる。しかし、多くのタンパク質の持続的な発現は、月間観察された。
注:動物福祉法と実験動物の愛護ケアや使用に関するPHS方針で義務付けられてすべての動物の手順はUCLA学長の動物研究委員会によって承認された。
代表的な結果:
上記のin vivoエレクトロポレーションの手順での正しい実装はFDBとIO筋肉におけるプラスミドの効果的なトランスフェクションになるはずです。しかしながら、トランスジェニック蛋白質の変異体の発現の効率は、当社のコントロールのうちタンパク質、タンパク質の機能的特性、および他の変数の数のプラスミド、大きさと複雑さに依存します。 mCherryタンパク質のための市販のプラスミド(PMR - mCherry)符号化の存在下でエレクトロポFDB筋肉のために図1に示すように、それらのほとんどが赤色蛍光を表示するという事実によって示されているように、筋線維のほとんどは、我々のプロトコルをトランスフェクトされています。これにより、個々の繊維は、タンパク質の発現の程度が異なるを示すという可能性を除外しない、またはいくつかの繊維がすべて3でトランスフェクトされていないこと。それはBすべきeはそのようなmCherry、EGFP、ECFP、およびEYFPの蛍光タンパク質の大量の効率的な発現は、筋線維"興奮性と興奮収縮連関の特性を損なわないことを指摘した。実際に、彼らは、偽トランスフェクトした筋肉(結果は示していない)のものと区別がつかない。
骨格筋線維の蛍光タグタンパク質の局所的発現を確認するために使用される実用的なアプローチ。
ディノ ボ発現するトランスジェニック蛋白質の細胞内局在は、日常的に細胞構造のよく同定されたマーカーのそれぞれのタグと画像のTPLSM、蛍光画像を使用して、取得同時によって評価されます。これらの後者の最も典型的には以下のとおりです。)第二高調波発生(SHG)サルコメアのミオシン異方性バンド(M -ラインを中心に)9,10から生じる画像、および、b)のジ- 8 - ANEPPS蛍光表面とこの透過性の電位差dye11と筋線維の膜横断管状(T管)システムを標識することにより得られる画像を、。ジ- 8 - ANEPPSで染色した筋線維の蛍光画像では、T -細管は、ファイバーの長軸にほぼ直交する蛍光指向の狭いバンドとして表示されます。これらのバンドは、不均等に互いに離間している:彼らは、M -ラインにまたがる長距離、およびZ - 11行にまたがる短いもので区切られています。
骨格筋線維におけるα-アクチニン- EGFPの発現と局在。
構造的な筋肉の蛋白質α-アクチニンのタグ付きバリアントの発現の例を図2に示されています。このタンパク質は、そのように、日常的にこのstructure12のマーカーとして使用される、Z線の主要なコンポーネントであることが知られており、されています。我々は、EGFPをC末端にタグ付けされた人間(非筋)のためのプラスミドpEGFPN1 -α- actinin1エンコーディングα-アクチニンとFDBとIO筋肉をトランスフェクション。六日間トランスフェクション後、我々は、α-アクチニンがほとんど均等に繊維軸に沿って等間隔に狭い帯域で発現されるEGFP蛍光の分布、によって評価することを見出した。サルコメアごとに単一のバンドが(図2A&2D)見られている。 Z -ラインと、これらのバンドの共局在は、SHG(図2B)およびジ- 8 - ANEPPS(図2E)画像でEGFP蛍光の分布を比較することによって実証される。として彼らはZ -ラインの位置と一致する、つの連続したM -バンドの中間に位置していることを示すオーバーレイ画像(図2C)、SHGのバンドと交互にα-アクチニン- EGFPのバンド、で示される。ジ- 8 - ANEPPSで染色したトランスフェクトされた筋線維では、α-アクチニン- EGFPのバンドは、側面にZ -ラインを(つまり、より短い距離で区切られた)が知られているT -細管(図2F)の各ペア間に集中見られているしたがって、遺伝子組換えα-アクチニンはZ線を対象としていることを示している。
EGFPとのN末端にタグDHPRα1sの発現
pEGFPC1.1 - DHPRα1Sと筋肉のトランスフェクションの効率は、それを示すTPLSMの画像(図3A)で確認されているほとんどの繊維が発現するEGFP -DHPRα1s(膜貫通型タンパク質)。トランスフェクトされた繊維の最も顕著な特徴は、このタンパク質は、T -細管をターゲットとした場合に予想されるとしてEGFP蛍光(図3A&3B)の二重の縞模様のパターンです。それはまた別の繊維が蛍光強度の様々なレベルを表示しながら、個々の繊維の縞模様の蛍光パターンは、繊維に沿って均質に維持しているように見えることが図3で観察することができます。より高い倍率(図3B)で、それははっきりとバンドの間で不均等な間隔は、ジ- 8 - ANEPPS(例えば図2E)ステンドグラス繊維で観察されたのと似ていることが分かる。オーバーレイ画像(図3B&3E)は、このタンパク質は、T -細管に位置していることを裏付ける、SHGのバンドがEGFP -DHPRα1sバンドの間に大きな間隔内に配置されていることを示しています。追加は、非蛍光性親油性陰イオンで測定をFRETのDPA -(データは示さず)さらにEGFPの部分はT -細管"膜の内側リーフレットの数ナノメートルの範囲内であることを示している。
ローカライゼーションとEYFP - ClC1の発現の機能評価
EGFP -DHPRα1sで観察されたものと同様のパターンでEYFP -タグ付けされた骨格筋塩素チャネル(ClC1)の構造(N末端 )、ディスプレイEYFP蛍光のバンド(図4A)をコードするpEYFP - ClC1、でトランスフェクション繊維"表現(図3A)およびジ- 8 - ANEPPS染色(図2E)で示すように、T管の配置に対応する。として期待されるオーバーレイ(図4C)に示すように、EYFP - ClC1(図4A)とSHG画像(図4B)の重畳は、SHGのバンドが大間隔Oを中心としていることを示していますEYFP蛍光バンドの間にfを。
として機能する塩素イオンチャンネルの過剰発現から期待される筋線維の静止コンダクタンスの有意な増加でEYFP - ClC1結果、発現するかどうかを評価するために、我々トランスフェクトされたFDBの筋肉から酵素的に解離筋線維とそれらの電気生理学的特性を研究二微小電極を用いた実験では、以前に6,11,13説明した。標準的な蛍光顕微鏡の世界的な蛍光強度の測定(図示せず)から評価されるようにEYFP - ClC1を大量に発現している一つであり、他は非トランスフェクションのコントロールである:図5は、2ファイバからの結果を示しています。図5Aに電圧レコードが(EYFP - ClC1を発現している筋線維から得られる)過度の安静時のコンダクタンスが原因でそれを示し、繊維はほとんど非興奮です。最大400nA(0.5msの)の現在の刺激パルスは非常に小さいアクティブレスポンスを(オーバシュート、図5A)引き出すために使用する必要がありました。コントロールの繊維に記録されたものよりはるかに遅いと広いもののクロライドチャネルブロッカー9 - ACAの500μMを含むものへの外部タイロード溶液の交換後、200 nAの電流パルスは、活動電位を(図5B)誘発するのに十分であった(図5C)。予想通り、9 - ACAの添加は、このコントロールの繊維(図5D)に最小限の影響を持っていた。
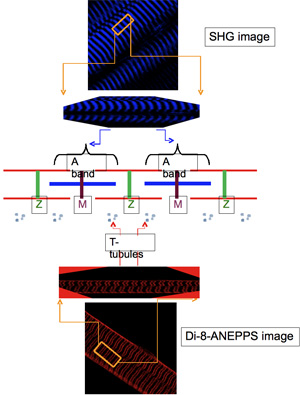
図1 生体内エレクトロポレーション法のトランスフェクション効率が。明(A)および蛍光(B)FDBの筋肉の画像は、PMR - mCherryでトランスフェクション。エレクトロポレーションプロトコルの後の日数:12日。してくださいここをクリックして図1の拡大版のために。

図2 の発現とFDBの繊維のα-アクチニン- EGFPの標的。パネルAおよびBは、α-アクチニン- EGFPを発現する繊維で、それぞれ、EGFP蛍光とSHGイメージです。パネルCは、AとBのパネルDとEの画像の重ね合わせであり、それぞれ、ジ- 8 - ANEPPSとα-アクチニン- EGFPとステンドグラスを表現する別の繊維の蛍光イメージです。 6日間:パネルFは、エレクトロポレーションプロトコルの後にDとEの日の画像の重ね合わせです。

図3 の発現とFDB繊維にEGFP -DHPRα1sの標的 。パネルA、EGFP -DHPRα1sを表現する繊維のグループのEGFP蛍光画像。パネルBは、優れた蛋白質の発現の縞模様のパターンを表示するために、パネル内の正方形の拡大です。パネルCはパネルAのパネルDの画像に対応するSHGイメージなのは画像の重ね合わせであり、C.パネルEは、エレクトロポレーションプロトコルの後にパネルD.の日に示された領域の拡大である:20日。
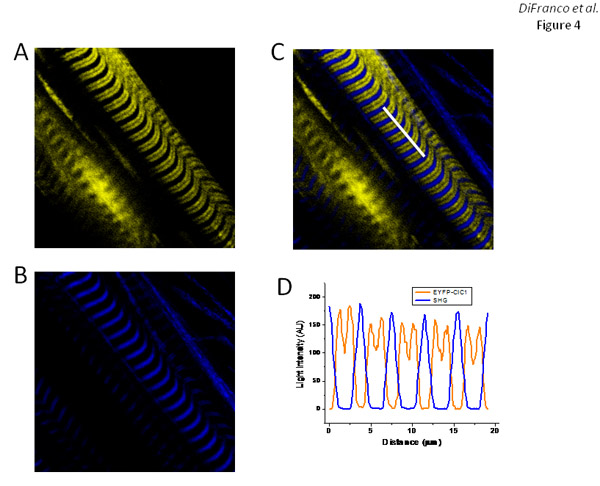
図4 の発現とFDB繊維でEYFP - ClC1の標的 。パネルAおよびBは、EYFP - ClC1を表現する繊維のそれぞれEYFPの蛍光とSHG画像、、です。パネルCは、パネルでの画像の重ね合わせであるとB.パネルDは、エレクトロポレーションプロトコルの後にパネルC.の日の画像でハイライトされて白い線に沿って測定された強度のプロファイルです:7日間。
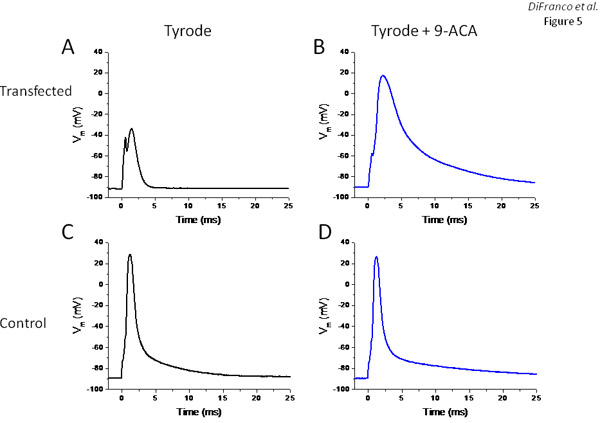
図5 トランス ジェニックEYFP - ClC1。パネルを表現する電気生理学的評価の繊維は、AとBはそれぞれ、9 - ACAによる治療の前と後の電流パルスに応答して、EYFP - ClC1を発現している繊維から電圧レコードです。パネルCとDは電圧レコードである(活動電位)がそれぞれ、9 - ACAによる治療の前と後の非トランスフェクション光ファイバで電流パルスに応答して誘発した。
ディスカッション
ここでは、in vivoでのエレクトロポレーションのことで骨格筋線維へのDNAプラスミドの効果的なトランスフェクションを達成するために従わなければならない詳細な手順を説明します。我々のアプローチの主な利点は、動物にごくわずかの健康被害をもたらすの実装のシンプルさ、そしてその最小限の侵襲です。現実には、上述のエレクトロポレーションプロトコルは、麻酔下の...
開示事項
The authors have nothing to disclose.
謝辞
私達は私達とTPLSM施設を共有するために博士T.オーティス、神経生物学、UCLAの部、感謝、博士C. pEYFP - ClC1プラスミドの種類の寄付のためのFahlke、生理学研究所、アーヘン工科大学、ドイツ、、と氏技術サポートのため。R.セラーノ。この作品は、NIH / NIAMS助成AR047664とAR54816からの補助金によって支えられている。
参考文献
- Muangmoonchai, R., Wong, S., Smirlis, D., Phillips, I., Shephard, E. Transfection of liver in vivo by biolistic particle delivery. Molecular Biotechnology. 20 (2), 145-151 (2002).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Voltage-dependent dynamic FRET signals from the transverse tubules in mammalian skeletal muscle fibers. J Gen Physiol. 130 (6), 581-600 (2007).
- DiFranco, M., Neco, P., Capote, J., Meera, P., Vergara, J. L. Quantitative evaluation of mammalian skeletal muscle as a heterologous protein expression system. Protein Expression and Purification. 47 (1), 281-288 (2006).
- Meera, P., Dodson, P. D., Karakossian, M. H., Otis, T. S. Expression of GFP-tagged neuronal glutamate transporters in cerebellar Purkinje neurons. Neuropharmacology. 49 (6), 883-889 (2005).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Dynamic FRET Signals between DPA and the {alpha}1s and {beta}1a Subunits of the DHPR of Mammalian Skeletal Muscle. Biophys. J. 94, 2633-2633 (2008).
- Woods, C. E., Novo, D., DiFranco, M., Capote, J., Vergara, J. L. Propagation in the transverse tubular system and voltage dependence of calcium release in normal and mdx mouse muscle fibres. J Physiol. 568 (Pt 3), 867-880 (2005).
- DiFranco, M., Woods, C. E., Capote, J., Vergara, J. L. Dystrophic skeletal muscle fibers display alterations at the level of calcium microdomains. Proc Natl Acad Sci U S A. 105 (38), 14698-14703 (2008).
- Lueck, J. D., Mankodi, A., Swanson, M. S., Thornton, C. A., Dirksen, R. T. Muscle Chloride Channel Dysfunction in Two Mouse Models of Myotonic Dystrophy. J. Gen. Physiol. 129 (1), 79-94 (2007).
- Zipfel, W. R. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second harmonic generation. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7075-7080 (2003).
- Plotnikov, S. V., Millard, A. C., Campagnola, P. J., Mohler, W. A. Characterization of the Myosin-Based Source for Second-Harmonic Generation from Muscle Sarcomeres. Biophys J. 90 (2), 693-703 (2006).
- DiFranco, M., Capote, J., Vergara, J. L. Optical imaging and functional characterization of the transverse tubular system of mammalian muscle fibers using the potentiometric indicator di-8-ANEPPS. J Membr Biol. 208 (2), 141-153 (2005).
- Mills, M. Differential expression of the actin-binding proteins, {{alpha}}-actinin-2 and -3, in different species: implications for the evolution of functional redundancy. Hum. Mol. Genet. 10 (13), 1335-1346 (2001).
- Woods, C. E., Novo, D., DiFranco, M., Vergara, J. L. The action potential-evoked sarcoplasmic reticulum calcium release is impaired in mdx mouse muscle fibres. J Physiol. 557 (Pt 1), 59-75 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved