É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Transfecção de DNA de mamíferos usando músculos esqueléticos In Vivo Eletroporação
Neste Artigo
Resumo
Descrevemos os procedimentos detalhados para a transfecção eficiente de DNA plasmidial nas fibras dos músculos do pé de ratos ao vivo usando o eletroporação ea visualização posterior de expressão da proteína através de microscopia de fluorescência.
Resumo
A crescente interesse em biologia celular é a de expressar formas transgenicamente modificado de proteínas essenciais (por exemplo, constrói fluorescente etiquetado e / ou variantes mutantes), a fim de investigar sua distribuição endógenos e relevância funcional. Uma abordagem interessante que foi implementada para cumprir este objectivo em células totalmente diferenciadas é o
Protocolo
Procedimentos experimentais para a eletroporação in vivo de músculos FDB e IO
- Antes de iniciar o em protocolos de eletroporação in vivo, plasmídeos de expressão de mamífero deve ser amplificado para produzir concentração na faixa de 2-5 mg para Nota plasmídeo / mL de TE:. Rotineiramente usar kits de amplificação comerciais e seguir os procedimentos do fabricante. Comercial plasmídeos expressão carregando o trabalho promotor CMV muito bem no músculo esquelético em transfections vivo.
- Volume da alíquota necessária (10-20 mL) da solução de plasmídeo e salve-o em dois tubos Eppendorf de 0,5 ml (um para cada pé do mouse).
- Prepare uma solução contendo 2 hialuronidase mg / ml em Tyrode estéril.
- Usando uma caixa de anestesiar, profundamente anestesiar um rato usando 4% de isoflurano em O2 com uma máquina aprovado gás anestésico. Colocar o animal em uma almofada de aquecimento (37 ° C) e manter a anestesia usando uma máscara facial de roedores. Monitorar a profundidade anestésica por reflexo pitada dedo do pé.
- Sob observação com um microscópio de dissecção, injetar 10 mL da solução de hialuronidase sob a footpads de um dos pés do mouse usando um 1 "agulha de calibre 33 longa estéril. Penetrar na pele em um ponto perto do calcanhar do pé e avançar a agulha por via subcutânea para a base dos dedos dos pés para ~ 1 / 4 ".
- Repita o procedimento com o outro pé se assim o desejar.
- Desligue a anestesia e coloque o mouse em uma gaiola. Permita que ele se recuperar totalmente da anestesia.
- Após uma hora, anestesiar o animal para uma segunda vez e coloque-o no bloco de aquecimento. Seguindo o mesmo procedimento descrito para a solução de hialuronidase, injetar um total de 20-50 mg do DNA plasmidial (dependendo do tamanho da construção do plasmídeo). O volume de injeção total deve ser inferior a 20 mL / pé. Nota: quando L μ 15-20 é necessário, é aconselhável fechar a pele no ponto de entrada da agulha com tecido cola.
- Desligue a anestesia e coloque o mouse em uma gaiola. Permita que ele se recuperar totalmente da anestesia e esperar por 10-15 min.
- Anestesiar o animal pela terceira vez e coloque-o no bloco de aquecimento.
- Selecione um pé do animal. Coloque uma agulha de acupuntura banhado a ouro sob a pele do calcanhar, e uma segunda na base dos dedos dos pés. Eletrodos são orientados paralelamente entre si e perpendicular ao eixo longitudinal do pé.
- Ligue a cabeça das agulhas (eletrodos) para o estimulador elétrico que utiliza micro-clip conectores. Electroporate os músculos através da aplicação de 20 pulsos, 20 ms de duração / cada, em 1Hz. Dependendo do espaçamento dos eletrodos, amplitude da tensão dos pulsos é ajustado (através do monitoramento com um osciloscópio) para produzir um campo elétrico de 100 V ~ Nota / cm:. Não contrações em resposta aos estímulos devem ser observados se o nível de A anestesia é adequada.
- Se assim o desejar, repita os procedimentos acima no pé contralateral do animal.
- Devolver o animal para sua gaiola e uma vez totalmente recuperado da anestesia mantê-lo sob observação. Nota: se o procedimento foi normal, o animal deve recuperar a mobilidade total dentro de 30 minutos e depois está pronto para ser enviado de volta para a sala de animais no biotério. As injeções de hialuronidase e DNA no footpads não têm perceptível efeitos adversos sobre os animais. Uma vez recuperado da anestesia, os ratos são capazes de amble normalmente ao redor da gaiola. Como uma precaução adicional, adicionar à água potável do carprofeno animais em 0,0027 mg / ml durante 2 dias como um analgésico.
- Expressão da proteína pode ser analisada 2-8 dias após a transfecção. No entanto, a expressão sustentada de muitas proteínas tem sido observado por vários meses.
NOTA: Todos os procedimentos animais foram aprovados pela Research o chanceler UCLA Animal da Comissão, como manda a Lei do Bem-Estar Animal e do PHS Política de Assistência Humanitária e Uso de Animais de Laboratório.
Resultados representativos:
A correcta aplicação da eletroporação in vivo nos procedimentos descritos acima devem resultar na transfecção de plasmídeos eficaz nos músculos FDB e IO. No entanto, a eficiência de expressão de variantes de proteínas transgénicas dependerá do plasmídeo, o tamanho ea complexidade da proteína, as propriedades funcionais da proteína, e uma série de outras variáveis fora de nosso controle. Como ilustrado na Figura 1 para um músculo FDB electroporated na presença de um comercial de codificação (PMR-mCherry) plasmídeo para a proteína mCherry, a maioria das fibras musculares são transfectadas com nosso protocolo, como ilustrado pelo fato de a maioria deles mostrar fluorescência vermelha. Isso não exclui a possibilidade de que as fibras individuais apresentam diferentes graus de expressão da proteína, ou que não são poucas fibras transfectadas em todos os três. Deve-be observou que a expressão eficiente de grandes quantidades de proteínas fluorescentes como mCherry, EGFP, ECFP, e EYFP, não prejudica a excitabilidade das fibras musculares e propriedades acoplamento excitação-contração. Na verdade, eles são indistinguíveis daqueles nos músculos farsa transfectadas (resultados não mostrados).
Abordagens práticas utilizadas para verificar a expressão de proteínas fluorescentes localizadas-marcado em fibras musculares esqueléticas.
A localização intracelular do di novo expressaram proteínas transgênicas é regularmente avaliada pelo simultânea aquisição, utilizando a TPLSM, imagens fluorescentes das tags e imagens respectivas de marcadores bem identificados das estruturas celulares. O mais típico destes últimos são: a) geração de segundo harmônico (SHG) imagens, que surgem a partir da anisotropia miosina do sarcômero A bandas (centrado no M-lines) 9,10 e, b) di-8-ANEPPS fluorescência imagens, que podem ser obtidos por rotulagem a superfície e transversal tubular (túbulos T) do sistema de membranas das fibras musculares com este dye11 impermeant potenciométrica. Em imagens de fluorescência de fibras musculares coradas com di-8-ANEPPS, o T-túbulos aparecem como faixas estreitas de fluorescência orientada aproximadamente ortogonal ao eixo longo da fibra. Estas bandas são desigualmente espaçadas umas das outras: elas são separadas por uma longa distância que se estende por todo o M-linhas, e um curta que se estende por todo o 11 Z-line.
Expressão e localização de α-actinina-EGFP em fibras musculares esqueléticas.
Um exemplo da expressão de uma variante com a tag da proteína muscular estruturais α-actinina é mostrado na Figura 2. Esta proteína é conhecida por ser um dos principais componentes do Z-line e, como tal, é rotineiramente utilizado como um marcador deste structure12. Nós transfectadas músculos FDB e IO com a codificação pEGFPN1-α-actinin1 plasmídeo para consumo humano (músculo não-) α-actinina marcados no terminal C com EGFP. Seis dias após a transfecção, descobrimos que, avaliado pela EGFP distribuição de fluorescência, α-actinina é principalmente expresso em faixas estreitas igualmente espaçados ao longo do eixo da fibra. A única banda por sarcômero é visto (Figuras 2A e 2D). A co-localização dessas bandas com o Z-linhas é demonstrada comparando a distribuição de EGFP fluorescência com o SHG (Figura 2B) e di-8-ANEPPS (Figura 2E) imagens. Como mostrado pela imagem de sobreposição (Figura 2C), α-actinina-EGFP bandas se alternam com as bandas SHG, indicando que eles estão localizados a meio caminho entre dois períodos consecutivos de M-bandas, coincidindo com a localização do Z-lines. Nas fibras musculares transfectadas corados com di-8-ANEPPS, α-actinina-EGFP bandas são vistos centrado entre cada par de túbulos T (Figura 2F) que são conhecidos para flanquear a Z-linhas (ou seja, separadas por uma distância mais curta), indicando assim que transgênicos α-actinina é direcionado para o Z-line.
Expressão de DHPRα1s marcados no N-terminal com EGFP
A eficiência de transfecção muscular com pEGFPC1.1-DHPR α 1s é verificada em imagens TPLSM (eg Figura 3A), mostrando que a maioria das fibras expressar EGFP-DHPRα1s (uma proteína transmembrana). A característica mais proeminente de fibras transfectadas é o padrão duplo em faixas de EGFP fluorescência (Figuras 3A & 3B), como seria de esperar se esta proteína foi voltado para o T-túbulos. Também pode ser observado na Figura 3 que, embora diferentes fibras mostrar vários níveis de intensidade de fluorescência, o padrão de bandas de fluorescência de uma fibra individual parece ser mantida homogênea ao longo da fibra. Na maior ampliação (Figura 3B), pode ser visto claramente que o espaçamento desigual entre as bandas é semelhante à observada em fibras coradas di-8-ANEPPS (eg Figura 2E). As imagens de sobreposição (Figura 3B e 3E) mostram que as bandas SHG estão localizados dentro do maior espaçamento entre EGFP-DHPRα1s bandas, corroborando que esta proteína está no T-túbulos. Adicionais FRET medições com o ânion não-fluorescentes lipofílico DPA (dados não mostrados) demonstrar ainda mais que a metade está dentro de EGFP alguns nanômetros do folheto interno de membranas túbulos T '.
Localização e avaliação funcional da expressão de EYFP-ClC1
Fibras transfectadas com pEYFP-ClC1, que codifica uma construção EYFP-tagged (no N-terminal) do canal de cloreto de músculo esquelético (ClC1), bandas de mostrar EYFP de fluorescência (Figura 4A) com um padrão semelhante ao observado para EGFP-DHPRα1s 'expressão (Figura 3A) e correspondentes ao arranjo dos túbulos T, conforme ilustrado com di-8-ANEPPS coloração (Figura 2E). Como esperado, a sobreposição de EYFP-ClC1 (Figura 4A) e imagens de SHG (Figura 4B), como mostrado na overlay (Figura 4C), mostram que as bandas SHG estão centradas na grande espaçamento of entre bandas EYFP fluorescência.
, A fim de avaliar se a expressão de EYFP-ClC1 resulta em um aumento significativo na condutância de descanso das fibras musculares, como esperado a partir da superexpressão de canais de cloro funcional, fibras musculares enzimaticamente dissociada do músculo FDB transfectadas e estudou as suas propriedades eletrofisiológicas usando uma configuração de dois microeletrodos experimental descrito anteriormente 6,11,13. Figura 5 mostra os resultados de duas fibras: uma expressando uma grande quantidade de EYFP-ClC1 avaliado a partir de medições globais intensidade de fluorescência em um microscópio de fluorescência padrão (não mostrado), eo outro é um controle não-transfectadas. O registro de tensão na Figura 5A (obtido a partir da fibra muscular expressar EYFP-ClC1) demonstra que, devido ao excesso de condutância em repouso, a fibra é quase não-excitáveis. Pulsos de estímulo de corrente de até 400nA (0,5 ms) necessário para ser usado a fim de obter uma resposta muito pequena ativa (sem overshoot Figura 5A). Após a substituição da solução de Tyrode externo para um contendo 500 mM do bloqueador dos canais de cloreto de sódio 9-ACA, 200 pulsos atuais nA foram suficientes para provocar um potencial de ação (Figura 5B), embora muito mais lento e mais amplo do que os registrados na fibra de controle ( Figura 5C). Como esperado, a adição de 9 ACA teve efeitos mínimos sobre esta fibra controle (Figura 5D).
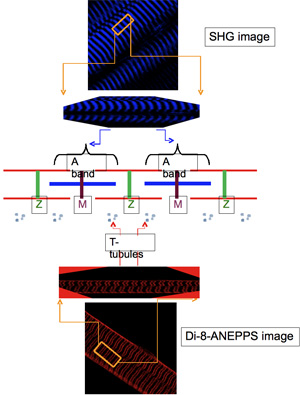
Figura 1. Eficiência Transfection do método de eletroporação in vivo. Brightfield (A) e de fluorescência (B) imagens de um músculo FDB transfectadas com pmr mCherry. Dias após o protocolo de eletroporação: 12 dias. Por favor, clique aqui para uma versão ampliada da figura 1.

Figura 2. Expressão e direcionamento de α-actinina-EGFP em fibras FDB. Painéis A e B são EGFP fluorescência e imagens SHG, respectivamente, de uma fibra expressando α-actinina-EGFP. Painel C é uma superposição das imagens em A e B. Os painéis D e E são as imagens de fluorescência de outra fibra expressando α-actinina-EGFP e corados com di-8-ANEPPS, respectivamente. Painel F é a superposição de imagens em D e E. Dias após eletroporação protocol: 6 dias.

Figura 3. Expressão e direcionamento de EGFP-DHPRα1s em fibras FDB. Painel A, EGFP imagem da fluorescência de um grupo de fibras expressando EGFP-DHPRα1s. Painel B é uma ampliação da praça no painel A, a fim de mostrar melhor o padrão de bandas da expressão da proteína. Painel C é a imagem SHG correspondente à imagem no painel A. Painel D é a sobreposição das imagens A e C. Painel E é um alargamento da área indicada no painel de D. Dias após o protocolo de eletroporação: 20 dias.
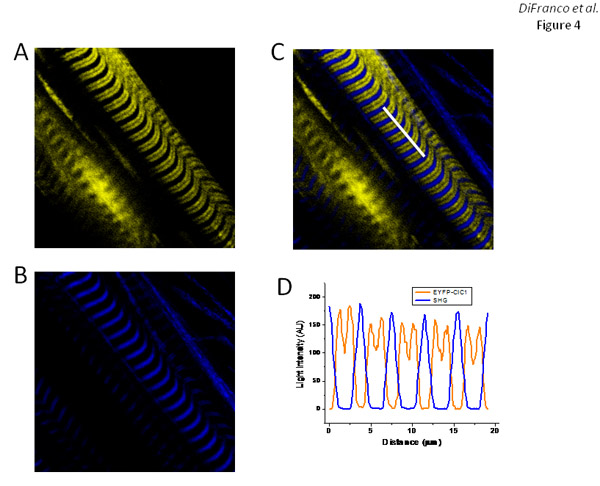
Figura 4. Expressão e direcionamento de EYFP-ClC1 em fibras FDB. Os painéis A e B são EYFP fluorescência e imagens SHG, respectivamente, de fibras expressando EYFP-ClC1. Painel C é a superposição das imagens em painéis A e B. Painel D é um perfil de intensidade medida ao longo da linha branca em destaque na imagem no painel C. Dias após a eletroporação protocolo: 7 dias.
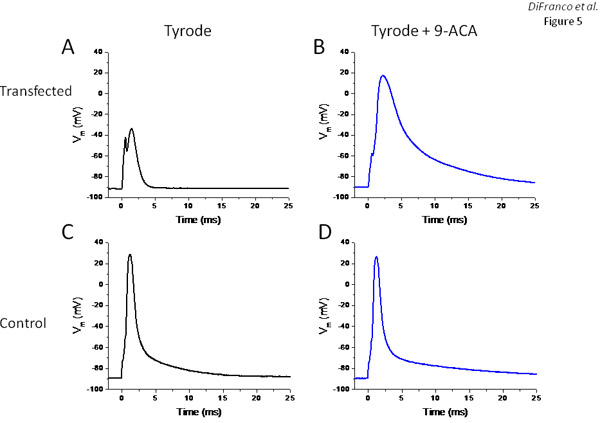
Figura 5. Fibras avaliação eletrofisiológica transgênicos expressando EYFP-ClC1. Painéis A e B são registros de tensão de uma fibra expressar EYFP-ClC1 em resposta a pulsos de corrente antes e após o tratamento com 9-ACA, respectivamente. Painéis C e D são registros de voltagem (potenciais de ação) provocou em resposta a pulsos de corrente em uma fibra não-transfectadas antes e após o tratamento com 9-ACA, respectivamente.
Discussão
Descrevemos aqui os passos detalhados que devem ser seguidas a fim de atingir transfections eficaz de plasmídeos de DNA em fibras musculares esqueléticas em por eletroporação in vivo. As principais vantagens da nossa abordagem são a simplicidade de implementação, e sua mínima invasividade que resulta em perigo para a saúde negligenciável para os animais. Na realidade, os protocolos acima descritos eletroporação não implicam muito mais do que duas injeções subcutâneas por pé, seguido po...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Agradecemos ao Dr. T. Otis, Departamento de Neurobiologia, UCLA, para compartilhar as instalações TPLSM conosco, Dr. C. Fahlke, Instituto de Fisiologia, RWTH Aachen, Alemanha, para o tipo de doação o plasmídeo pEYFP-ClC1, eo Sr. . R. Serrano para suporte técnico. Este trabalho foi suportado por concessões do NIH / NIAMS concede AR047664 e AR54816.
Referências
- Muangmoonchai, R., Wong, S., Smirlis, D., Phillips, I., Shephard, E. Transfection of liver in vivo by biolistic particle delivery. Molecular Biotechnology. 20 (2), 145-151 (2002).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Voltage-dependent dynamic FRET signals from the transverse tubules in mammalian skeletal muscle fibers. J Gen Physiol. 130 (6), 581-600 (2007).
- DiFranco, M., Neco, P., Capote, J., Meera, P., Vergara, J. L. Quantitative evaluation of mammalian skeletal muscle as a heterologous protein expression system. Protein Expression and Purification. 47 (1), 281-288 (2006).
- Meera, P., Dodson, P. D., Karakossian, M. H., Otis, T. S. Expression of GFP-tagged neuronal glutamate transporters in cerebellar Purkinje neurons. Neuropharmacology. 49 (6), 883-889 (2005).
- DiFranco, M., Capote, J., Quinonez, M., Vergara, J. L. Dynamic FRET Signals between DPA and the {alpha}1s and {beta}1a Subunits of the DHPR of Mammalian Skeletal Muscle. Biophys. J. 94, 2633-2633 (2008).
- Woods, C. E., Novo, D., DiFranco, M., Capote, J., Vergara, J. L. Propagation in the transverse tubular system and voltage dependence of calcium release in normal and mdx mouse muscle fibres. J Physiol. 568 (Pt 3), 867-880 (2005).
- DiFranco, M., Woods, C. E., Capote, J., Vergara, J. L. Dystrophic skeletal muscle fibers display alterations at the level of calcium microdomains. Proc Natl Acad Sci U S A. 105 (38), 14698-14703 (2008).
- Lueck, J. D., Mankodi, A., Swanson, M. S., Thornton, C. A., Dirksen, R. T. Muscle Chloride Channel Dysfunction in Two Mouse Models of Myotonic Dystrophy. J. Gen. Physiol. 129 (1), 79-94 (2007).
- Zipfel, W. R. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second harmonic generation. Proceedings of the National Academy of Sciences of the United States of America. 100 (12), 7075-7080 (2003).
- Plotnikov, S. V., Millard, A. C., Campagnola, P. J., Mohler, W. A. Characterization of the Myosin-Based Source for Second-Harmonic Generation from Muscle Sarcomeres. Biophys J. 90 (2), 693-703 (2006).
- DiFranco, M., Capote, J., Vergara, J. L. Optical imaging and functional characterization of the transverse tubular system of mammalian muscle fibers using the potentiometric indicator di-8-ANEPPS. J Membr Biol. 208 (2), 141-153 (2005).
- Mills, M. Differential expression of the actin-binding proteins, {{alpha}}-actinin-2 and -3, in different species: implications for the evolution of functional redundancy. Hum. Mol. Genet. 10 (13), 1335-1346 (2001).
- Woods, C. E., Novo, D., DiFranco, M., Vergara, J. L. The action potential-evoked sarcoplasmic reticulum calcium release is impaired in mdx mouse muscle fibres. J Physiol. 557 (Pt 1), 59-75 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados