Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ambulatorio de grabación ECG en ratones
En este artículo
Resumen
ECG telemétrico se ha convertido en una herramienta esencial en la evaluación de modelos animales para las arritmias cardíacas y muerte súbita cardíaca. A continuación, presentamos una guía paso a paso para telemetría ECG para su aplicación a largo plazo de la monitorización ambulatoria de ECG en ratones.
Resumen
Telemétricas registro del ECG en los ratones es esencial para entender los mecanismos detrás de las arritmias, trastornos de la conducción, y la muerte cardiaca repentina. Aunque el ECG de superficie se utiliza para mediciones de corta duración de los intervalos de la forma de onda, no es práctico para los estudios a largo plazo de la variabilidad del ritmo cardíaco o la captura de raros episodios de arritmias. Implantables telémetros ECG ofrecen las ventajas de la implantación quirúrgica sencilla, a largo plazo de registro de los electrogramas en ratones ambulatoria, y escalabilidad con registros simultáneos de varios animales. A continuación, presentamos una guía paso a paso para la implantación de telémetros para el registro del ECG ambulatorio en los ratones. La adhesión cuidadosa a la técnica aséptica se requiere para obtener resultados favorables de supervivencia con la posibilidad de la implantación y la grabación de semanas a meses. Por lo tanto, la telemetría ECG implantable es una herramienta valiosa para la detección de información crítica sobre la electrofisiología cardíaca en modelos animales ambulatorios como el ratón.
Protocolo
1. Preparación de telémetro de implantación quirúrgica
- Antes de introducir un telémetro ECG en el ratón, es importante asegurarse de que el telémetro ECG es estéril y en buen estado de funcionamiento. Los nuevos dispositivos de telemetría se proporcionan típicamente en condiciones estériles por el fabricante. Telémetros ECG puede ser reutilizado siempre que el dispositivo se limpia con solución Tergazyme 1% durante al menos 4 horas. Usted puede enjuagar el telémetro con agua estéril después de la limpieza con Tergazyme. Además, el uso Wavicide-01 durante la noche desinfectante para esterilizar el telémetro ECG. Asegúrese de lavar desinfectante con agua estéril 48 horas antes de la implantación en ratones. Guardar en un recipiente estéril.
- Compruebe el telémetro conduce a la integridad tanto de los hilos conductores y de la vaina aislante. Encienda el transmisor de telemetría mediante un imán saludó con la mano dentro de los 5 cm del telémetro, y prueba de la señal con una frecuencia de radio AM 530,. La señal debe ser fuerte y claro y que varían en intensidad y el tono basado en la manipulación de los cables. Anote el número de modelo, el número de serie telémetro, y el valor de calibración del ECG. Los fabricantes suelen recomendar que el telémetro debe ser por 24 horas antes de la implantación, consulte el manual de instrucciones de su telémetro específicos para más detalles. En este ejemplo, vamos a utilizar una Sciences Data International (DSI) telémetro para su implantación.
- Preparación telémetro de plomo puede ser logrado mediante la reducción de los efectos negativos (blanco) dan lugar a aproximadamente 3,5 cm y el positivo (rojo) a 2,5 cm. Estas son las longitudes óptimas para la implantación del cable negativo en el lado derecho del pecho, y el cable positivo en el abdomen a la izquierda (ver figura 2). A continuación, retire la envoltura de aislamiento para exponer 7 mm de alambre. Pintar el extremo del cable de metal con pegamento estériles, como Vet-Bond, y luego coloque las tapas llevan a las puntas de metal. Estas tapas se evitará la erosión de la piel debido a la colocación del electrodo. Aproximadamente 2.3 mm de alambre de metal deben ser expuestos para la detección eléctrica del ritmo del corazón nativo.
2. La implantación quirúrgica del telémetro
- Para utilizar una técnica estéril en la cirugía de murino, tendrá que guantes estériles, un campo estéril, y las suturas de Prolene 6-0. Usted también tendrá que dos pares de pinzas esterilizadas, un par de extremos romos tijeras, un bisturí, y un conductor de la aguja. Los instrumentos quirúrgicos se pueden esterilizar en un esterilizador de cuentas de vidrio se calienta a 250 grados Celsius. Asegúrese de esterilizar y lavar el telémetro como se describió previamente antes de su uso.
- Prepare el ratón para la cirugía por primera anestesiar el ratón en una caja de inducción con 3% de isoflurano en 0,5 L / min O2 al 100%. Use una almohadilla eléctrica, tales como T-bomba que hace circular el agua caliente, para mantener la temperatura del ratón anestesiado es. La temperatura puede ser controlada por la sonda rectal, si lo desea. Cuando el ratón está adecuadamente sedado, completamente afeitado el abdomen y el pecho del ratón con una maquinilla eléctrica. Volver a anestesiar a los ratones con isoflurano antes de transferir el ratón a un tubo de flujo constante, en decúbito supino, con la cabeza de espaldas y la cola hacia usted. Pegue las patas de los ratones a la mesa de operaciones con calefacción. Limpie el abdomen con un algodón con alcohol para eliminar el vello rasurado y la limpieza del campo operatorio. Aplicar tres capas diferentes de betadine con hisopos para desinfectar el abdomen y el pecho. Verificar el nivel correcto de la anestesia mediante la aplicación de presión sobre el lecho de la uña del ratón. Después de que el ratón se ha preparado para la cirugía, el uso de guantes estériles y aplicar el campo estéril en el campo quirúrgico.
- Telémetro implantación intraperitoneal ofrece la ventaja de la experimentación de fisiología del ejercicio. Para la inserción intraperitoneal, comenzar la cirugía mediante el uso de un bisturí para crear una incisión vertical en la línea media de la piel que recubre el abdomen alrededor de 2,5 cm de longitud. Con cuidado, separa el pellejo de los tejidos conectivos subyacentes con extremos romos tijeras. A continuación, cree una incisión vertical en la línea media la línea alba que cubre el peritoneo, aproximadamente 1,5 cm de longitud. Además, crear un pequeño agujero en el peritoneo por encima (craneal) de la incisión peritoneal, el cual servirá como una salida por vía subcutánea conduce. Mientras se realiza la cirugía, mantener la humedad del lugar de la cirugía de vez en cuando gotas de solución salina estéril en el campo operatorio.
- Inserte el telémetro en la cavidad peritoneal derecha. Inserte pinzas en el agujero superior al telémetro y tire de ambos lleva a través del orificio principal por lo que están saliendo de la cavidad peritoneal. Uso continuo 6-0 suturas de Prolene para cerrar la incisión de 1,5 cm peritoneal línea media vertical.
3. El plomo implantación y el cierre abdominal
- Los cables de ECG se colocan a la cabeza de configuración II. A la cabeza con la funda blanca / transparente es negativo, y se coloca en el abdomen superior izquierdo. En primer lugar, crear una incisión de 0,5 cm de la piel en el pecho superior derecho del ratón.A continuación, utilice la tijera sin punta para crear un túnel de vuelta a la incisión abdominal. Saque el cable a través del túnel y el uso de una sutura de prolene 6-0 para fijar la cabeza en el músculo pectoral. Asegúrese de que la sutura en la parte superior de la parte expuesta de la cabeza, y crea un buen contacto entre el plomo y el músculo subyacente. Use una segunda sutura proximal a la mencionada una, para inmovilizar la cabeza con el músculo. Cierre la incisión en la piel con una sutura de Prolene 6-0.
- El cable positivo (vaina roja) se coloca en el abdomen izquierdo debajo del diafragma izquierdo y debajo del corazón. La iniciativa se basa en el tejido peritoneal subyacente por sutura de Prolene 6-0 y debe tener un buen contacto con el tejido peritoneal. Se hace una incisión adicional no es necesario en este paso porque el sitio de implante del electrodo está cerca de la incisión de la línea media vertical, por lo tanto se puede acercar con el campo quirúrgico ya existente. Tenga en cuenta que el tejido peritoneal debe ser levantada para evitar la perforación del intestino subyacente.
- Cerrar la fascia abdominal y la piel de forma secuencial con Prolene 6-0 en capas.
4. Cuidados post-operatorios
- Dar el ratón 0,1 ml de [1 mg / ml] buprenorfina para la analgesia en el postoperatorio inmediato. Deje que el ratón para recuperarse de una cirugía en un cojín de calefacción. Si el ratón ha tenido una cirugía prolongada> 30 min, o si el ratón se vea seca, se puede inyectar la solución salina estéril al 0.2 hasta 0.3 mL en el peritoneo para la rehidratación. Para la continuación de la analgesia postoperatoria es una práctica estándar para proporcionar ratones con buprenorfina dos veces al día durante tres días, y luego, según sea necesario cada ocho horas.
- Limpie el betadine con una gasa con alcohol para evitar la irritación post-quirúrgica. Recuerde que debe registrar el peso post-quirúrgico para la determinación posterior de la post-quirúrgica de la salud.
- 8-24 horas después de la cirugía, darle al ratón analgesia con buprenorfina cuando sea necesario, ya que esto reducirá el dolor y reducir el fracaso en la principal de ratón de arañazos en el sitio de post-quirúrgica.
5. Resultados representante
Cuando se realiza correctamente, el ratón se han cerrado con incisiones abdominales subcutánea lleva debajo de la piel. Por lo general, el ratón lleva 10-30 minutos para recuperarse de la anestesia. Se tarda unos 70-10 días antes de que los ratones se han recuperado completamente de la cirugía, como lo demuestra la recuperación de la pérdida de peso post-operatorio y la normalización de la movilidad.
La complicación más frecuente de la cirugía es la erosión de las derivaciones de las extremidades a través de la piel en los primeros 10 días después de la cirugía. Esta complicación común se puede evitar firmemente adherido subcutánea lleva a los tejidos subcutáneos o el peritoneo. Esta técnica evita lleva floja, que crean la presión y la fricción en la piel cuando el ratón deambula. Aunque es menos común, la infección y la sepsis puede ocurrir por errores en la técnica estéril, o de la limpieza incompleta de los telémetros utilizado.
Salida de ECG puede ser registrada por una matriz de receptor junto con el software de adquisición de datos, tales como Data Sciences International (DSI). Resultados de forma de onda debe incluir una claramente definida onda P, que indica la despolarización auricular, y también una onda QRS que representa la despolarización ventricular, como se muestra en la Figura 3. Una buena calidad del trazado del ECG debe tener claramente definida una onda P que precede a una ola de QRS claramente definidos en una proporción de 1:1. No debe ser la señal de fondo bajo y los intervalos RR debe ser regular en ratones de tipo salvaje. Una mala calidad del trazado del ECG pueden tener indistinta o las ondas P QRS, o la señal de fondo, lo que puede hacer el análisis, al siguiente equipo difícil. Un pobre el trazado del ECG pueden ser fijados por lleva telémetro re-implantación, por lo general uno a la vez. Para volver a implantar una ventaja de telémetro, coloque el ratón bajo anestesia, y el uso de la técnica quirúrgica, hacer una incisión en la piel que recubre directamente a la cabeza en cuestión. Cuando la cabeza se accede, corte el hilo de sutura de anclaje a la cabeza, y mover la cabeza a la posición deseada antes de anclar la ventaja de nuevo. Finalmente, cerca de la zona quirúrgica con Prolene 6-0.

Figura 1: Un ejemplo de un telémetro de animales pequeños con cables positivo y negativo. En general, el cable rojo es el positivo y el cable blanco es el cable negativo. Cada cable debe tener una cubierta aislante, de 5-7 mm de cable expuesto, y una punta de plástico tapado, lo que evita la erosión de la iniciativa a través de la piel.
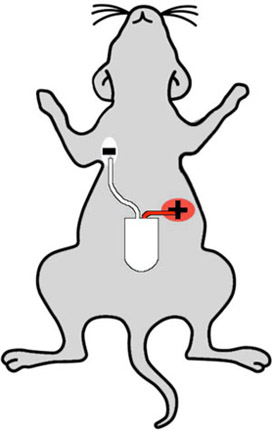
Figura 2: dibujos animados que muestran los lugares de implantación adecuada telémetro de un ratón. El blanco (negativo) se implanta en el pecho superior derecho del ratón, y el rojo (positivo) se coloca en el abdomen izquierdo, de tal manera que los sentidos telémetro la "ventaja de dos" de configuración.

Figura 3: Representante de forma de onda de un ratón en ritmo sinusal normal. La onda P representa la despolarización auricular y el complejo QRS representa la despolarización ventricular. Una forma de onda de alta calidad debe tener una onda P diferente que precede a cada complejo QRS en una proporción de 1:1.
Discusión
Los pasos críticos de este procedimiento son la limpieza y la preparación correcta del ratón antes de la cirugía la supervivencia. Cuando un telémetro y el sitio del ratón operativo se limpian correctamente, hay un mucho mejor resultado post-quirúrgico. Además, mucha atención a la colocación del electrodo reduce post-quirúrgica erosión de la piel. Posibles modificaciones de la técnica incluyen configuraciones alternativas para evaluar la función del VI pared lateral (derivación I de configuración), o el ...
Agradecimientos
McCauley marca está respaldada por un mentor NIH-formación conceder 5T32HL066991-07
Xander Wehrens es apoyado por el NIH / NHLBI subvenciones 1R01HL091947-01A209 y 3R01HL089598 03S109-
Materiales
| Name | Company | Catalog Number | Comments |
| Steri 250 Bead Sterilizer | Inotech | IS-250 | |
| Blunt-Ended Scissors | Roboz Surgical Instruments Co. | RS-5980 | |
| Blunt-Ended Forceps (x2) | Roboz Surgical Instruments Co. | RS-5138 | |
| Veterinary Anesthesia Vaporizer | Surgivet | Isotec 4 | |
| T/Pump | Gaymar Industries | P/N11184-000 | |
| Propylene Blue Monofilament Suture | Ethicon Inc. | 8718 | |
| Povodone Iodine, 10% | Equate | N/A | |
| Alcohol Swabs | PDI | B339 | |
| Tergazyme | Alconox, Inc. | 21837-118 | |
| Wavidicde-01 | Medical Chemical Corporation | Wavicide-01 | |
| ECG Telemeter | DataSciences International | EA-F20 |
Referencias
- Cerrone, M. Bidirectional ventricular tachycardia and fibrillation elicited in a knock-in mouse model carrier of a mutation in the cardiac ryanodine receptor. Circ Res. 96 (10), e77-e77 (2005).
- Chelu, M. G. Calmodulin kinase II-mediated sarcoplasmic reticulum Ca2+ leak promotes atrial fibrillation in mice. J Clin Invest. 119 (7), 1940-1940 (1940).
- Sood, S. Intracellular calcium leak due to FKBP12.6 deficiency in mice facilitates the inducibility of atrial fibrillation. Heart Rhythm. 5 (7), 1047-1047 (2008).
- Swoap, S. J., Gutilla, M. J. Cardiovascular changes during daily torpor in the laboratory mouse. Am J Physiol Regul Integr Comp Physiol. 297 (3), R769-R769 (2009).
- Costa-Goncalves, d. a., C, A. Role of the multidomain protein spinophilin in blood pressure and cardiac function regulation. Hypertension. 52 (4), 702-702 (2008).
- Wehrens, X. H., Kirchhoff, S., Doevendans, P. A. Mouse electrocardiography: an interval of thirty years. Cardiovasc Res. 45 (1), 231-231 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados