Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ambulante EKG-Aufzeichnung in Mäuse
In diesem Artikel
Zusammenfassung
Telemetric EKG wurde als ein wesentliches Instrument bei der Beurteilung von Tiermodellen für Herzrhythmusstörungen und den plötzlichen Herztod entwickelt. Hier präsentieren wir eine schrittweise Anleitung zur telemetrischen EKG-Aufzeichnungen für den Einsatz in langfristige ambulante EKG-Überwachung in Mäusen.
Zusammenfassung
Telemetric EKG-Aufzeichnung in Mäusen ist von wesentlicher Bedeutung für das Verständnis der Mechanismen, die hinter Arrhythmien, Reizleitungsstörungen und plötzlichen Herztod. Obwohl die Oberflächen-EKG für kurzfristige Messungen der Wellenform Abständen verwendet wird, ist es nicht für Langzeitstudien der Herzfrequenzvariabilität oder der Erfassung von seltenen Episoden von Herzrhythmusstörungen praktisch. Implantierbarer EKG Entfernungsmesser bieten die Vorteile der einfachen chirurgischen Implantation, Langzeit-Aufzeichnung von Elektrogramme in der ambulanten Mäusen und Skalierbarkeit bei gleichzeitiger Aufnahme von mehreren Tieren. Hier präsentieren wir eine Schritt-für-Schritt-Anleitung für die Implantation von Entfernungsmesser für ambulante EKG-Aufzeichnung bei Mäusen. Eine sorgfältige Einhaltung aseptische Technik ist für günstige Überlebensdaten mit der Möglichkeit der Implantation und der Aufnahme von Wochen bis Monaten erforderlich. So ist implantierbaren EKG-Telemetrie zu einem wertvollen Werkzeug für den Nachweis von kritischen Informationen auf die kardiale Elektrophysiologie in der ambulanten Tiermodellen, wie die Maus.
Protokoll
1. Vorbereitung der Telemeter für Chirurgische Implantation
- Vor dem Einsetzen einer EKG-Entfernungsmesser in der Maus, ist es wichtig, sicherzustellen, dass die EKG-Entfernungsmesser ist steril und in einwandfreiem Zustand sind. New Telemetrie-Geräte sind in der Regel in einem sterilen Zustand vom Hersteller zur Verfügung gestellt. EKG-Entfernungsmesser bereitgestellt wiederverwendet werden das Gerät gereinigt wird mit Tergazyme 1% ige Lösung für mindestens 4 Stunden. Sie können den Entfernungsmesser mit sterilem Wasser abspülen nach der Reinigung mit Tergazyme. Darüber hinaus verwenden Wavicide-01 Desinfektionsmittel über Nacht auf die EKG-Entfernungsmesser zu sterilisieren. Achten Sie darauf, Desinfektionsmittel abwaschen mit sterilem Wasser 48 Stunden vor der Implantation in Mäuse. Shop in einem sterilen Behälter.
- Überprüfen Sie die Entfernungsmesser führt für die Integrität sowohl der leitenden Drähten und die isolierende Hülle. Schalten Sie den Telemetrie-Sender mit Hilfe eines Magneten winkte innerhalb von 5 cm der Entfernungsmesser und testen Sie das Signal mit einem AM-Radio, Frequenz 530. Das Signal sollte stark und klar und sollte in der Intensität und Tonhöhe Manipulation der Drähte variieren. Notieren Sie die Modellnummer, die Entfernungsmesser Seriennummer und die EKG-Kalibrierwert. Hersteller empfehlen oft, dass der Entfernungsmesser sollte auf 24 Stunden vor der Implantation werden, siehe die Bedienungsanleitung für Ihren spezifischen Entfernungsmesser für weitere Einzelheiten. In diesem Beispiel werden wir ein Data Sciences International (DSI) Entfernungsmesser für die Implantation zu verwenden.
- Telemeter führen Präparat kann, indem man die negative (weiß) führen zu ca. 3,5 cm und die positive (rot) bis 2,5 cm erreicht werden. Dies sind die optimalen Längen für die Implantation der negativen Blei in der rechten Brust, und positive Führung in der linken Unterbauch (siehe Abbildung 2). Als nächstes entfernen Sie die isolierende Hülle um 7 mm Draht freizulegen. Malen Sie das Ende des Metall-Führung mit sterilen Sekundenkleber, wie Vet-Bond, und fügen Sie führen Kappen, um das Metall Spitzen. Diese Kappen werden mit der Haut vermeiden Erosion durch Platzierung führen. Etwa 2-3 mm Metalldraht sollte für die elektrische Abfragung der einheimischen Herzrhythmus ausgesetzt werden.
2. Chirurgische Implantation des Telemeter
- Um sterile Technik in murine Operation verwenden, müssen Sie sterile Handschuhe, ein steriles Abdecktuch, und 6-0 Prolene Fäden. Sie werden auch 2 Paar sterilisierte Pinzette benötigt, 1 Paar blunt-ended Schere, ein Skalpell und Nadel-Treiber. Chirurgische Instrumente können in einer Glasperle Sterilisator erhitzt, um 250 Grad Celsius sterilisiert werden. Achten Sie darauf, sterilisieren und waschen Sie den Entfernungsmesser wie bisher vor dem Einsatz beschrieben.
- Bereiten Sie die Maus für die Operation, indem Sie zuerst betäuben die Maus in eine Induktion Box mit 3% Isofluran in 0,5 l / min 100% O2. Verwenden Sie ein Heizkissen, wie ein T-Pumpe, die warmes Wasser zirkuliert, um die narkotisierten Maus Temperatur zu halten. Die Temperatur kann durch die rektale Sonde überwacht werden, falls gewünscht. Wenn die Maus ausreichend sediert, komplett rasiert den Bauch und die Brust der Maus mit elektrischen Haarschneider. Re-betäuben die Maus mit Isofluran vor der Übertragung die Maus, um eine konstante-Strömungsrohr, Rücken, Kopf und Schwanz abgewandten Richtung zu Ihnen. Band nach unten mit der Maus den Pfoten, um den beheizten OP-Tisch. Wischen Sie den Bauch mit einem Alkoholtupfer rasiert Haar zu entfernen und das Operationsfeld zu reinigen. Wenden Sie drei separate Schichten betadine mit Abstrichen auf den Bauch und Brust zu desinfizieren. Überprüfen Sie die korrekte Höhe der Anästhesie durch Druck auf die Maus Nagelbett. Nach der Maus wurde für Chirurgie vorbereitet worden, verwenden Sie sterile Handschuhe und Anwendung der sterilen Tuch auf das OP-Feld.
- Intraperitoneal Entfernungsmesser Implantation bietet den Vorteil, Sportphysiologie Experimentieren. Für intraperitoneal Einfügung beginnen Operation mit einem Skalpell, um eine vertikale Mittellinie Schnitt in der Haut über dem Bauch etwa 2,5 cm in der Länge zu erstellen. Sie vorsichtig die Haut vor zugrunde liegende Bindegewebe mit blunt-ended Schere. Dann erstellen Sie eine vertikale Mittellinie Schnitt in der Linea alba, die über dem Bauchfell, etwa 1,5 cm in der Länge. Darüber hinaus erstellen Sie ein kleines Loch in das Bauchfell oberhalb (kranial), die peritoneale Inzision, die als Ventil für die subkutane führt dienen wird. Während der Durchführung der Operation, halten Sie die Operationsstelle feucht von gelegentlich tropfenden steriler Kochsalzlösung auf das OP-Feld.
- Legen Sie die Entfernungsmesser in die rechte Bauchhöhle. Setzen Sie Zange in das Loch über dem Entfernungsmesser und ziehen Sie beide führt durch die Führung Loch, so dass sie aus dem Peritoneum hervorstehenden sind. Verwenden kontinuierliche 6-0 Prolene Fäden, um die 1,5 cm Peritonealdialyse vertikale Mittellinienschnitt schließen.
3. Lead-Implantation und Bauchdeckenverschluss
- Die EKG-Ableitungen sind in der Ableitung II-Konfiguration platziert. Das Blei mit dem weiß / transparenter Mantel negativ ist, und befindet sich im linken Oberbauch platziert. Erstellen Sie zunächst ein 0,5 cm Hautschnitt in der Maus oberen rechten Brust.Als Nächstes verwenden Sie das stumpfe Schere, einen Tunnel zurück zu schaffen, um den Bauchschnitt. Ziehen Sie die Führung durch den Tunnel und die Nutzung einem 6-0 Prolene Naht an der Spitze der Brustmuskel zu verankern. Achten Sie darauf, die Naht ist auf der exponierten Teil des Bleis, und schafft einen guten Kontakt zwischen Blei und darunter liegende Muskulatur. Verwenden Sie eine zweite Naht proximal zu den genannten ein, um die Führung an die Muskeln zu immobilisieren. Schließen Sie den Hautschnitt mit 6-0 Prolene Naht.
- Der Pluspol (rot Mantel) ist in der linken Bauch unter dem linken Zwerchfell und unterhalb des Herzens gelegt. Das Blei wird auf die zugrunde liegende Peritonealgewebe von 6-0 Prolene Naht verankert und sollte guten Kontakt mit der Peritonealgewebe haben. Ein weiterer Einschnitt wird in diesem Schritt nicht notwendig, da die Website von Blei-Implantation ist in der Nähe der vertikalen Inzision in der Mittellinie, so kann leicht mit den vorhandenen OP-Feld zugegriffen werden. Beachten Sie, dass die peritoneale Gewebe angehoben müssen, um eine Perforation der zugrunde liegenden Darm zu vermeiden.
- Schließen Sie die Bauchfaszie und die Haut nacheinander mit 6-0 Prolene in Schichten.
4. Post-operative Betreuung
- Geben Sie mit der Maus 0,1 ml [1 mg / mL] Buprenorphin zur Analgesie unmittelbar nach der Operation. Lassen Sie die Maus, um sich von der Operation auf einem Heizkissen erholen. Wenn die Maus längere Chirurgie> 30 min, oder wenn mit der Maus erscheint trocken, können Sie 0,2-0,3 ml sterile Kochsalzlösung in das Bauchfell zur Rehydration spritzen musste. Für die weitere postoperative Analgesie ist es üblich, Mäuse mit Buprenorphin zweimal täglich für drei Tage, und dann als alle acht Stunden benötigt.
- Reinigen Sie betadine mit einem Alkoholtupfer, um postoperative Irritationen zu vermeiden. Denken Sie daran, die post-operative Gewicht für die anschließende Bestimmung der post-chirurgischen Gesundheitsakte.
- 8-24 Stunden nach der Operation, verhält sich die Maus zusätzliche Analgesie mit Buprenorphin, wenn nötig, da dies Schmerzen verringern und führen Platzierung Ausfall von Maus krallte sich in der post-OP-Gebiet.
5. Repräsentative Ergebnisse
Wenn richtig ausgeführt, sollte die Maus Baucheinstiche geschlossen haben bei subkutaner führt unter der Haut. Normalerweise dauert der Maus 10-30 Minuten, um aus der Narkose zu erholen. Es dauert ca. 7-10 Tage, bevor die Mäuse vollständig von der Operation erholt haben, als durch Wiederherstellung der postoperativen Gewichtsabnahme und eine Normalisierung der Mobilität bewiesen.
Die häufigste Komplikation nach der Operation ist die Erosion des Körpers führt durch die Haut in den ersten 10 Tagen nach der Operation. Diese häufige Komplikation kann durch fest haftende subkutane führt zu subkutanen Gewebe-oder Bauchfell vermieden werden. Diese Technik vermeidet slack führt, die Druck und Reibung auf der Haut zu schaffen, wenn die Maus ambulates. Obwohl weniger häufig, Infektionen und Sepsis können von Fehlern in einer sterilen Technik oder unvollständige Reinigung verwendet Entfernungsmesser auftreten.
EKG-Ausgabe können von einem Empfänger-Matrix mit Datenerfassungs-Software, wie zB Data Sciences International (DSI) gekoppelt aufgezeichnet werden. Waveform Ergebnisse sollten einen klar definierten P-Welle, bezeichnet atriale Depolarisation, und auch eine QRS-Welle, die ventrikuläre Depolarisation bedeutet, wie in Abbildung 3 dargestellt. Eine gute Qualität EKG-Kurve sollte einen klar definierten P-Welle vor einer klar definierten QRS-Welle in einem Verhältnis von 1:1. Es sollte geringe Hintergrundsignal und RR-Intervalle sollten in Wildtyp-Mäusen regelmäßig. Eine schlechte Qualität EKG-Kurve kann undeutliche P oder QRS-Wellen, oder Hintergrund-Signal, das zu machen nachfolgenden Computer-Analyse schwierig sein kann. Eine schlechte EKG-Kurve kann durch Re-Implantation Entfernungsmesser führt, in der Regel ein zu einer Zeit fixiert werden. Zum erneuten Implantat ein Entfernungsmesser führen, statt mit der Maus in Narkose und mit OP-Technik, einen Einschnitt in die Haut direkt über dem Blei in Frage. Wenn die Führung zugegriffen wird, schneiden Sie die Naht Verankerung der Führung, und verschieben Sie die Führung an die gewünschte Position vor Anker wieder die Führung. Schließlich, in der Nähe der Operationsstelle mit 6-0 Prolene.

Abbildung 1: Ein Beispiel für ein kleines Tier Entfernungsmesser mit positiven und negativen führt. Im Allgemeinen ist das rote Kabel der Pluspol und der Bleiweiß ist der negative führen. Jede Leitung sollte eine isolierende Hülle, 5-7 mm blanker Draht und einem Kunststoff verschlossen Spitze, die Erosion der Führung verhindert, dass durch die Haut.
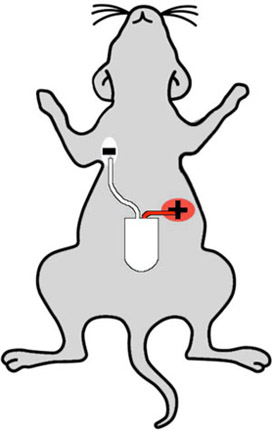
Abbildung 2: Cartoon zeigt richtige Entfernungsmesser Nidationsstellen auf einer Maus. Der weiße (negative) führen in der Maus im rechten oberen Brustbereich implantiert und die rote (positive) führen in der linken Bauch, so dass der Entfernungsmesser Sinne des "führen zwei"-Konfiguration platziert.

Abbildung 3: Repräsentative Wellenform einer Maus in einen normalen Sinusrhythmus. P-Welle stellt atriale Depolarisation und QRS-Komplex stellt ventrikulären Depolarisation. Ein qualitativ hochwertiges Signal sollte eine deutliche P-Welle vor jedem QRS-Komplex im Verhältnis 1:1.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die entscheidenden Schritte dieses Verfahrens sind ordnungsgemäße Reinigung und Vorbereitung der Maus vor dem Überleben der Operation. Wenn ein Entfernungsmesser und die Maus operative Seite ordnungsgemäß gereinigt, es gibt eine viel bessere postoperative Ergebnisse. Darüber hinaus reduziert die Aufmerksamkeit der Platzierung führen postoperativen Haut Erosion. Mögliche Änderungen an der Technik sind alternative Konfigurationen seitlichen Wand LV-Funktion (Lead I-Konfiguration), oder die Nutzung des Entfernungs...
Access restricted. Please log in or start a trial to view this content.
Danksagungen
Mark McCauley wird durch ein NIH Mentor-Ausbildung zu gewähren 5T32HL066991-07 unterstützt
Xander Wehrens wird durch NIH / NHLBI gewährt 1R01HL091947-01A209 und 3R01HL089598-03S109 unterstützt
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Steri 250 Bead Sterilizer | Inotech | IS-250 | |
| Blunt-Ended Scissors | Roboz Surgical Instruments Co. | RS-5980 | |
| Blunt-Ended Forceps (x2) | Roboz Surgical Instruments Co. | RS-5138 | |
| Veterinary Anesthesia Vaporizer | Surgivet | Isotec 4 | |
| T/Pump | Gaymar Industries | P/N11184-000 | |
| Propylene Blue Monofilament Suture | Ethicon Inc. | 8718 | |
| Povodone Iodine, 10% | Equate | N/A | |
| Alcohol Swabs | PDI | B339 | |
| Tergazyme | Alconox, Inc. | 21837-118 | |
| Wavidicde-01 | Medical Chemical Corporation | Wavicide-01 | |
| ECG Telemeter | DataSciences International | EA-F20 |
Referenzen
- Cerrone, M. Bidirectional ventricular tachycardia and fibrillation elicited in a knock-in mouse model carrier of a mutation in the cardiac ryanodine receptor. Circ Res. 96 (10), e77-e77 (2005).
- Chelu, M. G. Calmodulin kinase II-mediated sarcoplasmic reticulum Ca2+ leak promotes atrial fibrillation in mice. J Clin Invest. 119 (7), 1940-1940 (1940).
- Sood, S. Intracellular calcium leak due to FKBP12.6 deficiency in mice facilitates the inducibility of atrial fibrillation. Heart Rhythm. 5 (7), 1047-1047 (2008).
- Swoap, S. J., Gutilla, M. J. Cardiovascular changes during daily torpor in the laboratory mouse. Am J Physiol Regul Integr Comp Physiol. 297 (3), R769-R769 (2009).
- Costa-Goncalves, da, C, A. Role of the multidomain protein spinophilin in blood pressure and cardiac function regulation. Hypertension. 52 (4), 702-702 (2008).
- Wehrens, X. H., Kirchhoff, S., Doevendans, P. A. Mouse electrocardiography: an interval of thirty years. Cardiovasc Res. 45 (1), 231-231 (2000).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten