このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおけるホルター心電図の記録
要約
遠隔測定心電図は心臓の不整脈や心臓突然死のために動物モデルを評価する上で不可欠なツールとして浮上している。ここで、我々は、マウスの長期的、ホルター心電図モニタリングのアプリケーションのための測定ECG記録への段階的なガイドを提示する。
要約
マウスの遠隔計測心電図記録は、不整脈、伝導障害、そして心臓突然死の背後にあるメカニズムを理解するために不可欠です。表面心電図は、波形の間隔の短期的な測定のために利用されていますが、それは、心拍変動や不整脈の珍しいエピソードのキャプチャの長期的研究のために実用的ではありません。埋め込み型心電図テレメーターは、単純な外科的移植、外来マウスのelectrogramsの長期的な記録、および複数の動物の同時録画とスケーラビリティの利点があります。ここで、我々は、マウスのホルター心電図記録用テレメータの注入へのステップバイステップガイドを紹介。無菌操作に細心の注意を順守は数週間から数ヶ月に注入し、記録の可能性と良好な生存率の結果が必要です。このように、埋め込み型心電図テレメトリは、マウスなどの外来動物モデルにおける心臓電気生理学に関する重要な情報を検出するための貴重なツールです。
プロトコル
1。外科的移植のためのテレメーターの調製
- マウスに心電図テレメータを挿入する前に、それは、心電図テレメータは無菌と良好な状態にあることを確認することが重要です。新しいテレメトリ装置は、通常、製造元によって無菌状態で提供されています。心電図テレメーターは、デバイスが少なくとも4時間Tergazyme 1%溶液を用いて洗浄されていれ再利用することができます。あなたがTergazymeで洗浄した後、滅菌水でテレメータを洗うことができる。さらに、心電図テレメータを殺菌するために一晩Wavicide - 01消毒剤を使用。 48時間のマウスに移植する前に、滅菌水で消毒剤を洗い落とすようにしてください。滅菌容器に保管する。
- テレメータをチェックし、両方の導線の整合性と絶縁シースにつながります。磁石テレメータの5cm以内に手を振ってを使用してテレメトリ送信機の電源を入れ、AMラジオ、周波数530との信号をテストします。信号は強いと明確にする必要がありますし、強度とワイヤの操作に基づいてピッチに変化するはずです。モデル番号、テレメータシリアル番号、および心電図の較正値を記録します。メーカーはしばしば、テレメーターは、移植前に24時間の上にあることをお勧めします、詳細については、特定のテレメータの取扱説明書を参照してください。この例では、我々は、移植のためのデータサイエンスインターナショナル(DSI)テレメータを使用します。
- テレメータリードの準備は約3.5 cmおよび2.5センチメートルに正(赤)リード線にマイナス(白)のリード線を切断することによって達成することができる。これらは、右胸の負極リードの注入、及び左腹部のプラス側のリード線(図2参照)のための最適な長さです。次に、ワイヤーの7 mmを公開するために絶縁被覆を除去。そのような獣医-ボンドのような無菌瞬間接着剤、金属製のリードの端をペイントして、金属の先端に鉛ダストキャップを取り付け。これらのキャップは、配置を導くために起因する皮膚の浸食を避けることができます。約2〜3mmの金属線は、ネイティブの心臓のリズムの電気的検出用に公開される必要があります。
2。テレメータの外科的移植
- マウス手術で無菌操作を使用するためには、滅菌手袋、滅菌ドレープ、および6から0 Prolene縫合が必要になります。また、滅菌ピンセット、先の尖っていないハサミの1ペア、メス、および針のドライバの2ペアが必要になります。手術器具は、摂氏250度に加熱ガラスビーズ滅菌器で滅菌することができる。以前、使用前に説明したようにテレメータを殺菌し、洗浄してください。
- 最初の0.5 L /分100%O2でイソフルラン3%使用してインダクションボックスにマウスを麻酔による手術のためのマウスを準備します。麻酔マウスの温度を維持するために、そのような暖かい水を循環させるT -ポンプとして、加熱パッドを使用してください。必要に応じて温度は、直腸プローブによって監視されることがあります。マウスが十分に鎮静されている場合、完全に電気バリカンでマウスの腹部と胸部を削る。頭が離れて直面しているとあなたに向かって尾で、仰臥位、一定のフローチューブにマウスを転送する前に、イソフルランでマウスを再度麻酔。加熱された手術台にマウスの足ダウンテープ。剃毛毛を削除すると術野をきれいにアルコール綿で腹部を拭きます。腹部と胸部を消毒するために綿棒でbetadineの3つの別々のコートを適用します。マウスの爪床に圧力を適用することによって、麻酔の正しいレベルを確認してください。マウスが手術のために準備された後、滅菌手袋を使用し、手術野に滅菌ドレープを適用する。
- 腹腔内テレメータの注入は、運動生理学の実験の利点を提供しています。腹腔内挿入のために、長さの腹部約2.5センチメートルを覆う皮膚に垂直正中切開を作成するためにメスを使用して手術を始めます。先の尖っていないハサミを使用して、基になる結合組織から慎重に別の皮膚。その後、、長さが約1.5 cmの腹膜を覆う白線の垂直正中切開を作成します。また、皮下のリードのための出口となる腹膜切開、に(脳神経)のすぐ上腹膜に小さな穴を作成します。手術を行っている間、時折動作フィールドに滅菌生理食塩水を滴下して手術部位の潤いを保つ。
- 右腹腔内にテレメーターを挿入します。テレメータに優れた穴に鉗子を挿入し、それらが腹膜から突出しているように、リード穴に通し、両方のリード線をプルアップ。 1.5センチメートル腹膜垂直正中切開を閉じるために、連続6から0 Prolene縫合糸を使用してください。
3。注入と腹部閉鎖をリード
- ECGのリードは、リードIIの構成で配置されます。白/透明シースと鉛は負であり、左上腹部に置かれます。最初に、マウスの右胸に0.5 cmの皮膚切開を作成します。次に、腹部切開に戻ってトンネルを作成する鈍はさみを使用してください。トンネルを経由してリードを引いて、胸筋にリードを固定するために6から0 Proleneの縫合糸を使用してください。縫合糸は、リードの露出部分の上にある、鉛及び基本的な筋肉の間の良好な接触を作成することを確認してください。筋肉にリードを固定するために、前述のものに近位第二縫合糸を使用してください。 6から0 Proleneの縫合糸を使用して皮膚切開を閉じます。
- プラス側のリード線(赤シース)は左横隔膜下と心臓の下の左腹部に配置されます。リードは6から0 Proleneの縫合によって下にある腹膜組織に固定されており、腹膜組織との良好な接触を持つ必要があります。鉛注入のサイトはこのように簡単に既存の手術野でアクセスすることが、垂直正中切開に近いため、追加の切開は、このステップでは必要ありません。腹膜組織の基盤となる腸の穿孔を避けるために、解除する必要があることに注意してください。
- 層の6から0 Proleneで順次腹部筋膜と皮膚を閉じます。
4。術後ケア
- [1 mg / mLの]手術直後鎮痛のためのブプレノルフィンのマウス0.1mLを与える。マウスは、加熱されたパッドの手術から回復することができます。マウスは長時間手術> 30分、またはマウスが乾いた表示される場合は、水分補給のための腹膜に0.2から0.3 mLの滅菌生理食塩水を注入する可能性を持っている場合。継続的な術後の鎮痛のためには、3日間1日2回ブプレノルフィンとマウスを提供する標準的な手法であり、その後8時間ごとに必要に応じて。
- 手術後の炎症を避けるために、アルコール綿棒でbetadineを拭き取ります。手術後の健康のその後の決定のための外科手術後の体重を記録してください。
- 手術後8〜24時間、必要な時にブプレノルフィンとマウスの追加鎮痛を与える、これは痛みを軽減し、マウスのclawing後の手術部位でのリードの配置の失敗を削減するとして。
5。代表的な結果
皮下の皮膚の下にリードを正しく実行するとき、マウスは腹部切開を閉じているはずです。通常、マウスは麻酔から回復するために10〜30分かかります。マウスは完全に手術から回復している前にそれは、モビリティの術後の体重減少と正規化の回復によって証明される、約7〜10日かかる。
手術から最も一般的な合併症は、手術後の最初の10日間の皮膚からの手足のリード線の浸食です。この一般的な合併症は、しっかりと皮下に皮下組織や腹膜につながる付着することで回避することができます。この手法は、マウスがambulates時に皮膚への圧力と摩擦を作成スラックリード線を、避けることができます。あまり一般的で、感染症や敗血症は無菌操作でエラーが発生し、または使用するテレメータの不完全な洗浄から発生する可能性がありますが。
心電図の出力は、データサイエンスインターナショナル(DSI)のようなデータ収集ソフトウェアと結合受信機の行列、記録することができる。波形の結果は、明確に定義されたP波、心房脱分極を示す、また、下の図3に示すように、心室脱分極を、意味するQRS波を含める必要があります。良質ECGトレースが1:1の割合で明確に定義されたQRS波の前に明確に定義されたP波を持つ必要があります。低いバックグラウンドシグナルとRR間隔が野生型マウスでは定期的にあるべき存在するはずです。質の悪いECGトレースは、その後のコンピュータ解析を困難にすることが不明瞭なPやQRS波、またはバックグラウンド信号を、可能性があります。貧しいECGトレースは通常、再注入するテレメータのリード、一度で固定してもよい。テレメータリードを再移植する、麻酔下でマウスを置いて、手術手技を使用して、直接問題の鉛を覆う皮膚に切開を行います。リード線がアクセスされると、リードをアンカー縫合糸を切断し、再びリードを固定する前に目的の場所にリードを移動する。最後に、6から0 Proleneで手術部位を閉じてください。

図1:正と負のリード線と小動物のテレメーターの例。一般的には、赤いリード線は、正極リードであり、そして白のリード線は負のリードです。各リード線はむき出しになったワイヤの絶縁被覆、5-7 mmとし、皮膚を通して、鉛の侵食を防止するプラスチックキャップの先端を、持つ必要があります。
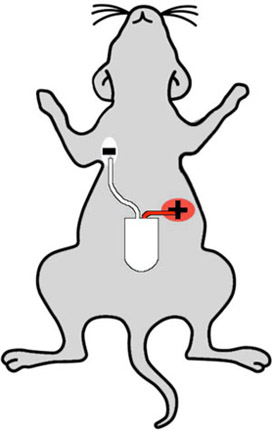
図2:マウスで適切なテレメータ注入部位を示す漫画。白(負の)リードは、マウスの右胸の上部に注入される、と赤(正の)リードは、テレメータの感覚その左腹部、"鉛の二つの"構成で配置されます。

図3:正常洞調律のマウスの代表波形。 P波は心房脱分極を表し、QRS波は心室の脱分極を表しています。高品質の波形は、1:1の比率でそれぞれのQRS波の前に明確なP波を持つ必要があります。
ディスカッション
この手順の重要なステップは、生存の手術前にマウスの適切な洗浄と準備です。テレメータとマウス手術部位が適切に洗浄されている場合、より良い手術後の転帰があります。さらに、配置を導くために細心の注意は、外科手術後の皮膚の侵食を軽減。技術への可能な変更は、ECG波形解析のためだけでなく、温度、さらには血圧の解析のためだけでなく、横方向のLV壁の機能を(私の構成を?...
謝辞
マークマッコーリーは、NIHメンター訓練助成金5T32HL066991 - 07でサポートされています
ザンダーWehrensは1R01HL091947 - 01A209と3R01HL089598 - 03S109 NIH / NHLBIの助成金によってサポートされています
資料
| Name | Company | Catalog Number | Comments |
| Steri 250 Bead Sterilizer | Inotech | IS-250 | |
| Blunt-Ended Scissors | Roboz Surgical Instruments Co. | RS-5980 | |
| Blunt-Ended Forceps (x2) | Roboz Surgical Instruments Co. | RS-5138 | |
| Veterinary Anesthesia Vaporizer | Surgivet | Isotec 4 | |
| T/Pump | Gaymar Industries | P/N11184-000 | |
| Propylene Blue Monofilament Suture | Ethicon Inc. | 8718 | |
| Povodone Iodine, 10% | Equate | N/A | |
| Alcohol Swabs | PDI | B339 | |
| Tergazyme | Alconox, Inc. | 21837-118 | |
| Wavidicde-01 | Medical Chemical Corporation | Wavicide-01 | |
| ECG Telemeter | DataSciences International | EA-F20 |
参考文献
- Cerrone, M. Bidirectional ventricular tachycardia and fibrillation elicited in a knock-in mouse model carrier of a mutation in the cardiac ryanodine receptor. Circ Res. 96 (10), e77-e77 (2005).
- Chelu, M. G. Calmodulin kinase II-mediated sarcoplasmic reticulum Ca2+ leak promotes atrial fibrillation in mice. J Clin Invest. 119 (7), 1940-1940 (1940).
- Sood, S. Intracellular calcium leak due to FKBP12.6 deficiency in mice facilitates the inducibility of atrial fibrillation. Heart Rhythm. 5 (7), 1047-1047 (2008).
- Swoap, S. J., Gutilla, M. J. Cardiovascular changes during daily torpor in the laboratory mouse. Am J Physiol Regul Integr Comp Physiol. 297 (3), R769-R769 (2009).
- Costa-Goncalves, d. a., C, A. Role of the multidomain protein spinophilin in blood pressure and cardiac function regulation. Hypertension. 52 (4), 702-702 (2008).
- Wehrens, X. H., Kirchhoff, S., Doevendans, P. A. Mouse electrocardiography: an interval of thirty years. Cardiovasc Res. 45 (1), 231-231 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved