JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스의 외래 ECG 기록
요약
Telemetric ECG는 심장 arrhythmias과 갑작스런 심장 죽음에 대한 동물 모델을 평가 필수적인 도구로 떠오르고있다. 여기, 우리는 생쥐의 장기 외래 ECG 모니터링 응용 프로그램에 대한 telemetric ECG 녹음에 stepwise 가이드를 제시한다.
초록
생쥐에서 Telemetric ECG 기록은 arrhythmias 뒤에 메커니즘, 전도 장애, 그리고 갑작스런 심장 죽음을 이해하는 것이 필수적입니다. 표면 ECG가 파형 간격의 단기 측정에 이용되지만, 그것은 심장 박동의 변화 또는 arrhythmias 희귀한 에피소드의 촬영의 장기 연구 실용적되지 않습니다. Implantable ECG의 telemeters 간단한 외과 이식, 외래 생쥐의 electrograms의 장기 저장, 여러 동물의 동시 녹음과 확장성의 장점을 제공합니다. 여기, 우리는 생쥐에서 외래 ECG 기록에 대한 telemeters의 주입에 대한 단계별 가이드를 제시한다. 무균 기술을 조심해, 준수는 주간 개월 주입 및 녹음의 가능성과 유리한 생존 결과에 필요합니다. 따라서, implantable ECG의 원격 측정에는 마우스와 같은 외래 동물 모델에서 심장 전기 생리학에 대한 중요 정보를 감지를위한 유용한 도구입니다.
프로토콜
1. 외과 이식을위한 측거기의 준비
- 마우스로 ECG 측거기를 삽입하기 전에, 그것은 ECG 측거기가 불임 좋은 작업 순서에 있는지 확인하는 것이 중요합니다. 새 원격 장치는 일반적으로 제조 업체가 살균 상태로 제공됩니다. ECG의 telemeters는 장치가 최소한 4 시간 동안 Tergazyme 1 % 용액을 사용하여 세척 제공 활용할 수 있습니다. 당신은 Tergazyme와 세척 후 살균 물을 측거기를 헹굴 수 있습니다. 또한, ECG 측거기을 소독하기 위해 밤새 Wavicide - 01 살균제를 사용합니다. 48시간 생쥐에 주입하기 전에 물을 살균 소독제 씻어주십시오. 멸균 용기에 보관하십시오.
- 측거기가 실시 와이어 모두의 무결성 및 단열 피복의 리드 확인합니다. 자석 측거기의 5cm 이내에 흔들를 사용하여 원격 측정 송신기를 켜고, 그리고 AM 라디오, 주파수 530로 신호를 테스트합니다. 신호는 강하고 명확해야하고 강도 및 와이어의 조작에 따라 피치 다양합니다. 모델 번호, 일련 번호 측거기 및 ECG 보정 값을 기록합니다. 제조 업체들은 종종 측거기가 주입하기 전에 24 시간 동안에있을 자세한 내용은 특정 측거기에 대한 설명서를 참조해야하는 것이 좋습니다. 이 예제에서, 우리는 이식을위한 데이터 과학 국제 (DSI) 측거기를 사용합니다.
- 측거기 리드 준비는 약 3.5 ㎝와 2.5 cm에 긍정적인 (적색) 리드에 대한 부정적인 (흰색) 리드를 절단하여 얻을 수 있습니다. 이것은 오른쪽 가슴에있는 부정적인 리드의 주입을위한 최적의 길이, 그리고 왼쪽 복부에 긍정적인 리드 (그림 2 참조)입니다. 다음 와이어 7mm를 노출하기 위해 절연 피복을 제거합니다. 이러한 베트 - 본드와 같은 무균 superglue과 금속 리드의 끝 부분을 페인트 다음 금속 팁을 초래할 뚜껑을 부착합니다. 이 모자는 위치를 이끌로 인해 피부 부식을 방지합니다. 약 2-3mm 금속 와이어는 기본 심장 리듬의 전기 감지에 대한 노출되어야합니다.
2. 측거기의 수술 주입
- murine 수술의 살균 기술을 사용하기 위해서는 멸균 장갑, 멸균 드레이프와 6-0 Prolene의 봉합이 필요합니다. 당신은 또한 1 무딘 종단 가위의 쌍을, 메스와 바늘 드라이버 소독 집게의 이쌍해야합니다. 외과 용구는 섭씨 250 도까지 가열 유리 비드 살균기에 소독 수 있습니다. 이전에 사용하기 전에 설명한대로 측거기을 소독하고 씻어주십시오.
- 첫번째 0.5 L / 분, 100 % O2 안에 isoflurane 3 % 사용하여 유도 상자에 마우스를 anesthetizing하여 수술 마우스를 준비합니다. anesthetized 마우스의 온도를 유지하는 등 따뜻한 물을 순환 T - 펌프로, 가열 패드를 사용합니다. 원하는 경우 온도, 직장 탐침에 의해 모니터할 수 있습니다. 마우스가 충분히 진정되면 완전히 전기 면도기와 마우스의 복부와 가슴 면도. 머리가 떨어져 직면하고 향해 꼬리, 부정사, 지속적인 흐름 관에 마우스를 전송하기 전에 isoflurane으로 마우스를 다시 마취. 가열 수술 테이블에 마우스 발냄새 아래 테이프. 면도 머리를 제거하고 수술 현장을 청소 알코올 면봉으로 복부를 닦아주십시오. 복부와 가슴을 소독하기 위해 면봉과 betadine 세 별도의 코팅을 적용합니다. 마우스 손톱 침대에서 압력을 적용하여 마취의 정확한 수준을 확인합니다. 마우스가 수술 준비되고 나면, 멸균 장갑을 사용하여 수술 부위에 멸균 드레이프를 적용합니다.
- Intraperitoneal 측거기 주입은 운동 생리학의 실험의 장점을 제공합니다. intraperitoneal 삽입 들어, 약 2.5 cm 길이의 복부를 overlying 피부에 수직으로 정중선 절개를 생성하기 위해 메스를 사용하여 수술을 시작합니다. 무딘 종단 가위를 사용하여 기본 결합 조직에서 조심스럽게 분리 피부. 그런 다음, 길이 약 1.5 cm를 복막을 overlying linea 알바에 수직으로 정중선 절개를 만듭니다. 또한 피하위한 콘센트가 연결 될 것입니다 복막 절개로 (두개골) 위의 복막에 작은 구멍을 만들 수 있습니다. 수술을 수행하는 동안, 때때로 운영 분야에 멸균 생리 드리핑하여 수술 사이트 촉촉한을 유지.
- 오른쪽 복막 구멍에 측거기를 넣습니다. 측거기 우수 구멍에 집게를 삽입하고 그들이 복막에서 protruding하므로 모두 선두 구멍 통해 연결 당기십시오. 1.5 cm 복막 수직 정중선 절개를 닫습 연속 6-0 Prolene 봉합을 사용합니다.
3. 이식 및 복부 폐쇄 리드
- ECG 리드는 리드 II 구성에 배치됩니다. 투명 / 백색 피복있는 단서는 부정적이며, 왼쪽 상단 복부에 저장됩니다. 첫째, 마우스의 오른쪽 상단 가슴에 0.5 cm의 피부 절개를 만듭니다.다음, 복부 절개로 터널을 만들 수있는 무딘 가위를 사용합니다. 터널을 통해 리드를 당겨하고 가슴 근육에 리드를 앵커에 6-0 Prolene의 치료를 사용합니다. 봉합사는 리드의 노출 부분의 맨 위에 있으며, 리드 및 기본 근육 사이 좋은 접촉을 생성되었는지 확인합니다. 근육에 리드를 고정하기 위해, 상기 한 근위 두 번째 치료를 사용합니다. 6-0 Prolene의 봉합사를 사용하여 피부 절개를 닫습니다.
- 긍정적인 리드 (빨간색 껍질)은 왼쪽 횡경막 아래의 왼쪽 복부와 심장 아래에 배치됩니다. 리드는 6-0 Prolene의 봉합에 의해 기본 복막 조직 정박하며 복막 조직과 잘 접촉이 있어야합니다. 리드 이식의 사이트가 가까이 수직 정중선 절개에 따라서 쉽게 기존의 수술 현장으로 액세스할 수 있기 때문에 추가적인 절개가이 단계에서 필요하지 않습니다. 복막 조직이 기본 대장의 천공을 피하기 위해 해제해야합니다.
- 레이어에 6-0 Prolene와 함께 순차적으로 복부 근막과 피부를 닫습니다.
4. 포스트 수술 케어
- [1 MG / ML] 즉시 수술 후 진통제에 대한 buprenorphine의 마우스 0.1 ML주세요. 온수 패드에 수술에서 회복하기 위해 마우스를 허용합니다. 마우스는 장시간 수술> 30 분, 또는 마우스가 건조 나타나는 경우, 당신이 rehydration 위해 복막에 0.2-0.3 ML 멸균 생리를 주입 수를 가지고있는 경우. 지속적인 사후 수술 진통제의 경우는 사흘 동안 회 buprenorphine와 마우스를 제공하기 위해 표준 관행이며, 다음 각 여덟 시간이나 필요에 따라.
- 후 수술 자극을 피하기 위해 알코올 면봉과 betadine를 청소하십시오. 이후 수술 건강 후속 결정에 대한 사후 수술 무게를 기록해야합니다.
- 수술 후 8-24시간이 고통을 줄이고 마우스가 사후 수술 사이트에서 긁어 대고에서 리드 배치 실패를 줄일 수 있듯이, 마우스에게 필요한 buprenorphine와 추가 진통제를 제공합니다.
5. 대표 결과
피하이 피부 아래의 리드와 함께 제대로 수행되면, 마우스는 복부 incisions를 닫았한다. 보통 마우스는 마취에서 회복하기 위해 10-30분 걸립니다. 생쥐가 완전히 수술에서 회복하기 전에는 이동성의 게시물 수술 체중 감소 및 정상화의 회복에 의해 입증에 대해 7~10일 소요됩니다.
수술의 가장 흔한 합병증은 수술 후 처음 10 일 동안 피부를 통해서 사지 리드의 침식이다. 이것은 일반적인 합병증은 확고하게 피하가 피하 조직이나 복막에 이르게 준수하여 피할 수 있습니다. 이 기술은 마우스 ambulates 때 피부에 압력과 마찰을 만들 느슨하게 리드를 방지합니다. 많이, 감염 및 패혈증 살균 기술에, 또는 사용 telemeters의 불완전 청소부터 오류에서 발생할 수 있지만.
ECG 출력 데이터 등 과학 국제 (DSI)와 같은 데이터 수집 소프트웨어와 결합하여 수신기 매트릭스에 의해 기록될 수 있습니다. 파형 결과는 아래 그림 3과 같이 명확하게 정의된 P 파, 심방 탈분극을 나타내는, 또한 심실 탈분극를 나타냅니다 QRS 파를 포함해야합니다. 양질의 ECG 흔적이 1:1 비율로 명확하게 정의된 QRS 파도 앞에 명확하게 정의된 P 파 있어야합니다. 가 낮은 백그라운드 신호이어야하며 RR 간격은 야생 형 생쥐의 정규해야합니다. 품질이 ECG 추적은 이후 컴퓨터 분석을 어렵게 할 수 있습니다 이것은 P 또는 QRS 파, 또는 배경 신호를 가질 수 있습니다. 가난한 ECG 추적은 일반적으로 다시 이온 주입 측거기 리드, 한 번에 하나의 고정된 수 있습니다. 측거기 리드를 다시 삽입하려면, 마취에서 마우스를 장소, 수술 기법을 사용, 직접 문제의 선두 overlying 피부에 절개를합니다. 선두에 액세스할 때 리드를 고정 봉합사를 잘라, 다시 리드를 고정하기 전에 원하는 위치로 리드를 이동합니다. 마지막으로, 6-0 Prolene으로 외과 사이트를 닫습니다.

그림 1 : 긍정적이고 부정적인 리드와 작은 동물 측거기의 예. 일반적으로 적색 리드는 긍정적인 리드이고, 떡밥은 부정적인 리드입니다. 각각의 리드는 노출 전선의 절연 피복 5-7 음, 그리고 피부를 통해 리드의 침식을 방지 비닐 덮인 팁을 보유해야합니다.
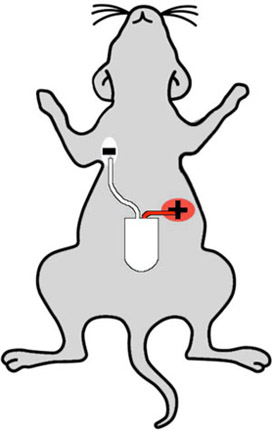
그림 2 : 마우스 적절한 측거기 주입 사이트를 보여주는 만화. 흰색 (음수) 리드는 마우스의 오른쪽 상단 가슴에 이식이며, 빨간색 (긍정적인) 리드는 왼쪽 복부, 등 그 측거기의 감각이 "리드 두"구성에 배치됩니다.

그림 3 : 정상 부비동 리듬에 마우스의 대표 파형. P 파는 심방 탈분극을 나타내고 QRS 복합은 심실 탈분극를 나타냅니다. 고품질의 파형은 1:1 비율의 각 QRS 복합 앞에 고유 P 파 있어야합니다.
Access restricted. Please log in or start a trial to view this content.
토론
이 절차의 중요한 단계는 생존 수술하기 전에 마우스의 적절한 청소하고 준비하고 있습니다. 측거기와 마우스 조직 사이트가 깨끗한지 때, 훨씬 더 이후의 수술 결과가 있습니다. 또한, 배치를 이끌주의는 이후 수술 피부 부식을 줄일 수 있습니다. 기술하는 것이 가능 개조 측면 LV 벽 기능 (I 구성을 리드), 또는뿐만 아니라 ECG 파형 분석을위한 원격 계측기로 송신하다의 사용을 평가하는 다른 구?...
Access restricted. Please log in or start a trial to view this content.
감사의 말
마크 맥컬리는 NIH 가르치고 - 교육 교부금 5T32HL066991 - 07에 의해 지원됩니다
젠더 Wehrens는 NIH / NHLBI 보조금 1R01HL091947 - 01A209 및 3R01HL089598 - 03S109에서 지원
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Steri 250 Bead Sterilizer | Inotech | IS-250 | |
| Blunt-Ended Scissors | Roboz Surgical Instruments Co. | RS-5980 | |
| Blunt-Ended Forceps (x2) | Roboz Surgical Instruments Co. | RS-5138 | |
| Veterinary Anesthesia Vaporizer | Surgivet | Isotec 4 | |
| T/Pump | Gaymar Industries | P/N11184-000 | |
| Propylene Blue Monofilament Suture | Ethicon Inc. | 8718 | |
| Povodone Iodine, 10% | Equate | N/A | |
| Alcohol Swabs | PDI | B339 | |
| Tergazyme | Alconox, Inc. | 21837-118 | |
| Wavidicde-01 | Medical Chemical Corporation | Wavicide-01 | |
| ECG Telemeter | DataSciences International | EA-F20 |
참고문헌
- Cerrone, M. Bidirectional ventricular tachycardia and fibrillation elicited in a knock-in mouse model carrier of a mutation in the cardiac ryanodine receptor. Circ Res. 96 (10), e77-e77 (2005).
- Chelu, M. G. Calmodulin kinase II-mediated sarcoplasmic reticulum Ca2+ leak promotes atrial fibrillation in mice. J Clin Invest. 119 (7), 1940-1940 (1940).
- Sood, S. Intracellular calcium leak due to FKBP12.6 deficiency in mice facilitates the inducibility of atrial fibrillation. Heart Rhythm. 5 (7), 1047-1047 (2008).
- Swoap, S. J., Gutilla, M. J. Cardiovascular changes during daily torpor in the laboratory mouse. Am J Physiol Regul Integr Comp Physiol. 297 (3), R769-R769 (2009).
- Costa-Goncalves, da, C, A. Role of the multidomain protein spinophilin in blood pressure and cardiac function regulation. Hypertension. 52 (4), 702-702 (2008).
- Wehrens, X. H., Kirchhoff, S., Doevendans, P. A. Mouse electrocardiography: an interval of thirty years. Cardiovasc Res. 45 (1), 231-231 (2000).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유