Method Article
Medicamentos sistémicos y locales de entrega para el Tratamiento de Enfermedades del Sistema Nervioso Central en modelos de roedores
En este artículo
Resumen
Exhaustivas pruebas preclínicas de fármacos que actúan en el sistema nervioso central a menudo incluye la evaluación y la comparación de biodistribución de drogas en asociación con rutas específicas de la administración. En este caso, tres métodos de uso general de la administración sistémica (intravenosa, intraperitoneal y oral), así como un método para la entrega local (convección mejorado la entrega) se ha demostrado en ratones.
Resumen
Exhaustivas pruebas preclínicas del sistema nervioso central (SNC) la terapéutica incluye la consideración de vías de administración y biodistribución del agente en la evaluación de la eficacia terapéutica. Entre las dos clasificaciones principales de la administración, local o sistémica, los enfoques de la administración sistémica se prefieren a menudo debido a la facilidad de administración. Sin embargo, la administración sistémica puede resultar en la concentración del fármaco óptimo se logra en el sistema nervioso central, y llevar a conclusiones erróneas respecto a la eficacia del agente. Los métodos locales de la administración de fármacos son más invasivas, pero pueden ser necesarias para alcanzar niveles terapéuticos de fármacos del SNC. Este sentido, demuestran la técnica apropiada para las tres rutas de la administración de fármacos sistémicos: inyección intravenosa, inyección intraperitoneal, y una sonda nasogástrica. Además, se muestra un método para la entrega local en el cerebro: la convección mejorada entrega (CED). El uso de compuestos marcados con fluorescencia se incluye en vivo de imágenes y verificación de la correcta administración del medicamento. Los métodos se presentan el uso de modelos murinos, pero se puede adaptar fácilmente para su uso en las ratas.
Protocolo
1. Métodos de entrega sistémica
Aunque la administración sistémica de drogas no es el enfoque más eficaz para el logro de altas concentraciones de drogas en el sistema nervioso central, la entrega sistémica son convenientes y bien aceptada por los pacientes. Aquí, vamos a demostrar los procedimientos adecuados para tres procedimientos que se acerca la administración sistémica: inyección intravenosa, inyección intraperitoneal, y una sonda nasogástrica.
A. inyección intravenosa (inyección de vena de la cola)
- Antes de iniciar el procedimiento, el peso corporal de los ratones deben ser registrados. Al igual que con todos los estudios preclínicos, el peso corporal debe ser monitoreada regularmente (dos veces por semana o más) para evaluar la toxicidad potencial de drogas. No más de 1% del peso corporal del ratón en el volumen debe ser inyectada en una sola vez. Por ejemplo, no más de 0,2 ml de líquido se debe inyectar en un ratón de 20g. Todos los fluidos inyectados por vía intravenosa deben ser esterilizados mediante un método apropiado.
- El ratón se debe calentar durante 5-10 minutos utilizando una almohadilla eléctrica o una lámpara de calor para dilatar la vena de la cola. Si se utiliza una lámpara de calor, controlar el ratón en todo momento para evitar la hipertermia.
- El ratón se transfiere a un dispositivo de retención, el cual restringe el ratón al tiempo que permite el acceso a la vena de la cola (ver video). En la cola del ratón hay cuatro vasos visibles: los vasos en los lados dorsal y lateral son las venas, y la embarcación en la parte ventral es una arteria. Para acceder a la vena de la cola, la cola del ratón se mantiene en el punto más distal, y se gira 90 grados para que la vena está mirando hacia arriba. El sitio de la inyección se limpia con un algodón con alcohol y una jeringa de insulina 28g se inserta lado biselado hacia arriba, en la vena (ver video). Si la aguja está correctamente colocado en la vena, se debe mover libremente y sin presión. Poco a poco se inyectan la droga, incluso con la presión sobre unos 5-10 segundos. Si aparece una ampolla en la cola, dejar de inyectarse, ya que esto indica que la aguja ya no está en la vena.
- Después de la inyección, aplique una leve presión sobre el sitio de la inyección hasta que el sangrado se detenga. Esto normalmente toma unos 30-60 segundos. Monitorear el ratón durante 5-10 minutos después de la inyección para asegurar que no hay sangrado posterior.
B. inyección intraperitoneal
- Antes de comenzar la inyección, la droga debe ser cargado en una jeringa conectada a una aguja 28G. Asegúrese de que no hay espacio en la jeringa para la elaboración del émbolo antes de la inyección (por ejemplo, si se inyectan 200μL, asegúrese de que la capacidad de la jeringa es 300μL o superior).
- Quitar el ratón de la jaula por la cola y colocarlo en una superficie con textura, por lo que el ratón tiene algo de donde agarrarse. Una tapa de caja es suficiente. Deje que el ratón para estirar su cuerpo y luego con su mano no dominante, sujete la piel en la parte trasera del ratón, teniendo cuidado de que pellizcar ligeramente la piel tanto como sea posible entre el pulgar y el dedo índice y medio (ver video). Ponga el ratón para que el abdomen del ratón es hacia arriba. Si el ratón se puede mover libremente la cabeza, soltar el agarre y vuelva a intentarlo, a fin de evitar ser mordido durante la inyección.
- Con su mano dominante, recoge la jeringa e inserte la aguja en un ángulo de 30 grados en el cuadrante inferior izquierdo del ratón (ver video). Al pasar el cursor ligeramente invertida le ayudará a mover los órganos de distancia del sitio de la inyección. Para asegurarse de que la aguja está en el espacio intraperitoneal, tire hacia atrás el émbolo de la jeringa. Si cualquier líquido o sangre en la jeringa, la aguja no está en el espacio intraperitoneal y debe ser eliminado. Si no hay líquido es aspirado en la jeringa, y luego inyectar el contenido de la jeringa con una presión uniforme sobre 5.1 segundos y suelte el ratón.
- Monitorear el ratón durante 5-10 minutos después de la inyección para asegurarse de que el ratón vuelve a los niveles de actividad normal.
C. oral por sonda
- Antes de comenzar la inyección, se registra el peso del ratón. El volumen máximo que puede ser entregado mediante una sonda nasogástrica es de 10 ml por kilogramo de peso corporal. Por ejemplo, el volumen máximo de un ratón de 20 g sería 200μL. Tratando de inyectar un mayor volumen puede resultar en reflujo, lo que hará que la administración de fármacos incompleta. Si es necesario administrar un mayor volumen que lo indicado anteriormente, hasta tres dosis se puede administrar más de 24 horas.
- Para evitar perforar el esófago, que es importante para medir la longitud de la aguja de una sonda para cada ratón. Mantenga una punta de bola 18g aguja curva sonda en la última costilla del ratón, y luego marque la longitud de la punta de la cabeza del ratón usando un marcador permanente (ver video). Durante la sonda, esta marca será un punto de parada al insertar la aguja en la boca del ratón.
- Restringir el ratón usando el mango igual que para una inyección intraperitoneal. Insertar la aguja sonda en la boca, sobre la lengua, y Advana vez que la aguja a través de la faringe. No inserte la aguja más allá de la marca de frenado. La aguja debe avanzar sin problemas, sin ningún tipo de presión (ver video). Si se encuentra con la presión, deténgase y retirar la aguja para evitar la inyección de líquido en los pulmones.
- Con la aguja en su lugar, el émbolo en 5.1 segundos y luego se retira la aguja en el mismo ángulo que se introdujo. Monitorear el ratón durante 5-10 minutos, prestando especial atención a cualquier signo de dificultad para respirar que puede indicar que el líquido ha entrado en los pulmones.
2. Entrega Local
Aguda por convección mejorado de entrega
A. La construcción de la sonda
Una cánula CED reflujo resistente a los roedores todavía no está comercialmente disponible. Aquí vamos a demostrar un método para la construcción de una cánula que es una adaptación de un método descrito por primera vez por Krauze et al (Krauze, 2005).
- La cánula tiene tres partes (Figura 1): tubos de sílice 100um de diámetro a través del cual fluye el líquido de infusión, una aguja de metal rígido de soporte estructural y tubo flexible de teflón para la carga de la infusión.
- Para obtener la aguja de metal rígido, con una llama para fundir el plástico en un catéter Surflo IV (24g estilete) y con unas pinzas retire la aguja de metal. El resto de la sonda puede ser descartada. Corta un trozo de tubo de sílice (OD 0.163mm), ligeramente más largo que la aguja de metal, utilizando una cuchilla de un solo filo. El papel de la sílice tubo en una pequeña gota de cianocrilato base de acción rápida adhesivo (por ejemplo, Krazy pegamento), teniendo cuidado de no conseguir algún tipo de pegamento en los extremos de la tubería. Inserte el tubo de sílice en la aguja de metal y dejar secar durante 5 minutos.
- Una vez seco, el tubo de sílice debe estar firmemente adherida a la aguja. Los extremos de la sílice se debe ajustar de manera que sobresalga 2 mm de tubo de sílice de la punta de la aguja y 3 mm de tubo de sílice sobresale desde el extremo plano (ver video).
- Corte una sección de tubería de teflón de 20 cm de longitud. Rollo de la aguja de metal en una pequeña gota de pegamento, de nuevo teniendo cuidado de no conseguir el pegamento en los extremos del tubo de sílice, ya que va a tapar la cánula. Insertar la aguja en el tubo de teflón a una profundidad de 1 cm. Deje secar durante 1 minuto. Utilizando una pistola de pegamento, aplique una gota de pegamento caliente a la articulación entre la aguja de metal y el tubo de teflón (ver video). Asegúrese de que el conjunto está cubierto por todos los lados y dejar secar por lo menos 1 hora. Cánulas se pueden hacer hasta una semana de antelación y se almacena a temperatura ambiente.
B. Procedimiento de infusión
- Para preparar la zona quirúrgica, todas las superficies deben ser rociadas con un desinfectante, como una solución de clorhexidina al 2%. Guantes quirúrgicos estériles deben ser usados durante el procedimiento. Las superficies son cubiertas con cortinas absorbente. Los siguientes materiales deben ser colocados en el área quirúrgica:
- Almohadilla eléctrica para mantener la temperatura del cuerpo del ratón
- Dos pequeñas cápsulas de Petri, que contiene 3% de peróxido de hidrógeno, y otro que contiene clorhexidina al 2%
- Hisopos estériles de gasa y algodón
- Escalpelos desechables estériles (Número 21)
- Agujas estériles 22g
- Ratón estereotáxica marco
- Velocidad controlada bomba de jeringa
- Autoclave de piel de ratón grapadora, grapas, y removedor de grapas
- Para configurar la cánula CED, adjunte una jeringa de 1 ml al tubo de teflón con un conjunto de adaptadores de jeringa de plástico. La cánula debe ser colocada en el marco estereotáxico para que sea perpendicular a la superficie quirúrgica (ver video). Para la desinfección de la cánula, llenar la jeringa 1 ml de etanol al 70% y el émbolo para ejecutar el etanol a través de la cánula. Repita este proceso con una solución salina estéril, y comprobar que no existen fugas en las juntas de la cánula. Para desinfectar el exterior de la cánula, frote suavemente con un 70% de etanol limpiar.
- Llenar la cánula con solución salina estéril y luego tire hacia atrás en la jeringa de modo que una pequeña burbuja de aire se introduce en la cánula. Esta burbuja de aire se separa el líquido de infusión de la solución salina en la cánula. Entonces, retrocarga su infusión (ver video). Conecte la jeringa de la bomba de jeringa y cebar la bomba con un breve funcionamiento de la cánula.
- Sedar al ratón usando un anestésico inyectado y preparar la piel con un algodón varias veces (5-10 segundos) con un trozo de gasa estéril empapado en la solución de clorhexidina al 2%. Ungüento oftálmico se debe aplicar al ratón para mantener la humedad adecuada durante el procedimiento. Con un bisturí estéril, crea una incisión sagital a lo largo del centro del cráneo, de aproximadamente 1,5 cm de largo (ver video). La superficie del cráneo se limpia con un algodón empapado en una solución de peróxido de hidrógeno al 3%. Tenga cuidado para evitar que el peróxido de hidrógeno en los ojos del ratón. Las líneas de sutura del cráneo debe ser evidente en este punto: si no son visibles, limpie suavemente el cráneo con una fresh hisopo de algodón empapado en una solución de peróxido de hidrógeno al 3%.
- Identificar el bregma (Figura 2) y luego medir de 2 mm a la derecha y posterior 1mm de esta estructura para localizar el lugar de la infusión. Con la aguja 22G estériles, suavemente crear un agujero en el cráneo en este punto al girar la aguja contra el cráneo (ver video). Evite forzar la aguja hacia abajo contra el cráneo.
- En este punto, el ratón debe ser colocado en el marco estereotáxico y comenzar a recibir anestesia inhalada (ver video). Administrar la anestesia en un nivel bajo (1%), ya que observe cuidadosamente el ratón de los cambios en la tasa de respiración, el ajuste de la anestesia en consecuencia.
- La posición de la cánula sobre el agujero del cráneo y luego baje de 3 mm por debajo de la superficie del cráneo. Comenzar la infusión, con las siguientes tarifas y duración:
0,1 l / min durante 5 minutos 
0,2 l / min durante 5 minutos 0,5 l / min durante 5 minutos 0,8 l / min durante 7,5 minutos OFF durante 1 minuto - Al final de la infusión, retirar la cánula lentamente y limpiar el cráneo con peróxido de hidrógeno al 3%. Aplicar cera de hueso estéril en el orificio (ver video). Con unas pinzas, sacar la piel a más de la calavera y grapas para cerrar. La buprenorfina debe ser administrado para aliviar el dolor post-operatorio.
- Monitorear el ratón después de la operación hasta que se recupera la conciencia y la movilidad. Debido a la duración del procedimiento, puede tomar hasta una hora para el ratón para recuperar la plena actividad. Durante este tiempo, lugar de la jaula del ratón sobre un cojín de la calefacción para evitar la hipotermia, y no la casa del ratón recuperación activa con otros ratones.
- Grapas de piel se debe quitar una semana después de la cirugía.
C. En Vivo Imágenes
Infusión con fluorescencia con etiqueta puede formar una imagen después de la administración de exclusión, y se puede controlar los cambios en la intensidad de la señal así como la ubicación de la señal. Por lo general, lo mejor es esperar 2-3 horas después de la infusión de la imagen, a fin de que el ratón para recuperarse de la infusión.
- Para la anestesia durante la exploración, utilice un bajo nivel de un anestésico inhalado. Coloque el ratón, la parte dorsal para arriba, en una estación de imágenes (por ejemplo, IVIS Lumina, Caliper Life Sciences, Alameda, CA). El uso de un ajuste adecuado de filtro para el flúor es que se explora, obtener una imagen. Para CED, una infusión de éxito deben mostrar la mayor parte del material en el cerebro, cerca del lugar de la perfusión (Figura 3).
3. Resultados representante
La falta de reacción adversa a la administración de la terapia es un indicador importante de la inyección de éxito. Por ejemplo, después de la inyección vena de la cola no debería haber ningún cambio en la apariencia (por ejemplo, tamaño, color) de la cola. Una burbuja o ampolla después de la inyección vena de la cola se indican por vía subcutánea, en lugar de la administración intravenosa, de la terapia. Para inyección intraperitoneal, una protuberancia en la piel o decoloración del abdomen puede indicar una inyección subcutánea o daños a las estructuras internas. En una sonda nasogástrica, un ratón con dificultad para respirar o la tos puede indicar que el líquido se inyecta en los pulmones, en lugar de en el estómago.
Para CED, la función neurológica es importante para evaluar la administración exitosa de la terapia. Un ratón que se presentan convulsiones o hemiparesia puede haber recibido una infusión inadecuada. Si una infusión fluorescente se utiliza, en vivo de imágenes se pueden aplicar para evaluar la gestión exitosa (Figura 3). Si la infusión no se localiza en el sitio de la inyección, la infusión no tuvo éxito.

Figura 1: Cánula CED y Quirúrgicas Set-up. Los elementos básicos de la entrega de convección-quirúrgica mayor puesta a punto se muestran. Una bomba de microinfusión (A) está conectado a la cánula de infusión (B, que se muestra ampliada en la parte superior). Un marco estereotáxico (C) se utiliza para colocar la sonda. Esta imagen no cuentan con calefacción y equipos de anestesia también se utiliza durante el procedimiento.

Figura 2: El ratón de las líneas de sutura del cráneo. El lugar de la infusión CED (estrella roja) se puede encontrar mediante la identificación de la intersección de las suturas coronal y sagital (bregma) y la medición de 2 mm y 1 mm lateral posterior de la bregma.
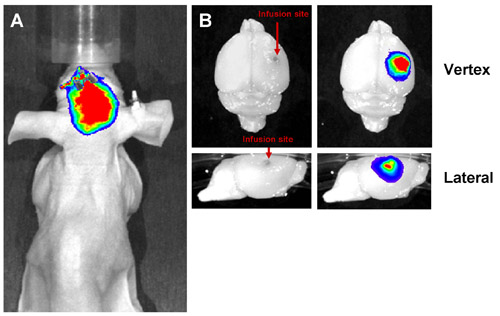
Figura 3: Resultados de Representante de CED éxito. Liposomes marcado con un colorante fluorescente rojo lejano se infunde en el cerebro del ratón por la CED y la imagen tanto in vivo como ex vivo. Una infusión de éxito muestra una señal fluorescente localizadas en el lugar de la infusión, tanto en vivo (A) y ex vivo (B). La señal debe estar localizado en el hemisferio infundido sin fugas en el hemisferio contralateral.
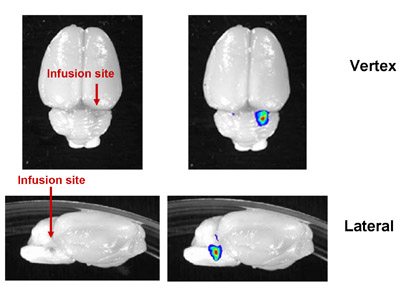
Figura 4: imagen representativa de la CED con éxito en el tronco cerebral de rata. Liposomas con fluorescencia marcado se infunde en el tronco cerebral de la rata. En ratas, tanto como 20μL puede infundir. El aumento del grosor del cráneo de la rata y profundidad de la inyección impedido de imágenes in vivo, pero la ubicación correcta de infusión pudo ser verificada por el ex imágenes in vivo del cerebro disecado.
Discusión
La evaluación preclínica de la eficacia de cualquier agente terapéutico debe tomar en cuenta las propiedades farmacológicas del agente y el tejido diana de interés. Mientras que los métodos sistémicos de la administración son en general más fácil y mejor tolerado por los pacientes, la selectividad de la barrera sangre-cerebro a menudo se requiere la entrega local de la terapia para el tratamiento de la enfermedad del SNC. En este caso, hemos demostrado un método de entrega directa al cerebro: CED. Otras formas de entrega local en el cerebro incluyen la administración directa al líquido cefalorraquídeo, la inyección intratumoral de bolo, y la inyección ventricular. Para estos métodos, capacidad de difusión de la terapéutica es muy importante, con la difusión de los pobres de la región de limitar la cobertura a unos milímetros del lugar de inyección (Jain 1989, Bobo, 1994). Por el contrario, CED utiliza presión positiva para aumentar el área de distribución de drogas (Bobo, 1994), al tiempo que permite terapéuticas dirigidas a determinadas estructuras neuroanatómicas. En nuestro laboratorio, hemos logrado CED realiza en el tronco cerebral, así como en el putamen caudado en los roedores (Figura 4).
La capacidad de realizar CED en modelos de roedores se ha convertido cada vez más importante en relación con el creciente interés en la maximización de la eficacia terapéutica en el tratamiento de varios tipos de enfermedad del SNC. CED se puede utilizar para ofrecer una variedad de agentes, incluyendo las proteínas purificadas, medicamentos de moléculas pequeñas, y los virus (Gill 2003, Degen 2003, Szerlip 2007). La gama de enfermedades que pueden ser tratados con CED incluye los cánceres del sistema nervioso central (Yamashita 2007), así como las enfermedades neurodegenerativas como la enfermedad de Parkinson (Gill 2003). Como la investigación CED sigue creciendo, la necesidad de imágenes in vivo de la terapia administrada CED es igualmente creciente. Mientras que la proyección de imagen fluorescente demostrado aquí probablemente no sería visible a través del cráneo humano, el empleo de otros métodos de co-inyección de agentes de contraste de resonancia magnética (Dickinson 2008) están atrayendo el interés de evaluar la aplicabilidad de control infusiones en pacientes con enfermedad del SNC.
Divulgaciones
Agradecimientos
NS65819 (CDJ, A), NS049720 (CDJ), CA097257 (CDJ, A), CIRM DR1-01426
Nos gustaría dar las gracias a Raquel Santos de asistencia técnica.
Materiales
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 2% Chlorhexidine | Fisher | NC9756995 | AKA “Nolvasan” | |
| 20g Needle | Becton Dickinson | 305175 | ||
| 28g Needle (with syringe) | Fisher | 22-004-270 | AKA Insulin Syringe | |
| 3% Hydrogen Peroxide | Fisher | H312P-4 | Store away from light | |
| Cotton Swabs | Fisher | 23-400-100 | Autoclave before use | |
| Cyanoacrylate-based Adhesive | Fisher | NC9592632 | AKA “Krazy Glue” | |
| Disposable Scalpels | Feather | 2975 | No. 21 | |
| Gauze | Fisher | 22028563 | Autoclave before use | |
| Heating Pad | Dunlap | HP950 | ||
| I.V. Catheter | Fisher | 14-841-20 | ||
| Infusion Pump | BASi | MD-1000, MD-1001 | ||
| Living Image Software | Caliper Life Sciences | Contact for Quote | ||
| Ophthalmic Ointment | Cardinal Health | 1272830 | AKA “Akwa Tears” | |
| Plastic Syringe Adaptors | Upchurch Scientific | P-604, P-200NX, P-215X, P-630 | Fits on Luer Lock Syringes | |
| Silica Tubing | Polymicro Technologies | 2000020 | ||
| Skin Stapler, Staples, Remover | Stoelting | 59020 | ||
| Stereotaxic Frame | Stoelting | 51725 | ||
| Teflon Tubing | Upchurch Scientific | 1520 | ||
| Xenogen Lumina | Caliper Life Sciences | Contact for Quote |
Referencias
- Bobo, R. H., Laske, D. W., Akbasak, A., Morrison, P. F., Dedrick, R. L., Oldfield, E. H. Convection-enhanced delivery of macromolecules in the brain. Proc. Natl. Acad. Sci. 91, 2076-2080 (1994).
- Degen, J. W., Walbridge, S., Vortmeyer, A. O., Oldfield, E. H., Lonser, R. R. Safety and efficacy of convection-enhanced delivery of gemcitabine or carboplatin in a malignant glioma model in rats. J Neurosurg. 99, 893-898 (2003).
- Dickinson, P. J., LeCouteur, R. A., Higgins, R. J., Bringas, J. R., Roberts, B., Larson, R. F., Yamashita, Y., Krauze, M. T., Noble, C. O., Drummond, D. C., Kirpotin, D. B., Park, J. W., Berger, M. S., Bankiewicz, K. S. Canine model of convection-enhanced delivery of liposomes containing CPT-11 monitored with real-time magnentic resonance imaging: laboratory investigation. J Neurosurg. 108, 989-998 (2008).
- Gill, S. S., Patel, N. K., Hotton, G. R., O'Sullivan, K., McCarter, R., Bunnage, M., Brooks, D. J., Svendsen, C. N., Heywood, P. Direct brain infusion of glial cell line-derived neurotrophic factor in Parkinson disease. Nature Medicine. 9, 589-595 (2003).
- Jain, R. K. Delivery of novel therapeutic agents in tumors: physiological barriers and strategies. J Natl Cancer Inst. 81, 570-576 (1989).
- Krauze, M. T., Saito, R., Noble, C. O., Tamas, M., Bringas, J., Park, J. W., Berger, M. S., Bankiewicz, K. Reflux-free cannula for convection-enhanced high-speed delivery of therapeutic agents. J Neurosurg. 103, 923-929 (2005).
- Krauze, M. T., Vandenberg, S. R., Yamashita, Y., Saito, R., Forsayeth, J., Noble, C. O., Park, J. W., Bankiewicz, K. Safety of real-time convection-enhanced delivery of liposomes to primate brain: a long-term retrospective. Exp Neurol. 210, 638-644 (2008).
- Murad, G. J., Walbridge, S., Morrison, P. F., Garmestani, K., Degen, J. W., Brechbiel, M. W., Oldfield, E. H., Lonser, R. R. Real-time, image-guided, convection-enhanced delivery of interleukin 13 bound to pseudomonas exotoxin. Clin Cancer Res. 12, 3145-3151 .
- Ozawa, T., James, C. D., Van Meir, E. Human Brain Tumor Cell and Tumor Tissue Transplantation Models. CNS Cancer: Models, Markers, Prognostic Factors, Targets, and Therapeutic Approaches. , 147-162 (2009).
- Szerlip, N. J., Walbridge, S., Yang, L., Morrison, P. F., Degen, J. W., Jarrell, S. T., Kouri, J., Kerr, P. B., Kotin, R., Oldfield, E. H., Lonser, R. R. Real-time imaging of convection-enhanced delivery of viruses and virus-sized particles. J Neurosurg. 107, 560-567 (2007).
- Yamashita, Y., Krauze, M. T., Kawaguchi, T., Noble, C. O., Drummond, D. C., Park, J. W., Bankiewicz, K. S. Convection-enhanced delivery of a topoisomerase I inhibitor (nanoliposomal topotecan) and a topoisomerase II inhibitor (pegylated liposomal doxorubicin) in intracranial brain tumor xenografts. Neuro Oncol. 9, 20-28 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados