Method Article
Drug Delivery sistemica e locale per la cura delle malattie del Sistema Nervoso Centrale in modelli di roditori
In questo articolo
Riepilogo
Approfondita sperimentazione preclinica di farmaci che agiscono nel sistema nervoso centrale spesso comporta la valutazione e il confronto biodistribuzione farmaco in associazione con percorsi specifici di somministrazione. Qui, tre metodi comunemente usati di consegna sistemica (per via endovenosa, intraperitoneale e orale), nonché un metodo per la consegna locale (convezione-enhanced consegna) sono dimostrati nei topi.
Abstract
Approfondito test preclinici del sistema nervoso centrale (SNC) terapie include una considerazione di vie di somministrazione e di biodistribuzione agente nella valutazione dell'efficacia terapeutica. Tra le due categorie principali di amministrazione, locale vs sistemica, gli approcci sistemici di consegna sono spesso preferiti a causa della facilità di somministrazione. Tuttavia, la consegna sistemica può determinare concentrazione del farmaco non ottimale stato raggiunto nel SNC, e condurre a conclusioni errate per quanto riguarda l'efficacia degli agenti. Locali metodi di somministrazione dei farmaci sono più invasive, ma possono essere necessarie per raggiungere livelli terapeutici farmaco sistema nervoso centrale. In questo studio dimostriamo tecnica corretta per tre vie di somministrazione dei farmaci sistemici: iniezione endovenosa, iniezione intraperitoneale, e sonda gastrica. Inoltre, mostriamo un metodo per la consegna locale al cervello: convezione-enhanced consegna (CED). L'uso di composti marcati con fluorescenza è incluso per imaging in vivo e la verifica della corretta somministrazione del farmaco. I metodi sono presentati utilizzando modelli murini, ma può essere facilmente adattato per l'utilizzo nei ratti.
Protocollo
1. Metodi di consegna sistemica
Anche se la consegna di farmaci sistemici non è l'approccio più efficiente per raggiungere elevate concentrazioni del farmaco nel sistema nervoso centrale, le consegne sistemici sono comodi e ben accettato dai pazienti. Qui dimostreremo procedure corrette per tre approcci sistemici solitamente usata somministrazione: iniezione endovenosa, iniezione intraperitoneale, e sonda gastrica.
A. iniezione per via endovenosa (Vein iniezione di coda)
- Prima di iniziare la procedura, il peso corporeo di ogni mouse deve essere registrato. Come per tutti gli studi preclinici, il peso corporeo devono essere controllati regolarmente (due volte alla settimana o più) per valutare la potenziale tossicità dei farmaci. Non oltre l'1% del peso corporeo del mouse in volume dovrebbe essere iniettato in una sola volta. Per esempio, non più di 0,2 ml di liquido deve essere iniettato in un topo 20g. Tutti i fluidi iniettati per via endovenosa deve essere sterilizzati con un metodo appropriato.
- Il mouse deve essere portata per 5-10 minuti utilizzando una piastra elettrica o una lampada di calore per dilatare la vena della coda. Se si utilizza una lampada di calore, monitorare il mouse in qualsiasi momento per evitare l'ipertermia.
- Il mouse è trasferito ad un dispositivo di ritenuta, che trattiene il mouse, consentendo l'accesso alla vena della coda (vedi video). Nella coda di topo ci sono quattro vasi visibili: i vasi sui lati dorsale e laterali sono le vene, e la nave sul lato ventrale è un'arteria. Per accedere alla vena della coda, la coda del topo si tiene presso il punto più distale, e ruotato di 90 gradi in modo che la vena è rivolto verso l'alto. Il sito di iniezione viene pulito con un batuffolo di cotone imbevuto di alcool e una siringa da insulina 28g viene inserito, lato smussato alto, nella vena (vedi video). Se l'ago è correttamente posizionato nella vena, dovrebbe muoversi liberamente e senza pressioni. Iniettare lentamente il farmaco con una pressione uniforme sul 5-10 secondi. Se una bolla appare sulla coda, stop iniezione in quanto questo indica che l'ago non è più in vena.
- Dopo l'iniezione, applicare una leggera pressione al sito di iniezione fino a quando l'emorragia si ferma. Questa operazione richiede normalmente 30-60 secondi. Monitorare il mouse per 5-10 minuti dopo l'iniezione per assicurarsi che non ci sono ulteriori emorragie.
B. iniezione intraperitoneale
- Prima di iniziare l'iniezione, il farmaco deve essere caricato in una siringa collegata ad un ago 28g. Assicurarsi che ci sia spazio nella siringa per il disegno indietro il pistone prima dell'iniezione (ad esempio, se l'iniezione 200μL, assicurarsi che la capacità siringa è 300μL o superiore).
- Rimuovere il mouse dalla gabbia per la coda e collocarla su una superficie strutturata, in modo che il mouse ha qualcosa da presa. Un coperchio gabbia di solito è sufficiente. Lasciare che il mouse per allungare il suo corpo e poi usare i tuoi mano non dominante, afferrare la pelle sul dorso del mouse, avendo cura di pizzicare leggermente la pelle il più possibile tra il pollice e indice e il medio (vedi video). Girare il mouse in modo che l'addome del mouse è rivolto verso l'alto. Se il mouse può liberamente muovere la testa, rilasciare la presa e riprovare, in modo da evitare di essere morsi durante l'iniezione.
- Con la mano dominante, prendere la siringa ed inserire l'ago con un angolo di 30 gradi nel quadrante in basso a sinistra del mouse (vedi video). Tenendo il mouse leggermente invertita aiuterà spostare gli organi di distanza dal sito di iniezione. Per assicurarsi che l'ago sia nello spazio intraperitoneale, tirare indietro lo stantuffo della siringa. Se qualsiasi liquido o sangue appare nella siringa, poi l'ago non è nello spazio intraperitoneale e deve essere rimosso. Se non fluido è aspirato nella siringa, iniettare il contenuto della siringa con una pressione uniforme sul 1-5 secondi e rilasciare il mouse.
- Monitorare il mouse per 5-10 minuti dopo l'iniezione per assicurare che il mouse ritorna a livelli normali attività.
C. orale Gavage
- Prima di iniziare l'iniezione, registrare il peso del mouse. Il volume massimo che può essere consegnato mediante sonda gastrica è 10 ml per chilogrammo di peso corporeo. Per esempio, il volume massimo di un mouse 20g sarebbe 200μL. Tentare di iniettare maggiori volumi può causare reflusso, che causerà consegna incompleta droga. Se è necessario somministrare maggiori volumi rispetto a quello sopra, fino a tre dosi possono essere somministrate in 24 ore.
- Per evitare la puntura del esofago, è importante misurare la lunghezza dell'ago sonda gastrica per ogni mouse. In possesso di una punta 18g palla ago curvo sonda gastrica al livello dell'ultima costola del mouse, e segnare la lunghezza alla punta della testa del mouse utilizzando un pennarello indelebile (vedi video). Durante la sonda gastrica, questo marchio sarà un punto di sosta quando si inserisce l'ago nella bocca del mouse.
- Trattenere il mouse utilizzando la stessa presa per mano come un'iniezione intraperitoneale. Inserire l'ago sonda gastrica in bocca, sulla lingua, e ADVAUna volta che l'ago attraverso la faringe. Non inserire l'ago passato il segno di fermarsi. L'ago dovrebbe procedere senza intoppi, senza alcuna pressione (vedi video). Se si verificano pressioni, stop e togliere l'ago per evitare l'iniezione di liquido nei polmoni.
- Con l'ago in posizione, spingere il pistone in 1-5 secondi e quindi rimuovere l'ago lo stesso angolo che è stato inserito. Monitorare il mouse per 5-10 minuti, prestando attenzione a eventuali segni di respiro affannoso che potrebbe indicare che il liquido è entrato nei polmoni.
2. Consegna locali
Acuta convezione-Enhanced consegna
A. Sonda Costruzione
Un reflusso resistente cannula CED per i roditori non è ancora disponibile in commercio. Qui si dimostrerà un metodo per la costruzione cannula che è stata adattata da un primo metodo descritto da Krauze et al (Krauze 2005).
- La cannula ha tre parti (figura 1): 100um tubo di silice di diametro attraverso il quale i flussi infusate, un ago metallico rigido per il supporto strutturale, e tubi flessibili in teflon per il caricamento del infusate.
- Per ottenere l'asta rigida di metallo, usare fiamme libere per fondere la plastica su un catetere Surflo IV (24g stiletto) e con delle pinzette rimuovere l'ago metallico. Il resto del catetere può essere scartata. Tagliare un pezzo di tubo di silice (OD 0,163 millimetri), leggermente più lungo che l'ago metallico, utilizzando un singolo filo della lama di rasoio. Ruolo il tubo di silice in una piccola goccia di cianoacrilato base ad azione rapida adesivo (ad esempio Krazy Glue), avendo cura di non avere la colla sulle estremità del tubo. Inserire il tubo di silice nella ago di metallo e lasciare asciugare per 5 minuti.
- Una volta asciutto, il tubo di silice devono essere saldamente apposta ago. Le estremità della silice deve essere tagliato in modo che sporge di 2 millimetri di silice tubo dal l'estremità appuntita dell'ago e 3mm di silice tubo sporge dalla fine piatta (vedi video).
- Tagliare una sezione di tubo in Teflon 20 cm di lunghezza. Rotolo l'ago di metallo in una piccola goccia di adesivo, sempre facendo attenzione a non prendere la colla sulle estremità del tubo di silice in quanto ciò ostruire la cannula. Inserire l'ago nel tubo in Teflon ad una profondità di 1 cm. Lasciate asciugare per 1 minuto. Utilizzando una pistola per colla, applicare una goccia di colla a caldo al giunto tra l'ago metallico e il tubo in Teflon (vedi video). Assicurarsi che il comune è coperto su tutti i lati e lasciare asciugare per almeno 1 ora. Cannule possono essere effettuate fino a una settimana di anticipo e conservato a temperatura ambiente.
B. Procedura di Infusione
- Per preparare l'area chirurgica, tutte le superfici devono essere irrorate con un disinfettante, come ad esempio una soluzione di clorexidina al 2%. Guanti chirurgici sterili dovrebbero essere indossati durante la procedura. Le superfici vengono poi coperti con drappi assorbente. Le seguenti forniture deve essere posto in zona chirurgica:
- Riscaldamento pad per mantenere la temperatura corporea del mouse
- Due piccoli piatti Petri, uno contenente perossido di idrogeno al 3%, e uno contenente 2% di clorexidina
- Garza sterile e cotone tamponi
- Bisturi sterili monouso (Numero 21)
- Aghi sterili 22g
- Topo stereotassica telaio
- Controllato tasso di pompa a siringa
- Autoclave del mouse pelle cucitrice, graffette, e rimozione di base
- Per configurare la cannula CED, allegare una siringa 1 ml al tubo in Teflon utilizzando un set di adattatori siringa di plastica. La cannula deve essere applicata al telaio stereotassico in modo che sia perpendicolare alla superficie chirurgico (vedi video). Per disinfettare la cannula, riempire la siringa con 1 ml di etanolo al 70% e premere lo stantuffo per eseguire l'etanolo attraverso la cannula. Ripetere questo processo con una soluzione fisiologica sterile, e controllare eventuali perdite intorno alle articolazioni cannula. Per disinfettare la parte esterna della cannula, pulire delicatamente con etanolo al 70% pulire.
- Riempire la cannula con soluzione salina sterile e poi tirare indietro siringa in modo che una piccola bolla d'aria è aspirata nella cannula. Questa bolla d'aria separerà le infusate dal salino nella cannula. Poi, backload tuo infusate (vedi video). Collegare la siringa alla pompa siringa e adescare la pompa con una breve esecuzione della cannula.
- Sedare il mouse utilizzando un anestetico iniettato e preparare la pelle dal tampone più volte (per 5-10 secondi) con un pezzo di garza sterile immerso nella soluzione di clorexidina al 2%. Pomata oftalmica deve essere applicato il mouse per mantenere l'umidità adeguata durante la procedura. Usando un bisturi sterile, creare una incisione sagittale lungo il centro del cranio, lungo circa 1,5 centimetri (vedi video). La superficie del cranio è poi puliti con un tampone di cotone imbevuto di una soluzione di perossido di idrogeno al 3%. Fare attenzione per evitare di perossido di idrogeno agli occhi del mouse. Le linee di sutura del cranio dovrebbe essere evidente a questo punto: se non sono visibili, tampone delicatamente il cranio con un fresh batuffolo di cotone imbevuto di soluzione di perossido di idrogeno al 3%.
- Identificare il bregma (Figura 2) e quindi misurare 2mm a destra e posteriore 1mm di questa struttura per individuare il sito di infusione. Utilizzando l'ago sterile 22g, delicatamente creare un foro nel cranio, a questo punto ruotando l'ago contro il cranio (vedi video). Evitare assolutamente di forzare l'ago verso il basso contro il cranio.
- A questo punto, il mouse deve essere posizionato nel frame stereotassico e iniziare a ricevere anestesia per via inalatoria (vedi video). Somministrare l'anestetico ad un livello basso (1%), e monitorare attentamente il mouse per i cambiamenti nel tasso di respirazione, regolando di conseguenza l'anestetico.
- Posizionare la cannula sopra il foro del cranio e quindi abbassare 3 mm sotto la superficie del cranio. Iniziare l'infusione, applicando le seguenti aliquote e le durate:
0,1 microlitri / min per 5 minuti 
0,2 microlitri / min per 5 minuti 0,5 microlitri / min per 5 minuti 0,8 microlitri / min per 7,5 minuti OFF per 1 minuto - Al termine dell'infusione, rimuovere lentamente la cannula e tampone del cranio con perossido di idrogeno al 3%. Applicare la cera sterile osso al foro (vedi video). Utilizzando pinze, disegnare la pelle insieme il cranio e fiocco a chiudere. Buprenorfina deve essere somministrato per il post-operatorio del dolore.
- Monitorare il mouse post-operatoria fino a quando non riprende conoscenza e di mobilità. A causa della lunghezza della procedura, può richiedere fino a un'ora per il mouse per riguadagnare piena attività. Durante questo tempo il luogo della gabbia del mouse su una piastra elettrica per evitare l'ipotermia, e non la casa del topo recupero con altri topi attivi.
- Graffette pelle deve essere rimosso una settimana dopo l'intervento chirurgico.
C. imaging in vivo
Infusate fluorescenza marcato può essere ripreso in seguito alla somministrazione CED, e possono essere monitorati per i cambiamenti di intensità del segnale e posizione del segnale. In genere, è meglio aspettare 2-3 ore dopo l'infusione di immagine, in modo da consentire il mouse per recuperare l'infusione.
- Per l'anestesia durante l'imaging, usare un basso livello di un anestetico per via inalatoria. Posizionare il mouse, lato dorsale alto, in una stazione di imaging (ad esempio, IVIS Lumina, Caliper Life Sciences, Alameda, CA). Utilizzando un filtro impostazione appropriata per il fluoro, che viene esposta, acquisire un'immagine. Per CED, un infuso di successo dovrebbe mostrare maggior parte del materiale del cervello in prossimità del sito di infusione (Figura 3).
3. Rappresentante Risultati
La mancanza di reazione avversa alla somministrazione della terapia è un importante indicatore di iniezione di successo. Per esempio, dopo l'iniezione coda vena ci dovrebbe essere nessun cambiamento di aspetto (ad esempio, dimensioni, colore) della coda. Una bolla o blister dopo l'iniezione coda vena indicherebbe sottocutanea, piuttosto che per via endovenosa, la consegna della terapia. Per iniezioni intraperitoneali, un urto sulla pelle o decolorazione dell'addome può indicare iniezione sottocutanea o danni alle strutture interne. In sonda gastrica, un mouse con respiro affannoso o tosse può indicare che il liquido è stato iniettato nei polmoni, invece che nello stomaco.
Per CED, la funzione neurologica è importante per valutare la somministrazione di successo della terapia. Un mouse che sta esibendo convulsioni o emiparesi potrebbe aver ricevuto una infusione improprio. Se un infusate fluorescente viene utilizzato, imaging in vivo può essere applicato per la valutazione della efficacia dell'amministrazione (Figura 3). Se il infusate non è localizzata al sito di iniezione, l'infusione non ha avuto successo.

Figura 1: Cannula CED e Chirurgiche Set-up. Gli elementi di base della convezione avanzata parto chirurgico set-up sono mostrati. Una pompa microinfusion (A) è collegato alla cannula di infusione (B, l'ingrandimento in alto). Una cornice stereotassica (C) viene utilizzato per posizionare la sonda. Questa immagine non comprendono il riscaldamento e le attrezzature anestetico utilizzato anche durante la procedura.

Figura 2: Mouse linee di sutura Teschio. Il sito di infusione CED (stella rossa) può essere localizzato, individuando l'intersezione delle suture sagittali e coronali (il bregma) e poi misura due millimetri laterale e 1 millimetro posteriore del bregma.
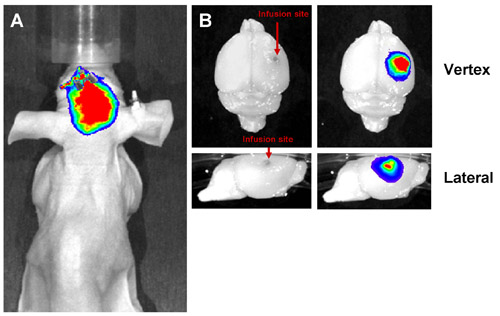
Figura 3: Risultati Rappresentante CED di successo. Liposomes etichettati con un far-rosso colorante fluorescente sono state infuse nel cervello di topo da CED e ripreso sia in vivo ed ex vivo. Una infusione di successo mostra un segnale fluorescente localizzato al sito di infusione sia in vivo (A) ed ex vivo (B). Il segnale deve essere localizzata nell'emisfero infusa senza dispersione nell'emisfero controlaterale.
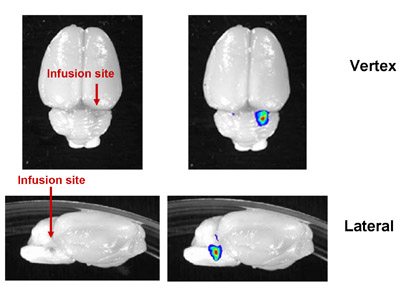
Figura 4: Immagine rappresentante del CED di successo nel tronco cerebrale di ratto. Liposomi fluorescenza-marcato infuse in tronco cerebrale di ratto. Nei ratti, per quanto 20μL può essere infusa. Lo spessore maggiore del cranio ratto e la profondità di iniezione precluso imaging in vivo, ma la posizione infusione corretta potrebbe essere verificato da ex-imaging in vivo del cervello sezionato.
Discussione
Valutazione preclinica dell'efficacia di qualsiasi agente terapeutico deve tenere in considerazione le proprietà farmacologiche di un agente e il tessuto bersaglio di interesse. Mentre i metodi di somministrazione sistemica sono in generale più facile e meglio tollerato dai pazienti, la selettività della barriera emato-encefalica spesso necessita di consegna locale della terapia per il trattamento delle malattie del SNC. Qui, abbiamo dimostrato un metodo di consegna diretta al cervello: CED. Altre forme di consegna locale al cervello comprendono la somministrazione diretta al fluido cerebro-spinale, l'iniezione in bolo intratumorale, e l'iniezione ventricolare. Per questi metodi, diffusibilità di terapeutico è di fondamentale importanza, con scarsa diffusione limitando la regione di copertura a pochi millimetri dal sito di iniezione (Jain 1989, Bobo 1994). Al contrario, CED utilizza la pressione positiva per aumentare l'area di distribuzione della droga (Bobo 1994), pur consentendo targeting terapeutico per specifiche strutture neuroanatomiche. Nel nostro laboratorio, abbiamo effettuato con successo CED nel tronco cerebrale e nel caudato putamen nei roditori (Figura 4).
La capacità di condurre CED in modelli di roditori è diventato sempre più importante in associazione con crescente interesse a massimizzare l'efficacia terapeutica nel trattamento di vari tipi di malattie del SNC. CED possono essere usati per fornire una varietà di agenti, tra cui proteine purificate, le droghe piccola molecola, e virus (Gill 2003, Degen 2003, Szerlip 2007). La gamma di malattie che possono essere trattate con CED include tumori del sistema nervoso centrale (Yamashita 2007) così come le malattie neurodegenerative come il morbo di Parkinson (Gill 2003). Come la ricerca CED continua ad espandersi, la necessità di imaging in vivo di CED terapia somministrata è allo stesso modo in aumento. Mentre l'immagine fluorescente dimostrato qui probabilmente non sarà visibile attraverso il teschio umano, utilizzando altri metodi di co-infusione di agenti di contrasto per risonanza magnetica (Dickinson 2008) stanno suscitando interesse per valutare l'applicabilità per il monitoraggio sostanze infuse nei pazienti con malattia sistema nervoso centrale.
Divulgazioni
Riconoscimenti
NS65819 (CDJ, TO), NS049720 (CDJ), CA097257 (CDJ, TO), CIRM DR1-01426
Vorremmo ringraziare Raquel Santos per assistenza tecnica.
Materiali
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 2% Chlorhexidine | Fisher | NC9756995 | AKA “Nolvasan” | |
| 20g Needle | Becton Dickinson | 305175 | ||
| 28g Needle (with syringe) | Fisher | 22-004-270 | AKA Insulin Syringe | |
| 3% Hydrogen Peroxide | Fisher | H312P-4 | Store away from light | |
| Cotton Swabs | Fisher | 23-400-100 | Autoclave before use | |
| Cyanoacrylate-based Adhesive | Fisher | NC9592632 | AKA “Krazy Glue” | |
| Disposable Scalpels | Feather | 2975 | No. 21 | |
| Gauze | Fisher | 22028563 | Autoclave before use | |
| Heating Pad | Dunlap | HP950 | ||
| I.V. Catheter | Fisher | 14-841-20 | ||
| Infusion Pump | BASi | MD-1000, MD-1001 | ||
| Living Image Software | Caliper Life Sciences | Contact for Quote | ||
| Ophthalmic Ointment | Cardinal Health | 1272830 | AKA “Akwa Tears” | |
| Plastic Syringe Adaptors | Upchurch Scientific | P-604, P-200NX, P-215X, P-630 | Fits on Luer Lock Syringes | |
| Silica Tubing | Polymicro Technologies | 2000020 | ||
| Skin Stapler, Staples, Remover | Stoelting | 59020 | ||
| Stereotaxic Frame | Stoelting | 51725 | ||
| Teflon Tubing | Upchurch Scientific | 1520 | ||
| Xenogen Lumina | Caliper Life Sciences | Contact for Quote |
Riferimenti
- Bobo, R. H., Laske, D. W., Akbasak, A., Morrison, P. F., Dedrick, R. L., Oldfield, E. H. Convection-enhanced delivery of macromolecules in the brain. Proc. Natl. Acad. Sci. 91, 2076-2080 (1994).
- Degen, J. W., Walbridge, S., Vortmeyer, A. O., Oldfield, E. H., Lonser, R. R. Safety and efficacy of convection-enhanced delivery of gemcitabine or carboplatin in a malignant glioma model in rats. J Neurosurg. 99, 893-898 (2003).
- Dickinson, P. J., LeCouteur, R. A., Higgins, R. J., Bringas, J. R., Roberts, B., Larson, R. F., Yamashita, Y., Krauze, M. T., Noble, C. O., Drummond, D. C., Kirpotin, D. B., Park, J. W., Berger, M. S., Bankiewicz, K. S. Canine model of convection-enhanced delivery of liposomes containing CPT-11 monitored with real-time magnentic resonance imaging: laboratory investigation. J Neurosurg. 108, 989-998 (2008).
- Gill, S. S., Patel, N. K., Hotton, G. R., O'Sullivan, K., McCarter, R., Bunnage, M., Brooks, D. J., Svendsen, C. N., Heywood, P. Direct brain infusion of glial cell line-derived neurotrophic factor in Parkinson disease. Nature Medicine. 9, 589-595 (2003).
- Jain, R. K. Delivery of novel therapeutic agents in tumors: physiological barriers and strategies. J Natl Cancer Inst. 81, 570-576 (1989).
- Krauze, M. T., Saito, R., Noble, C. O., Tamas, M., Bringas, J., Park, J. W., Berger, M. S., Bankiewicz, K. Reflux-free cannula for convection-enhanced high-speed delivery of therapeutic agents. J Neurosurg. 103, 923-929 (2005).
- Krauze, M. T., Vandenberg, S. R., Yamashita, Y., Saito, R., Forsayeth, J., Noble, C. O., Park, J. W., Bankiewicz, K. Safety of real-time convection-enhanced delivery of liposomes to primate brain: a long-term retrospective. Exp Neurol. 210, 638-644 (2008).
- Murad, G. J., Walbridge, S., Morrison, P. F., Garmestani, K., Degen, J. W., Brechbiel, M. W., Oldfield, E. H., Lonser, R. R. Real-time, image-guided, convection-enhanced delivery of interleukin 13 bound to pseudomonas exotoxin. Clin Cancer Res. 12, 3145-3151 .
- Ozawa, T., James, C. D., Van Meir, E. Human Brain Tumor Cell and Tumor Tissue Transplantation Models. CNS Cancer: Models, Markers, Prognostic Factors, Targets, and Therapeutic Approaches. , 147-162 (2009).
- Szerlip, N. J., Walbridge, S., Yang, L., Morrison, P. F., Degen, J. W., Jarrell, S. T., Kouri, J., Kerr, P. B., Kotin, R., Oldfield, E. H., Lonser, R. R. Real-time imaging of convection-enhanced delivery of viruses and virus-sized particles. J Neurosurg. 107, 560-567 (2007).
- Yamashita, Y., Krauze, M. T., Kawaguchi, T., Noble, C. O., Drummond, D. C., Park, J. W., Bankiewicz, K. S. Convection-enhanced delivery of a topoisomerase I inhibitor (nanoliposomal topotecan) and a topoisomerase II inhibitor (pegylated liposomal doxorubicin) in intracranial brain tumor xenografts. Neuro Oncol. 9, 20-28 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon