Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Las operaciones de carga en Kinesin molecular Traslados Desarrollado
En este artículo
Resumen
Servicio de transporte molecular que consiste en deslizarse sobre los microtúbulos funcionalizados superficie adherido kinesin proteínas motoras pueden servir como un sistema de transporte a nanoescala. En este caso, el montaje de un sistema de transporte típico se describe.
Resumen
Las células han desarrollado mecanismos moleculares sofisticadas, como las proteínas motoras kinesina y filamentos de microtúbulos, para apoyar el transporte activo intracelular de la carga. Mientras que la cola de dominio kinesins se une a una variedad de cargas, los dominios kinesins cabeza utilizar la energía química almacenada en moléculas de ATP al paso a lo largo de la red de microtúbulos. Los microtúbulos largas y rígidas sirven como pistas para el transporte de larga distancia intracelular.
Estos motores y los filamentos se pueden emplear también en microfabricated entornos sintéticos como componentes del servicio de transporte molecular 1. En un diseño de uso frecuente, los motores de quinesina se anclan a la superficie de la pista a través de sus colas, y los microtúbulos funcionalizados servir como elementos de transporte de carga, que son impulsados por estos motores. Estas naves se pueden cargar con la carga mediante la utilización de la unión fuerte y selectiva entre biotina y estreptavidina. Los componentes clave (tubulina biotina, estreptavidina, biotina y de carga) están disponibles comercialmente.
Basándose en el ensayo de la motilidad clásico invertido 2, la construcción de lanzaderas moleculares se detalla aquí. Kinesin proteínas motoras son adsorbidos en una superficie recubiertas con caseína, los microtúbulos de tubulina se polimerizan con biotina, se adhirió a la quinesina y posteriormente recubiertos con estreptavidina marcada con rodamina. La concentración de ATP se mantiene a una concentración subsaturating para lograr una velocidad de deslizamiento de microtúbulos óptima para operaciones de carga 3. Por último, biotina marcado con fluoresceína nanoesferas se agregan como carga. Nanoesferas se adhieren a los microtúbulos, como resultado de colisiones entre los microtúbulos deslizándose y nanoesferas adherirse a la superficie.
El protocolo puede ser fácilmente modificado para cargar una gran variedad de cargas, como el ADN biotinilado 4, 5 o puntos cuánticos una amplia variedad de antígenos mediante anticuerpos con biotina 4-6.
Protocolo
1.) Buffers y Reactivos
Estas soluciones deben prepararse con antelación y se almacena en alícuotas de tamaño conveniente. Una alícuota deberá contener solución suficiente para un experimento típico y una alícuota se debe utilizar para cada ensayo de motilidad. Las condiciones de almacenamiento y los tamaños típicos alícuota también se mencionan en los siguientes protocolos.
1. BRB80 buffer, (80 TUBOS mM, MgCl2 1 mM, EGTA 1 mM en agua desionizada destilada (dd) de agua, pH ajustado a 6,9 por KOH)
- Constituyen una solución de 100 ml de caldo de 0,5 M EGTA en agua dd. Ajustar el pH a 7.0 con 2 M NaOH.
- Constituyen una solución de 100 ml de caldo de 1 M de MgCl 2 en el agua dd. Autoclave la solución.
- Añadir 24,2 g de tuberías y 3,1 g de pellets de KOH en aproximadamente 800 ml de agua dd y revuelva hasta disolver. Ajustar el pH a 6.9 con 1 M solución de KOH. Añadir 2 ml de solución 0,5 M de valores EGTA y 1 ml de una solución de reserva M MgCl 2. Llevar el volumen a 1000 ml con agua dd.
- Alícuota de 50 ml en tubos falcon y se congelan a -20 ° C para su uso futuro. El tubo BRB80 actualmente se utilizan se pueden almacenar a 4 ° C oa temperatura ambiente.
2. Cloruro de magnesio, MgCl2 (100 mM en agua dd)
- Diluido en agua dd para conseguir una concentración final de 100 mM.
- Alícuota (10 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro
3. Guanosina-5'-trifosfato, sal disódica, GTP (25 mM dd agua, se ajustó el pH a 7 con NaOH)
- Se pesa y se disuelve en agua dd y ajustar el pH a 7 por 2 M de NaOH.
- Verificar la concentración midiendo la absorbancia UV a 260 nm. (Use un coeficiente de extinción de 11,7 x 103 M -1 cm -1).
- Alícuota (10 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
4. Dimetilsulfóxido, DMSO
- Alícuota (10 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
5. Taxol (1 mM en DMSO)
- Se pesa y se disuelven en DMSO bajo campana de extracción para lograr una concentración final de 1 mM.
- Alícuota (20 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
6. D-(+)-glucosa, (2 M en agua dd)
- Se pesa y se disuelve en agua dd para conseguir una concentración final de 2 M.
- Alícuota (20 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
7. Glucosa oxidasa, (2 mg / ml en BRB80)
- Disolver en BRB80 para lograr una concentración final de 2 mg / ml.
- Alícuota (20 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
8. Ditiotreitol, TDT (1 M en agua dd)
- Disolver en agua dd bajo campana de extracción para lograr una concentración final de 1 M.
- Alícuota (20 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
9. Catalasa, (0,8 mg / ml en BRB80)
- Disolver en BRB80 en al menos dos etapas para lograr una concentración final de 0,8 mg / ml. Determinar la concentración en cada etapa mediante la medición de absorbancia UV a 276 nm y 406 nm (Use un coeficiente de extinción de 3,1 x 10 5 M -1 cm -1 a 276 nm y 2.2 x 10 5 M -1 cm -1 a 406 nm y la ecuación A = cL).
- Alícuota (20 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
10. Adenosina-5'-trifosfato, ATP (100 mM en 100 mM MgCl 2)
- Prepare una solución stock de 100 mM de MgCl 2 en el agua dd. Pesar de polvo seco y se disuelven en esta solución y para lograr una concentración final de 100 mm.
- Verificar la concentración midiendo la absorbancia UV a 260 nm. (Use un coeficiente de extinción de 15,4 x 10 3 M -1 cm -1).
- Alícuota (20 l de volumen) en 0,5 ml de tubos de microcentrífuga y se almacena a -20 ° C para su uso futuro.
11. Caseína solución (20 mg / ml de caseína en BRB80)
- Añadir aproximadamente 3 g de caseína a 30 ml de agua dd en un tubo Falcon de 50 ml. Vortex durante 1 hora aproximadamente hasta que la solución se desarrolla consistencia espesa.
- Se centrifuga a aproximadamente 15.000 g durante 30 minutos. Filtrar el sobrenadante a través de 0.5 micras y 0.2 micras filtros de jeringa.
- Determinar la concentración del sobrenadante midiendo la absorbancia UV a 280 nm (Use un coeficiente de extinción de 0,67 cm mg mL -1 -1). Diluir a 20 mg / ml en BRB80.
- Alícuota (20 l de volumen) enpara tubos de 0,5 ml de microcentrífuga y se almacena a -20 ° C para su uso futuro.
2.) Soluciones estándar
Estos se preparan en el día de la prueba y debe ser desechado después de que el experimento ha terminado. Prepare 1 ml de cada uno.
1. BRB80CS0.5
- Solución diluida de caseína en BRB80 a una concentración final de 0,5 mg / ml y almacenar más de hielo. Esta solución se introduce en la celda de flujo antes de la kinesina y ayuda a mantener la actividad después de kinesin superficie de adsorción.
2. BRB80CA
- Prepare 0,2 mg / ml de caseína y un ATP mM en BRB80 y almacenar más de hielo. Kinesin se diluye aún más con esta solución antes de introducirlo en la celda de flujo.
3. BRB80T
- Solución diluida de taxol en BRB80 a una concentración final de 10 mM y se almacena a temperatura ambiente. Esta solución se utiliza para estabilizar los microtúbulos.
4. BRB80CT
- Preparar 10 taxol M y 0,2 mg / ml de caseína en BRB80 y almacenar a temperatura ambiente. Esto se utiliza para preparar a la Antifade y soluciones de los microtúbulos.
5. BRB80AF
- Prepare 20 mM D-glucosa, 20 mg / ml de glucosa oxidasa, 8 mg / ml de catalasa, 10 mM DTT, y 20 mM de ATP en BRB80CT y almacenar a temperatura ambiente. Esta solución se utiliza para diluir la estreptavidina y las nanoesferas y "eliminar" el exceso de estreptavidina en la celda de flujo. La velocidad de kinesina se puede controlar mediante el ajuste de la concentración de ATP en esta solución.
3.) Kinesin Preparación
- Expresar una kinesin construcción que consiste en el tipo salvaje, de larga duración en la cadena de Drosophila melanogaster kinesin pesada y un C-terminal-Su etiqueta en Escherichia coli y purificar utilizando una columna de Ni-NTA como se describe en 6.
- Hacer alícuotas (10 l cada uno) en tubos de 0,5 mL microcentrífuga y almacenar a -80 ° C para su uso futuro. La concentración de activos en estos kinesin alícuotas es de aproximadamente 200 nM 7.
- Para un experimento típico, se diluye la solución kinesin 20 veces en BRB80CA. La etiqueta del KIN20 solución y almacenar más de hielo.
4.) Microtúbulos Preparación
- En un tubo de microcentrífuga de 0,5 mL, preparar 25 L de solución de crecimiento: 4 mM MgCl 2, 1 mM GTP y un 5% DMSO (v / v) en BRB80 buffer.
- Añadir 6,25 l de esta solución a una alícuota de 20 mg de biotina tubulina liofilizado.
- Vortex, luego colóquelo en un baño de calor a 37 ° C durante 30 minutos para polimerizar. Diluir 100 veces en BRB80T y agitar suavemente. La etiqueta del MT100 solución y almacenar a temperatura ambiente.
- Hacer una dilución de 10 veces en BRB80AF MT100. La etiqueta del MT1000 solución.
5.) Estreptavidina y Nanosphere Solución
Prepare AlexaFluor568 estreptavidina marcada con una concentración de 100 nM en BRB80AF. Etiqueta que STV100 y almacenar más de hielo. Del mismo modo, diluir nanoesferas 5000 veces en la solución de BRB80AF. Etiqueta que NS5000 y almacenar más de hielo.
6.) Flujo de construcción de la célula
Construir una celda de flujo con dos cubreobjetos de vidrio separados por cinta de doble cara. Esta celda de flujo es de aproximadamente 2 cm de largo, 1 cm de ancho y 100 micras, y tiene un volumen de aproximadamente 20 mL. Las soluciones se introdujeron en la celda de flujo de un lado con una pipeta y con los malos de los otros con papel de filtro.
7.) Asamblea de ensayo invertido
Superficie del vidrio es la primera cubierta con la caseína que permite kinesina para mantener su funcionalidad en la adsorción. Después de kinesina se absorbe, los microtúbulos se introducen, que están en manos de quinesina. Los microtúbulos son luego recubiertos con estreptavidina fluorescentes. Después de lavar el exceso de estreptavidina, biotina fluoresceína nanoesferas de poliestireno (40 nm de diámetro) se introducen. Superficie adsorbido nanoesferas estacionaria chocan con los microtúbulos en movimiento y se cargan sobre ellos (Figura 1).
El orden de flujo de las soluciones y el tiempo permitido antes de la introducción de la solución a continuación se enumeran a continuación.
- BRB80CS0.5, a 5 minutos
- KIN20, a 5 minutos
- MT1000, a 5 minutos
- STV100, a 5 minutos
- BRB80AF, 3x
- NS5000
8.) Microscopía
Montar la celda de flujo en la platina del microscopio inmediatamente después de la introducción nanoesfera. En este experimento, un Eclipse TE2000-U microscopio de fluorescencia (Nikon, Melville, NY) equipado con un objetivo de aceite de 100X (AN 1.45), un X-Cite 120 de la lámpara (EXFO, Ontario, Canadá) y un ixon EMCCD cámara (ANDOR, South Windsor, CT) se utilizó. Un filtro FITC cubo (# 48001) y un cubo de filtro TRITC (# 48002, Tecnologías de Chroma, Rockingham, VT) se utilizaron para la imagen y nanoesferas respecti microtúbulosvamente en la superficie inferior de las celdas de flujo. El tiempo de exposición fue de 0,2 s, mientras que el tiempo entre la exposición fue de 2 s.
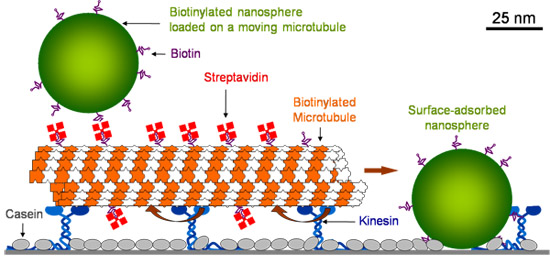
Figura 1. Esquema del servicio de transporte molecular.
Discusión
Con pequeñas modificaciones, este protocolo ha sido utilizado con éxito por una variedad de grupos para montar kinesina-microtúbulo ensayos de movilidad basado en. 10 mM de TDT en la solución final de la motilidad puede ser reemplazado con un 0,5% β-mercaptoetanol. Soluciones estándar (BRB80AF, KIN20 y MT1000) de más de 2 horas de vida no se debe utilizar. Cualquier solución que contiene microtúbulos taxol y sobre todo nunca deben ser colocados en el hielo. La exposición excesiva de la celda de flujo a los ray...
Divulgaciones
Agradecimientos
Estamos muy en deuda con Jonathon Howard, cuyo grupo desarrolló el protocolo básico para un ensayo de la motilidad de deslizamiento, que fue adaptado posteriormente por nosotros. El apoyo financiero de NSF concesión DMR0645023 se agradece.
Materiales
| Name | Company | Catalog Number | Comments |
| Adenosine-5’-triphosphate (ATP) | Invitrogen | A1049 | |
| Biotin tubulin | Cytoskeleton, Inc. | T333 | |
| Casein | Sigma-Aldrich | C-0376 | |
| Catalase | Sigma-Aldrich | C-9322 | |
| D-(+)-Glucose | Sigma-Aldrich | G-7528 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D-8779 | |
| Dithiotreitol (DTT) | Bio-Rad | 161-0610 | |
| Ethylene glycol-bis(2-amin–thylether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E-4378 | |
| FluoSpheres Biotinylated microspheres, 40 nm, yellow-green fluorescent (505/515) | Invitrogen | F-8766 | |
| Glucose oxidase | Sigma-Aldrich | G-7016 | |
| Guanosine-5’-triphosphate (GTP) | Roche Group | 106399 | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | 63069 | |
| Paclitaxel (Taxol) | Sigma-Aldrich | T1912 | |
| 1,4-Piperazinediethanesulfonic acid, Piperazine-1,4-bis(2-ethanesulfonic acid), Piperazine-N,N′-bis(2-ethanesulfonic acid) (PIPES) | Sigma-Aldrich | P-6757 | |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P-6310 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 480878 | |
| Streptavidin Alexa Fluor 568 conjugate | Invitrogen | S11226 |
Referencias
- Agarwal, A., Hess, H. Biomolecular motors at the intersection of nanotechnology and polymer science. Progress in Polymer Science. 35 (1-2), 252-252 (2010).
- Howard, J., Hunt, A. J., Baek, S. Assay of microtubule movement driven by single kinesin molecules. Methods Cell Biol. 39, 137-137 (1993).
- Agarwal, A., Katira, P., Hess, H. Millisecond curing time of a molecular adhesive causes velocity-dependent cargo-loading of molecular shuttles. Nano Lett. 9 (3), 1170-1170 (2009).
- Diez, S., Reuther, C., Dinu, C., Seidel, R., Mertig, M., Pompe, W., Howard, J. Stretching and Transporting DNA Molecules Using Motor Proteins. Nano Lett. 3 (9), 1251-1251 (2003).
- Bachand, G. D., Rivera, S. B., Boal, A. K., Gaudioso, J., Liu, J., Bunker, B. C. Assembly and transport of nanocrystal CdSe quantum dot nanocomposites using microtubules and kinesin motor proteins. Nano Lett. 4 (5), 817-817 (2004).
- Coy, D. L., Wagenbach, M., Howard, J. Kinesin takes one 8-nm step for each ATP that it hydrolyzes. J. Biol. Chem. 274 (6), 3667-3667 (1999).
- Katira, P., Agarwal, A., Fischer, T., Chen, H. -. Y., Jiang, X., Lahann, J., Hess, H. Quantifying the performance of protein-resisting surfaces at ultra-low protein coverages using kinesin motor proteins as probes. Advanced Materials. 19, 3171-3171 (2007).
- Vigers, G. P. A., Coue, M., McIntosh, J. R. Fluorescent Microtubules Break Up Under Illumination. J. Cell Biol. 107, 1011-1011 (1988).
- Brunner, C., Hess, H., Ernst, K. -. H., Vogel, V. Lifetime of biomolecules in hybrid nanodevices. Nanotechnology. 15 (10), S540-S540 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados