Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Frachtladesysteme auf Kinesin Powered Molekulare Shuttles
In diesem Artikel
Zusammenfassung
Molekulare Shuttles, bestehend aus funktionalisierten Mikrotubuli Gleiten auf der Oberfläche haften Kinesin Motorproteine können als nanoskalige Nahverkehr dienen. Hier ist die Montage eines typischen Shuttle-System beschrieben.
Zusammenfassung
Zellen verfügen über ausgefeilte molekulare Maschinerie entwickelt, wie Kinesin Motorproteine und Mikrotubuli, zu aktiven intrazellulären Transport von Gütern zu unterstützen. Während Kinesine Schwanz Domäne bindet an eine Vielzahl von Ladungen, nutzen Kinesine Kopfdomänen die chemische Energie in ATP-Molekülen gespeichert, um entlang der Mikrotubuli Gitter Schritt. Die langen, steifen Mikrotubuli dienen als Schienen für den Fernverkehr intrazellulären Transport.
Diese Motoren und Filamente können auch in mikrofabrizierten synthetischer Umgebungen als Komponenten der molekularen Shuttles 1 eingesetzt werden. In einer häufig verwendeten Design sind Kinesin-Motoren auf die Fahrbahn durch ihre Schwänze verankert, und funktionalisierte Mikrotubuli dienen als Fracht tragenden Elemente, die von diesen Motoren angetrieben werden. Diese Shuttles können mit Ladung durch die Nutzung der starke und selektive Bindung zwischen Biotin und Streptavidin geladen werden. Die wichtigsten Komponenten (biotinylierten Tubulin, Streptavidin und biotinylierten Ladung) sind kommerziell erhältlich.
Aufbauend auf den klassischen invertierten Motilität Test 2 ist der Aufbau von molekularen Shuttles detaillierte hier. Kinesin Motorproteine sind an einer Oberfläche mit Kasein vorbeschichtet adsorbiert; Mikrotubuli sind aus biotinylierten Tubulin polymerisiert, haftete an der Kinesin und anschließend mit Rhodamin-markiertem Streptavidin beschichtet. Die ATP-Konzentration ist bei subsaturating Konzentration aufrechterhalten, um ein Mikrotubulus Gleiten Geschwindigkeit optimal für Beladen 3 zu erreichen. Schließlich biotinylierten fluoresceinmarkierten Nanokügelchen als Fracht aufgenommen. Nanospheres an Mikrotubuli legen als Resultat von Kollisionen zwischen Gleiten Mikrotubuli und Nanokügelchen an der Oberfläche haften.
Das Protokoll kann leicht modifiziert werden, um eine Vielzahl von Ladungen wie biotinylierten DNA 4, Quantenpunkte 5 oder eine Vielzahl von Antigenen über biotinylierte Antikörper 4-6 laden.
Protokoll
1). Puffer und Reagenzien
Diese Lösungen sollten im Voraus vorbereitet werden und in handliche Portionen. Ein Aliquot sollte genügend Lösung für ein typisches Experiment und ein frisches Aliquot sollte für jede Motilität Assay verwendet werden. Die Lagerbedingungen und die typischen aliquoten Größen sind auch in den folgenden Protokollen erwähnt.
1. BRB80 Puffer (80 mM PIPES, 1 mM MgCl 2, 1 mM EGTA in deionisiertem destilliert (dd) Wasser, pH-Wert eingestellt auf 6,9 von KOH)
- Überlegen Sie sich einen 100-ml-Stammlösung von 0,5 M EGTA in dd Wasser. Der pH-Wert auf 7,0 mit 2 M NaOH-Lösung.
- Überlegen Sie sich einen 100-ml-Stammlösung von 1 M MgCl 2 in dd Wasser. Autoclave die Lösung.
- Add 24,2 g von Rohren und 3,1 g KOH-Pellets in ca. 800 ml dd Wasser und rühren sich aufzulösen. Der pH-Wert auf 6,9 mit 1 M KOH-Lösung. Add 2 mL 0,5 M EGTA Stammlösung und 1 ml 1 M MgCl 2-Stammlösung. Bringen Sie auf ein Volumen von 1000 ml mit dd Wasser.
- Aliquot in 50 mL Falcon-Röhrchen und bei -20 ° C für eine spätere Verwendung. Die BRB80 Rohr derzeit verwendet werden können bei 4 ° C oder bei Raumtemperatur gelagert werden.
2. Magnesiumchlorid, MgCl 2 (100 mM in dd Wasser)
- Verdünnen Sie in dd Wasser bis zu einer Endkonzentration von 100 mM zu erreichen.
- Aliquot (10 l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für die zukünftige Verwendung
3. Guanosin-5'-Triphosphat, Dinatriumsalz, GTP (25 mM in dd Wasser, pH-Wert auf 7 mit NaOH)
- Abwiegen und lösen sich in dd Wasser und den pH-Wert auf 7 mit 2 M NaOH-Lösung.
- Überprüfen Sie durch Messung der UV-Absorption bei 260 nm. (Verwenden Sie ein Extinktionskoeffizient von 11,7 x 103 M -1 cm -1).
- Aliquot (10 l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
4. Dimethylsulfoxid, DMSO
- Aliquot (10 l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
5. Taxol (1 mM in DMSO)
- Abwiegen und lösen sich in DMSO unter Abzug bis zu einer Endkonzentration von 1 mM zu erreichen.
- Aliquot (20 &mgr; l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
6. D-(+)-Glucose, (2 M in dd Wasser)
- Abwiegen und lösen sich in dd Wasser bis zu einer Endkonzentration von 2 M erreicht
- Aliquot (20 &mgr; l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
7. Glucose-Oxidase, (2 mg / mL in BRB80)
- Man löst in BRB80 bis zu einer Endkonzentration von 2 mg / mL zu erreichen.
- Aliquot (20 &mgr; l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
8. Dithiothreitol, DTT (1 M in dd Wasser)
- Man löst in dd Wasser unter Abzug bis zu einer Endkonzentration von 1 M. zu erreichen
- Aliquot (20 &mgr; l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
9. Catalase, (0,8 mg / mL in BRB80)
- Man löst in BRB80 in mindestens 2 Stufen bis zu einer Endkonzentration von 0,8 mg / mL zu erreichen. Bestimmen Sie die Konzentration in jeder Phase durch Messung der UV-Absorption bei 276 nm und 406 nm (Verwendung eines Extinktionskoeffizienten von 3,1 x 10 5 M -1 cm -1 bei 276 nm und 2,2 x 10 5 M -1 cm -1 bei 406 nm und der Gleichung A = cL).
- Aliquot (20 &mgr; l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
10. Adenosin-5'-Triphosphat, ATP (100 mM in 100 mM MgCl 2)
- Bereiten Sie eine Stammlösung von 100 mM MgCl 2 in dd Wasser. Abwiegen Trockenpulver und lösen sich in dieser Stammlösung zu einer Endkonzentration von 100 mM zu erreichen.
- Überprüfen Sie durch Messung der UV-Absorption bei 260 nm. (Verwenden Sie ein Extinktionskoeffizient von 15,4 x 10 3 M -1 cm -1).
- Aliquot (20 &mgr; l Volumen) in 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
11. Casein-Lösung (20 mg / ml Casein in BRB80)
- Fügen Sie etwa 3 g Casein zu 30 mL dd Wasser in einem 50 ml Falcon-Röhrchen. Vortex für ca. 1 Stunde, bis die Lösung entwickelt dicke Konsistenz.
- Zentrifugation bei ca. 15000 g für 30 Minuten. Den Überstand bis 0,5 m und 0,2 &mgr; Spritzenfilter.
- Bestimmen Sie die Konzentration der Überstand durch Messung der UV-Absorption bei 280 nm (Verwendung eines Extinktionskoeffizienten von 0,67 ml mg -1 cm -1). Verdünnen auf 20 mg / mL in BRB80.
- Aliquot (20 &mgr; l Volumen) inbis 0,5 ml Reaktionsgefäße und bei -20 ° C für eine spätere Verwendung.
2.) Standard-Lösungen
Diese basieren auf den Tag des Experiments vorbereitet und sollte verworfen, nachdem das Experiment vorbei ist. Bereiten Sie 1 mL jeder.
1. BRB80CS0.5
- Verdünnen Casein-Lösung in BRB80 zu einer endgültigen Konzentration von 0,5 mg / mL und speichert mehr als Eis. Diese Lösung wird in die Messzelle vor Kinesin eingeführt und halten die Kinesin-Aktivität nach Oberflächenadsorption.
2. BRB80CA
- Bereiten 0,2 mg / ml Casein und 1 mM ATP in BRB80 und speichert mehr als Eis. Kinesin ist weiter verdünnt mit dieser Lösung vor dem Einleiten in die Durchflusszelle.
3. BRB80T
- Verdünnen Taxollösung in BRB80 bis zu einer Endkonzentration von 10 uM und bei Raumtemperatur lagern. Diese Lösung wird verwendet, um Mikrotubuli zu stabilisieren.
4. BRB80CT
- Bereiten 10 uM Taxol und 0,2 mg / ml Casein in BRB80 und bei Raumtemperatur lagern. Dies dient der weiteren Vorbereitung der Antifade und Mikrotubuli-Lösungen.
5. BRB80AF
- Bereiten 20 mM D-Glucose, 20 ug / mL Glucose-Oxidase, 8 pg / mL Katalase, 10 mM DTT und 20 uM ATP in BRB80CT und bei Raumtemperatur lagern. Diese Lösung wird verwendet, um Streptavidin und Nanokügelchen verdünnen und "wash out" das überschüssige Streptavidin in der Durchflusszelle. Die Kinesin-Geschwindigkeit kann durch Anpassung der ATP-Konzentration in dieser Lösung gesteuert werden.
3). Kinesin Vorbereitung
- Express ein Kinesin-Konstrukt, bestehend aus dem Wildtyp und in voller Länge Drosophila melanogaster Kinesin heavy chain und eine C-terminale His-tag in Escherichia coli und Reinigung mit einem Ni-NTA-Säule wie in 6 beschrieben.
- Machen Aliquots (10 l pro Stück) in 0,5 ml Reaktionsgefäße und bei -80 ° C für eine spätere Verwendung. Die Konzentration der aktiven Kinesin in diesen Aliquots beträgt ca. 200 nM. 7
- Für ein typisches Experiment, verdünnen das Kinesin-Lösung 20-fach in BRB80CA. Beschriften Sie die Lösung KIN20 und speichert mehr als Eis.
4). Mikrotubuli Vorbereitung
- In einem 0,5 mL Mikrozentrifugenröhrchen, bereiten 25 ul des Wachstums Lösung: 4 mM MgCl 2, 1 mM GTP und 5% DMSO (v / v) in BRB80 Puffer.
- Add 6,25 ul dieser Lösung zu einem 20 ug Aliquot lyophilisierte biotinylierte Tubulin.
- Vortex, dann in einem Wärmebad bei 37 ° C für 30 Minuten zur Polymerisation. Verdünnen Sie 100-fach in BRB80T und vortexen. Beschriften Sie die Lösung MT100 und bei Raumtemperatur lagern.
- Machen Sie eine 10-fache Verdünnung von MT100 in BRB80AF. Beschriften Sie die Lösung MT1000.
5). Streptavidin und Nanosphere Lösung
Bereiten AlexaFluor568-markiertem Streptavidin in einer Konzentration von 100 nM in BRB80AF. Bezeichne STV100 und speichert mehr als Eis. Auch verdünnter Nanokügelchen 5000 fold in BRB80AF Lösung. Bezeichne NS5000 und speichert mehr als Eis.
6). Flow Cell Construction
Konstruieren Sie eine Durchflusszelle mit zwei Deckgläser durch doppelseitiges Klebeband getrennt. Diese Messzelle beträgt ca. 2 cm lang, 1 cm breit und 100 pm hoch und hat ein Volumen von etwa 20 ul. Die Lösungen sind in die Messzelle von einer Seite mit einer Pipette und böse von den anderen mit Filterpapier eingeführt.
7). Inverted Assay Assembly
Glass Oberfläche wird zuerst mit Kasein die Kinesin, um seine Funktionalität bei der Adsorption behalten können beschichtet. Nach Kinesin adsorbiert wird, sind Mikrotubuli eingeführt, die von Kinesin statt. Mikrotubuli sind dann mit fluoreszierenden Streptavidin beschichtet. Nach dem Auswaschen der überschüssigen Streptavidin, biotinyliert Polystyrol Fluorescein Nanokügelchen (40 nm Durchmesser) eingeführt. Adsorbiert stationären Nanokügelchen mit dem bewegten Mikrotubuli kollidieren und auf sie (Abbildung 1) geladen werden.
Die Reihenfolge der Fluss von Lösungen und die Zeit vor der Einführung der nächsten Lösung erlaubt sind unten aufgeführt.
- BRB80CS0.5, 5 Minuten
- KIN20, 5 Minuten
- MT1000, 5 Minuten
- STV100, 5 Minuten
- BRB80AF, 3x
- NS5000
8). Microscopy
Montieren Sie die Messzelle auf dem Mikroskoptisch unmittelbar nach Nanokugel Einführung. In diesem Experiment ein Eclipse TE2000-U Fluoreszenzmikroskop (Nikon, Melville, NY) mit einem 100X Öl-Objektiv (NA 1,45), ein X-Cite 120 Lampe (EXFO, Ontario, Kanada) und eine iXon EMCCD Kamera (Andor, ausgestattet South Windsor, CT) verwendet wurde. A FITC-Filter cube (# 48001) und einem TRITC-Filter cube (# 48002, Chroma Technologies, Rockingham, VT) wurden image Nanokügelchen und Mikrotubuli respecti verwendetVely auf der unteren Fläche der Messzellen. Die Belichtungszeit betrug 0,2 s, während die Zeit zwischen den Aufnahmen war 2 s.
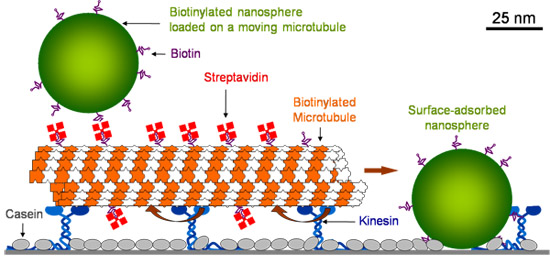
Abbildung 1. Schematische Darstellung des molekularen Shuttles.
Diskussion
Mit geringfügigen Änderungen wurde das Protokoll erfolgreich von einer Vielzahl von Gruppen verwendet werden, um Kinesin-Mikrotubuli-basierte Motilität Assays zu montieren. 10 mM DTT in den letzten Motilität Lösung kann mit 0,5% β-Mercaptoethanol ersetzt werden. Standard-Lösungen (BRB80AF, KIN20 und MT1000) mehr als 2 Stunden alt sollte nicht verwendet werden. Jede Lösung enthält Taxol und insbesondere Mikrotubuli sollte niemals auf Eis gelegt werden. Übermäßige Exposition der Messzelle gegen UV-Anregungslic...
Offenlegungen
Danksagungen
Wir sind hoch verschuldet, um Jonathon Howard, dessen Gruppe entwickelte das grundlegende Protokoll für eine gleitende Beweglichkeit Assay, der anschließend von uns angepasst wurde. Finanzielle Unterstützung von NSF gewähren DMR0645023 gedankt.
Materialien
| Name | Company | Catalog Number | Comments |
| Adenosine-5’-triphosphate (ATP) | Invitrogen | A1049 | |
| Biotin tubulin | Cytoskeleton, Inc. | T333 | |
| Casein | Sigma-Aldrich | C-0376 | |
| Catalase | Sigma-Aldrich | C-9322 | |
| D-(+)-Glucose | Sigma-Aldrich | G-7528 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D-8779 | |
| Dithiotreitol (DTT) | Bio-Rad | 161-0610 | |
| Ethylene glycol-bis(2-amin–thylether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E-4378 | |
| FluoSpheres Biotinylated microspheres, 40 nm, yellow-green fluorescent (505/515) | Invitrogen | F-8766 | |
| Glucose oxidase | Sigma-Aldrich | G-7016 | |
| Guanosine-5’-triphosphate (GTP) | Roche Group | 106399 | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | 63069 | |
| Paclitaxel (Taxol) | Sigma-Aldrich | T1912 | |
| 1,4-Piperazinediethanesulfonic acid, Piperazine-1,4-bis(2-ethanesulfonic acid), Piperazine-N,N′-bis(2-ethanesulfonic acid) (PIPES) | Sigma-Aldrich | P-6757 | |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P-6310 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 480878 | |
| Streptavidin Alexa Fluor 568 conjugate | Invitrogen | S11226 |
Referenzen
- Agarwal, A., Hess, H. Biomolecular motors at the intersection of nanotechnology and polymer science. Progress in Polymer Science. 35 (1-2), 252-252 (2010).
- Howard, J., Hunt, A. J., Baek, S. Assay of microtubule movement driven by single kinesin molecules. Methods Cell Biol. 39, 137-137 (1993).
- Agarwal, A., Katira, P., Hess, H. Millisecond curing time of a molecular adhesive causes velocity-dependent cargo-loading of molecular shuttles. Nano Lett. 9 (3), 1170-1170 (2009).
- Diez, S., Reuther, C., Dinu, C., Seidel, R., Mertig, M., Pompe, W., Howard, J. Stretching and Transporting DNA Molecules Using Motor Proteins. Nano Lett. 3 (9), 1251-1251 (2003).
- Bachand, G. D., Rivera, S. B., Boal, A. K., Gaudioso, J., Liu, J., Bunker, B. C. Assembly and transport of nanocrystal CdSe quantum dot nanocomposites using microtubules and kinesin motor proteins. Nano Lett. 4 (5), 817-817 (2004).
- Coy, D. L., Wagenbach, M., Howard, J. Kinesin takes one 8-nm step for each ATP that it hydrolyzes. J. Biol. Chem. 274 (6), 3667-3667 (1999).
- Katira, P., Agarwal, A., Fischer, T., Chen, H. -. Y., Jiang, X., Lahann, J., Hess, H. Quantifying the performance of protein-resisting surfaces at ultra-low protein coverages using kinesin motor proteins as probes. Advanced Materials. 19, 3171-3171 (2007).
- Vigers, G. P. A., Coue, M., McIntosh, J. R. Fluorescent Microtubules Break Up Under Illumination. J. Cell Biol. 107, 1011-1011 (1988).
- Brunner, C., Hess, H., Ernst, K. -. H., Vogel, V. Lifetime of biomolecules in hybrid nanodevices. Nanotechnology. 15 (10), S540-S540 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten