Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chargement du fret sur la kinésine Powered navettes moléculaires
Dans cet article
Résumé
Navettes moléculaires constitués de microtubules fonctionnalisés glissant sur la surface collée protéines motrices kinésine peut servir de système de transport nanométrique. Ici, le montage d'un système de navette typique est décrit.
Résumé
Les cellules ont évolué sophistiqué machinerie moléculaire, tels que les protéines motrices kinésine microtubules et de filaments, pour soutenir le transport intracellulaire actif de la cargaison. Alors que kinésines queue domaine se lie à une variété de cargaisons, domaines kinésines tête d'utiliser l'énergie chimique stockée dans les molécules d'ATP à l'étape le long du réseau de microtubules. Les longs microtubules raides servir de pistes pour le transport longue distance intracellulaire.
Ces moteurs et des filaments peut également être utilisé dans des environnements synthétiques microfabriqués en tant que composants de navettes moléculaires 1. Dans un motif fréquemment utilisés, les moteurs kinésine sont ancrées à la surface de la piste par le biais de leur queue, et microtubules fonctionnalisés servir éléments de transport de marchandise, qui sont propulsés par ces moteurs. Ces navettes peuvent être chargés de marchandises en utilisant la liaison forte et sélective entre la biotine et la streptavidine. Les composants clés (tubuline biotinylé, streptavidine et biotinylated fret) sont disponibles dans le commerce.
En s'appuyant sur le test de motilité inversé classique 2, la construction de navettes moléculaires est détaillée ici. Kinésine protéines motrices sont adsorbés sur une surface préalablement enduite avec de la caséine; microtubules sont polymérisés à partir de tubuline biotinylé, adhéré à la kinésine et ensuite revêtus avec de la rhodamine-streptavidine marquée. La concentration d'ATP est maintenue à une concentration subsaturating pour obtenir une vitesse de glissement des microtubules optimale pour le chargement 3. Enfin, biotinylé marqué à la fluorescéine nanosphères sont ajoutés en tant que cargaison. Nanosphères joindre aux microtubules du fait de collisions entre des microtubules de glisse et des nanosphères adhérant à la surface.
Le protocole peut être facilement modifié pour charger une variété de marchandises telles que l'ADN biotinylé 4, 5 ou points quantiques d'une grande variété d'antigènes au moyen d'anticorps biotinylés 4-6.
Protocole
1.) Tampons et réactifs
Ces solutions doivent être préparées à l'avance et stocké en aliquotes de taille pratique. Une aliquote doit contenir suffisamment de solution pour une expérience typique et une autre partie aliquote doit être utilisé pour chaque test de motilité. Les conditions de stockage et de tailles typiques aliquotes sont également mentionnées dans les protocoles suivants.
1. BRB80 tampon (80 mM PIPES, 1 mM MgCl2, 1 mM EGTA dans désionisée distillée (dd) d'eau, le pH ajusté à 6,9 par KOH)
- Préparez une solution de 100 ml de bouillon de 0,5 M EGTA dans l'eau dd. Ajuster le pH à 7,0 en utilisant une solution de NaOH 2 M.
- Préparez une solution de 100 ml de bouillon de 1 M MgCl 2 dans l'eau dd. Autoclaver la solution.
- Ajouter 24,2 g de PIPES et 3,1 g de pastilles de KOH à environ 800 ml d'eau dd et mélanger pour dissoudre. Ajuster le pH à 6,9 avec 1 M de solution de KOH. Ajouter 2 ml d'une solution 0,5 M de stock EGTA et 1 ml de 1 M MgCl 2 SOLUTIsur. Montez le volume à 1000 ml avec de l'eau dd.
- Aliquoter dans des tubes de 50 ml falcon et congeler à -20 ° C pour une utilisation future. Le tube BRB80 actuellement utilisé peut être conservé à 4 ° C ou à température ambiante.
2. Chlorure de magnésium MgCl 2 (100 mM dans l'eau dd)
- Diluer dans de l'eau dd pour obtenir une concentration finale de 100 mM.
- Aliquote (10 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure
3. Guanosine-5'-triphosphate, sel disodique, le GTP (25 mM dans de l'eau dd, pH ajusté à 7 par NaOH)
- Peser et dissoudre dans l'eau dd et ajuster le pH à 7 par une solution de NaOH 2 M.
- Vérifiez la concentration en mesurant l'absorbance UV à 260 nm. (Utilisez un coefficient d'extinction de 11,7 x 103 M -1 cm -1).
- Aliquote (10 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
4. Le diméthylsulfoxyde, DMSO
- Aliquote (10 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
5. Taxol (1 mM dans du DMSO)
- Peser et dissoudre dans du DMSO sous une hotte pour obtenir une concentration finale de 1 mM.
- Aliquote (20 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
6. D-(+)-glucose, (2 M dans l'eau dd)
- Peser et dissoudre dans l'eau dd pour obtenir une concentration finale de 2 M.
- Aliquote (20 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
7. Glucose oxydase, (2 mg / ml dans BRB80)
- Dissoudre dans BRB80 pour atteindre une concentration finale de 2 mg / mL.
- Aliquote (20 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
- Dissoudre dans l'eau dd sous une hotte pour obtenir une concentration finale de 1 M.
- Aliquote (20 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
9. Catalase, (0,8 mg / ml dans BRB80)
- Dissoudre dans BRB80 en au moins 2 étapes pour atteindre une concentration finale de 0,8 mg / ml. Déterminer la concentration à chaque étape par mesure de l'absorbance UV à 276 nm et 406 nm (Utilisez un coefficient d'extinction de 3,1 x 10 5 M -1 cm -1 à 276 nm et 2,2 x 10 5 M -1 cm -1 à 406 nm et l'équation A = Cl).
- Aliquote (20 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
10. Adénosine-5'-triphosphate, ATP (100 mM dans 100 mM de MgCl 2)
- Préparer une solution mère de 100 mM de MgCl2 jj water. Peser la poudre sèche et se dissolvent dans cette solution mère pour obtenir une concentration finale de 100 mM.
- Vérifiez la concentration en mesurant l'absorbance UV à 260 nm. (Utilisez un coefficient d'extinction de 15,4 x 10 3 M -1 cm -1).
- Aliquote (20 uL de volume) dans 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
11. Caséine solution (20 mg / ml dans de la caséine BRB80)
- Ajouter environ 3 g de caséine à 30 ml d'eau dd dans un tube Falcon de 50 ml. Vortex pendant environ 1 heure jusqu'à ce que la solution se développe consistance épaisse.
- Centrifuger à environ 15000 g pendant 30 minutes. Filtrer le surnageant à 0,5 um et 0,2 um filtres seringues.
- Déterminer la concentration du surnageant en mesurant l'absorbance UV à 280 nm (Utilisez un coefficient d'extinction de 0,67 mg mL -1 -1 cm). Diluez à 20 mg / mL dans BRB80.
- Aliquote (20 uL de volume) dans à 0,5 ml microtubes et conserver à -20 ° C pour une utilisation ultérieure.
2.) Solutions standard
Ceux-ci sont préparés le jour même de l'expérience et doivent être jetés après l'expérience est terminée. Préparer 1 ml de chaque.
1. BRB80CS0.5
- Diluer la solution de caséine dans BRB80 à une concentration finale de 0,5 mg / ml et de stocker plus de glace. Cette solution est introduite dans la cellule d'écoulement avant et permet de conserver la kinésine activité de kinésine, après l'adsorption en surface.
2. BRB80CA
- Préparer 0,2 mg / ml de caséine et 1 mM d'ATP dans BRB80 et de stocker plus de glace. Kinésine est encore diluée à l'aide de cette solution avant l'introduction dans la cellule d'écoulement.
3. BRB80T
- Diluer la solution taxol dans BRB80 à une concentration finale de 10 uM et conserver à température ambiante. Cette solution est utilisée pour stabiliser les microtubules.
- Préparer 10 uM de taxol et de 0,2 mg / ml de caséine dans BRB80 et stocker à température ambiante. Il est utilisé pour continuer à préparer le antifade et des solutions de microtubules.
5. BRB80AF
- Préparer 20 mM de D-glucose, 20 glucose oxydase pg / ml, 8 pg / ml de catalase, DTT 10 mM, et 20 uM d'ATP dans BRB80CT et stocker à température ambiante. Cette solution est utilisée pour diluer la streptavidine et des nanosphères et "laver" la streptavidine en excès dans la cellule d'écoulement. La vitesse de kinésine peut être contrôlée en ajustant la concentration d'ATP dans cette solution.
3). Préparation kinésine
- Exprimer une kinésine construire composé du type sauvage, pleine longueur de la chaîne Drosophila melanogaster kinésine lourd et un C-terminal His-tag dans Escherichia coli et purifier l'aide d'une colonne de Ni-NTA comme décrit en 6.
- Assurez aliquotes (10 ul chacun) dans 0,5 ml microtubes et magasins à -80 ° C pour une utilisation ultérieure. La concentration de la kinésine actif dans ces portions est d'environ 200 nM. 7
- Pour une expérience typique, diluer la solution kinésine 20 fois BRB80CA. Étiquetez le KIN20 solution et de stocker plus de glace.
Préparation des microtubules 4.)
- Dans un tube à centrifuger de 0,5 mL, préparer 25 pi de solution de croissance: 4 mM de MgCl2, 1 mM de GTP et 5% de DMSO (v / v) dans un tampon BRB80.
- Ajoutez 6,25 ul de cette solution à une aliquote de 20 ug de tubuline biotinylé lyophilisée.
- Vortex, puis mettre dans un bain thermique à 37 ° C pendant 30 minutes à polymériser. Diluer 100 fois dans BRB80T et vortexer doucement. Étiquetez le MT100 solution et conserver à température ambiante.
- Faire une dilution de 10 fois dans BRB80AF MT100. Étiquetez le MT1000 solution.
5.) Solution streptavidine et Nanosphère
Préparer AlexaFluor568 la streptavidine marquée à une concentration de 100 nM dans BRB80AF. Étiqueter et stocker STV100 sur la glace. De même, diluer nanosphères 5000 fois en solution BRB80AF. Étiqueter NS5000 et de stocker plus de glace.
6.) Construction Cellule à circulation
Construire une cuve à circulation à l'aide de deux lamelles de verre séparées par un adhésif double face. Cette cellule d'écoulement est d'environ 2 cm de long, 1 cm de large et 100 um de hauteur et a un volume d'environ 20 mL. Solutions sont introduites dans la cellule d'écoulement d'un côté à l'aide d'une pipette et sur méchant de l'autre à l'aide de papier filtre.
7.) Assemblée dosage inversé
Surface de verre est d'abord revêtu avec de la caséine qui permet de conserver la kinésine sa fonctionnalité à adsorption. Après la kinésine est adsorbé, les microtubules sont introduites, qui sont détenus par la kinésine. Les microtubules sont ensuite revêtues de streptavidine fluorescente. Après lavage de la streptavidine excès, biotinylé polystyrène fluorescéine nanosphères (40 dia nmter) sont introduits. Surface adsorbés nanosphères fixes entrent en collision avec les microtubules en mouvement et se charger sur eux (figure 1).
L'ordre du débit des solutions et des temps d'attente avant l'introduction de la solution suivante sont listés ci-dessous.
- BRB80CS0.5, 5 minutes
- KIN20, 5 minutes
- MT1000, 5 minutes
- STV100, 5 minutes
- BRB80AF, 3x
- NS5000
8.) Microscopie
Montez la cellule d'écoulement sur la platine du microscope immédiatement après l'introduction de nanosphères. Dans cette expérience, une Eclipse TE2000-U microscope à fluorescence (Nikon, Melville, NY) équipé d'un objectif huile 100X (NA 1,45), un X-Cite 120 lampe (EXFO, Ontario, Canada) et un iXon EMCCD caméra (ANDOR, South Windsor, CT) a été utilisé. Un cube filtre FITC (# 48001) et un cube TRITC filtre (n ° 48002, Technologies Chroma, Rockingham, VT) ont été utilisés à des nanosphères d'image et microtubules respectivement sur la surface de fond de cellules d'écoulement. Le temps d'exposition est 0.2s, alors que le temps entre l'exposition est de 2 s.
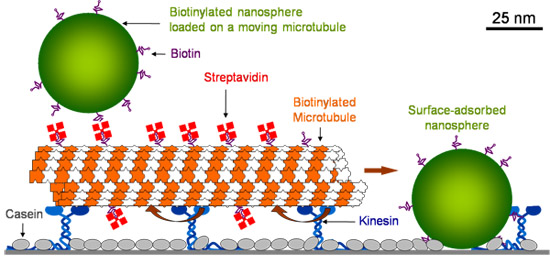
Figure 1. Schéma des navettes moléculaires.
Discussion
Avec des modifications mineures, ce protocole a été utilisé avec succès par une variété de groupes d'assembler kinésine-microtubules tests de motilité base. 10 mM de DTT dans la solution finale motilité peut être remplacé par 0,5% β-mercaptoéthanol. Solutions standard (BRB80AF, KIN20 et MT1000) plus de 2 heures ne doit pas utilisé. Toute solution contenant du taxol microtubules et surtout ne doit jamais être placé sur la glace. Une exposition excessive de la cellule d'écoulement aux UV des résu...
Déclarations de divulgation
Remerciements
Nous sommes très reconnaissants à Jonathan Howard, dont le groupe a développé le protocole de base pour un test de mobilité par glissement qui a ensuite été adapté par nos soins. Le soutien financier de la NSF subvention DMR0645023 est grandement appréciée.
matériels
| Nom du produit | Type | Entreprise | Numéro de catalogue | Commenter |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Adénosine-5'-triphosphate (ATP) | Invitrogen | A1049 | ||
| Tubuline biotine | Cytosquelette Inc | T333 | ||
| Caséine | Sigma-Aldrich | C-0376 | ||
| Catalase | Sigma-Aldrich | C-9322 | ||
| D-(+)-glucose | Sigma-Aldrich | G-7528 | ||
| Diméthylsulfoxyde (DMSO) | Sigma-Aldrich | D-8779 | ||
| Dithiotréitol (TNT) | Bio-Rad | 161-0610 | ||
| L'acide N, N, N ', N'-tétraacétique (EGTA) - éthylène glycol-bis (2-aminoéthyléther) | Sigma-Aldrich | E-4378 | ||
| FluoSpheres biotinylé microsphères, 40 nm, jaune-vert fluorescent (505/515) | Invitrogen | F-8766 | ||
| La glucose oxydase | Sigma-Aldrich | G-7016 | ||
| Guanosine-5'-triphosphate (GTP) | Roche Diagnostic | 106399 | ||
| Du chlorure de magnésium (MgCl 2) | Sigma-Aldrich | 63069 | ||
| Le paclitaxel (Taxol) | Sigma-Aldrich | T1912 | ||
| 1,4-Piperazinediethanesulfonic acide pipérazine-1 ,4-bis (2-éthanesulfonique), Ppipérazine-N, N'-bis (2-éthanesulfonique) (PIPES) | Sigma-Aldrich | P-6757 | ||
| L'hydroxyde de potassium (KOH) | Sigma-Aldrich | P-6310 | ||
| L'hydroxyde de sodium (NaOH) | Sigma-Aldrich | 480878 | ||
| Streptavidine conjugué Alexa Fluor 568 | Invitrogen | S11226 |
Références
- Agarwal, A., Hess, H. Biomolecular motors at the intersection of nanotechnology and polymer science. Progress in Polymer Science. 35 (1-2), 252-252 (2010).
- Howard, J., Hunt, A. J., Baek, S. Assay of microtubule movement driven by single kinesin molecules. Methods Cell Biol. 39, 137-137 (1993).
- Agarwal, A., Katira, P., Hess, H. Millisecond curing time of a molecular adhesive causes velocity-dependent cargo-loading of molecular shuttles. Nano Lett. 9 (3), 1170-1170 (2009).
- Diez, S., Reuther, C., Dinu, C., Seidel, R., Mertig, M., Pompe, W., Howard, J. Stretching and Transporting DNA Molecules Using Motor Proteins. Nano Lett. 3 (9), 1251-1251 (2003).
- Bachand, G. D., Rivera, S. B., Boal, A. K., Gaudioso, J., Liu, J., Bunker, B. C. Assembly and transport of nanocrystal CdSe quantum dot nanocomposites using microtubules and kinesin motor proteins. Nano Lett. 4 (5), 817-817 (2004).
- Coy, D. L., Wagenbach, M., Howard, J. Kinesin takes one 8-nm step for each ATP that it hydrolyzes. J. Biol. Chem. 274 (6), 3667-3667 (1999).
- Katira, P., Agarwal, A., Fischer, T., Chen, H. -. Y., Jiang, X., Lahann, J., Hess, H. Quantifying the performance of protein-resisting surfaces at ultra-low protein coverages using kinesin motor proteins as probes. Advanced Materials. 19, 3171-3171 (2007).
- Vigers, G. P. A., Coue, M., McIntosh, J. R. Fluorescent Microtubules Break Up Under Illumination. J. Cell Biol. 107, 1011-1011 (1988).
- Brunner, C., Hess, H., Ernst, K. -. H., Vogel, V. Lifetime of biomolecules in hybrid nanodevices. Nanotechnology. 15 (10), S540-S540 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon