Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Láser microdisección de captura de Drosophila Neuronas periféricas
En este artículo
Resumen
En este video-artículo se presenta un método para aislar uno o varios Drosophila Neuronas da a partir de larvas de tercer estadio con la captura de infrarrojos (IR) de la clase Laser Microdisección Captura (LCM). ARN obtenido de las neuronas aisladas puede ser fácilmente utilizada para aplicaciones posteriores como QRT-PCR o microarrays de análisis.
Resumen
La arborización dendrítica (da), las neuronas del sistema de Drosophila nervioso periférico (SNP) proporcionan un excelente sistema modelo en el que investigar los mecanismos moleculares que subyacen a la clase específica de 1,2 morfogénesis dendrita. Para facilitar el análisis molecular de la clase específica de desarrollo da las neuronas, es vital para obtener estas células en una población pura. Aunque una variedad de células, tejidos y técnicas específicas de aislamiento de ARN de las células de Drosophila existen, incluyendo la purificación magnética cordón celular basado en 3,4, fluorescente clasificación de células activadas (FACS) 5-8, y la proteína de unión a ARN estrategias basadas en 9, ninguno de estos métodos se pueden utilizar fácilmente para el aislamiento de una o varias clases específicas de Drosophila neuronas da con un alto grado de precisión espacial. Láser captura microdissection (LCM) se ha convertido en una herramienta extremadamente poderosa que puede ser usado para aislar determinados tipos de células a partir de secciones de tejido con un alto grado de resolución espacial y precisión. ARN obtenido a partir de células aisladas puede ser utilizado para los análisis incluidos QRT-PCR y microarrays de perfiles de expresión en un tipo de célula 10-16. Hasta la fecha, LCM no ha sido ampliamente aplicado en el análisis de los tejidos y las células de Drosophila 17,18, incluyendo las neuronas da en la etapa larval tercer estadio de desarrollo.
Aquí les presentamos nuestro protocolo optimizado para el aislamiento de las neuronas de Drosophila da con los rayos infrarrojos (IR) clase de LCM. Este método permite la captura de las neuronas individuales, da clases específicas o múltiples, con una alta especificidad y resolución espacial. La misma edad larvas tercer estadio que expresa una UAS-mCD8:: GFP 19 transgén bajo el control de cualquiera de la clase IV da neurona específica PPK-GAL4 20 driver o el pan-da neurona específica 21-7 21-GAL4 conductor fueron utilizados para estos experimentos. ARN obtenido a partir del aislado neuronas da es de muy alta calidad y se pueden usar directamente para las aplicaciones posteriores, incluida la QRT-PCR o microarrays de análisis. Además, este protocolo de LCM se pueden adaptar fácilmente para capturar otros tipos de células Drosophila una las distintas etapas de desarrollo depende del tipo específico de célula, GAL4 impulsada por el patrón de expresión de GFP.
Protocolo
Comentarios generales sobre el mcm de Drosophila neuronas periféricas
Permite a partir de 6 horas, hasta una semana o más para LCM dependiendo del tipo de tejido y el número de células necesarias.
Todos los procedimientos se llevan a cabo en estricto RNasa libre de las condiciones siguientes procedimientos estándar. Las larvas se manifieste 21-7-GAL4, UAS-mCD8:: GFP o ppk GAL4, UAS-mCD8:: GFP líneas transgénicas reportero fueron utilizados para estos experimentos.
1. Preparación de las larvas
- Recoger la misma edad 30-40 larvas de tercer estadio y lavarlas en ddH2O seguido por enjuagues breve RNAsa Away (Sigma-Aldrich), y un lavado final en ddH2O para eliminar RNAsa lejos. Mecha del exceso ddH2O completamente con una Kimwipe limpia antes de la incorporación de las larvas en octubre
- Tome un molde de tejido incorporación limpio y capa con una capa fina (1,5 a 2 mm) de la capa de octubre, apenas suficiente para cubrir una sola capa de larvas.
- Antes de la incorporación de las larvas, si es necesario, enfriar el octubre a 0 ° C en los moldes de tejido de inserción. Para ello, colocar el molde que contiene octubre en un bloque de hielo. Esto ayudará a reducir el movimiento de las larvas durante el proceso de incorporación.
- Coloque las larvas limpia en la OCT pre-enfriado y organizar en paralelo el uno al otro. Una vez que las larvas se han organizado, poco a poco llenar el molde con octubre sin alterar la disposición de las larvas. Ajustar congelar el molde, colocándolo en un bloque de hielo seco. [Paso Crítico:. Complemento congelar las larvas de inmediato para reducir el movimiento] Este método permite que las larvas de estar en un solo plano, maximizando el número de células disponibles por parte de las capturas.
Si es necesario para preservar la morfología de los tejidos para la identificación de las células de interés, o si el número esperado de células por sección se encuentra para ser satisfactorios, vaya directamente al paso 11.
Alternativamente, si las células están etiquetados específicamente y se pueden identificar con un marcador fácilmente identificables como GFP o RFP, pero el número de células por sección se encuentra una baja, entonces los pasos 5-10 de mayo de ser útil para aumentar el número de células disponibles para la captura de cada sección. Estos son pasos opcionales y debe ser considerada sólo si es necesario, como un método para aumentar el número de neuronas da para LCM por sección, cuando el otro método no proporciona buenos resultados. [Atención: Este método puede alterar la morfología de los tejidos en general y hacer la identificación de tejidos basados en la localización espacial específica muy difícil.]
- Lavado de 50-70 larvas de tercer estadio como se describe en el Paso 1. Coloque las larvas en un tubo de microcentrífuga de 1,5 ml que contiene 500 l de RNasa libre 1X PBS.
- Dounce las larvas utilizando un mortero de polipropileno (EE.UU. Científicas), con 6-7 brazadas lentas.
- Centrifugar la solución a 16.000 (x) g durante 5-10 segundos (hasta que la cutícula larval se establecen en la parte inferior del tubo de microcentrífuga]. Descartar el sobrenadante. La pastilla debe consistir principalmente de la cutícula larval en que el sistema nervioso periférico, incluyendo las neuronas da , está fuertemente adherido.
- Lave la cutícula pellet 2-3 veces en 1X PBS y resuspender el precipitado en 500 l de PBS 1X. Haga girar la solución a 16.000 (x) g durante 1 minuto para formar un compacto de pellets. Aspirar el sobrenadante por completo con una multa de una pipeta Pasteur.
- Retire con cuidado el sedimento del tubo de microcentrífuga con una espátula limpia, y la mecha el exceso de PBS con un pañuelo de papel Kimwipe limpio. [Nota: Es importante mantener la pastilla lo más compacto posible para aumentar el rendimiento celular]. Coloque el compacto pellet cutícula en un molde de plástico que contiene una fina capa de octubre (aprox. 1 mm).
- Suavemente hacia fuera el precipitado en un área circular delgada. Rellene el molde con octubre, y la congelación de los tejidos como se describe en el Paso 4.
- El uso de un criostato, corte cortes congelados con un espesor de 5.8 m en la llanura, la etiqueta, sin carga, RNasa libre portaobjetos de vidrio. [Paso crítico: la posición de las secciones de tejido cerca del centro de la diapositiva.]
- Tienda de las diapositivas, ya sea directamente en hielo seco o a -80 ° C en un recipiente limpio de diapositivas de la caja hasta que esté listo para microdisección. LCM realizar preferentemente dentro de una semana después de seccionar el tejido.
2. Eliminación de la deshidratación y la cutícula de las larvas congeladas las secciones
[Paso Crítico: Todas las soluciones para la deshidratación debe prepararse antes de cada sesión LCM. La deshidratación completa de las secciones de tejido congelado larval es esencial para lograr la eficiencia óptima microdisección]
- Eliminar las diapositivas que contienen las secciones congeladas de tejido de la larva -80 ° C congelador y colocarlos en hielo seco.
- Quitar una sola diapositiva de hielo seco y de inmediato se ponga directamente en un 50 ml cónicos tuse llena de fijador de etanol al 70%, seguido de un corto de enjuague en RNasa libre ddH2O de acuerdo con los tiempos recomendados en la Tabla 1.
- La presencia de la cutícula de larvas en las secciones de congelados pueden afectar la eficiencia de captura mediante la prevención de LCM eficiente tapa de las células de contacto que puede llevar a no específicos de captura. Si es necesario, llevar a cabo los siguientes pasos (4-5) para eliminar la cutícula de las secciones de tejido.
- Suavemente pipeta de 50 l de 2,5% de tripsina directamente en las secciones de tejido y se incuba durante 5-30 segundos a temperatura ambiente. [Paso Crítico: Este paso puede requerir de optimización. El tiempo de incubación depende del tejido que se microdissected y espesor de la sección. Ya la incubación puede borrar todo, incluyendo las células de interés, mientras que un corto de incubación puede ser insuficiente para eliminar la cutícula]
- Enjuague las secciones brevemente en un tubo cónico de 50 ml que contiene RNasa libre ddH2O para eliminar la tripsina, y ligeramente adheridos fragmentos de cutícula.
- Sumergir las preparaciones de forma secuencial en cada una de las restantes etanol y xileno soluciones para los tiempos recomendados (Tabla 1) para completar el proceso de deshidratación.
- Siguiendo el gradiente de la deshidratación, las diapositivas se describen brevemente seca bajo una corriente de aire suave durante 60-120 segundos a temperatura ambiente antes de realizar la LCM. [Atención: el xileno seco por completo de las secciones de tejido antes de realizar la LCM. Xileno se conoce a disolver el tapón LCM polímero resultante en la insuficiencia microdisección].
| 70% de etanol (fijador) | 3.10 Segundos |
| ddH2O | 5-10 segundos |
| 2,5% de tripsina de incubación | 5-30 segundos |
| ddH2O | 5-10 segundos |
| 70% de etanol | 60 Segundos |
| Etanol al 95% | 60 Segundos |
| 100% de etanol | 120 Segundos |
| 100% de etanol | 120 Segundos |
| 100% de xileno | 120 Segundos |
| 100% de xileno | 120 Segundos |
| Secar al aire en una corriente de aire templado | 60-120 segundos |
Tabla 1: Procedimiento recomendado para la deshidratación de la LCM congelados secciones de tejido larval.
3. Láser microdisección de captura
PixCell IIe instrumento LCM equipado con la óptica de epifluorescencia Fluor 300 optimizado para EGFP fue utilizado para la realización de la LCM.
[Paso Crítico: Si es posible, realizar la microdisección en una habitación con humedad controlada para evitar cualquier reducción en la eficiencia de microdisección por aumento de la humedad. Humedad del ambiente es un factor crítico que afecta la eficiencia de microdisección. Humedad ambiental baja puede causar un aumento de la electricidad estática se aferran resultado no específico de captura, mientras que la humedad ambiente alta puede resultar en la eficiencia de microdisección bajo. Hemos logrado la eficiencia LCM óptimo entre 25-50% de humedad relativa.]
- A su vez en el poder por el microscopio y la caja de control del láser.
- Cargar la tapa de montaje CapSure titular con HS LCM tapas (Molecular Devices): Dos cartuchos de tapas de LCM se pueden cargar al mismo tiempo.
- Abra el software de Molecular Devices y rellene el experimento, con número de diapositiva y el número de lote Cap.
- Cargar un nuevo cap SA LCM del cartucho en el instrumento PixCell IIe LCM y la posición correcta con respecto a la palanca de mando para asegurar la posición apropiada de la PAC en relación con el área de captura.
- Coloque el portaobjetos de microscopio que contiene secciones de larvas recién deshidratado tejido en el microscopio de microdisección.
- Localizar las células marcados con fluorescencia utilizando los oculares o la pantalla del ordenador. Debido a la alta especificidad de PPK-GAL4, UAS-mCD8:: GFP línea reportero transgénicos, la clase IV neuronas da pueden ser fácilmente identificados por la fluorescencia de GFP.
- Tema que el tejido se utiliza CapSure LCM LCM SA tapas [de un conjunto detallado de instrucciones para la configuración del instrumento, enfocando el láser y la realización de LCM véase la referencia 22].
- Ajuste el "Power" y "Duración" los parámetros láser de pulso para lograr un lugar preciso polímero fundido, cuyo tamaño se corresponde con el tamaño del punto láser seleccionado. Ajustar la configuración para personalizar el tamaño del área de polímeros fundidos. Los siguientes parámetros fueron utilizados para microdissecting sola clase IV da las neuronas: diámetro del punto 7.5 micras, fuerza láser 30-50 mW, láser y el tiempo 2-4 Ms y 1.2 disparos por celular se utilizaron. [Paso crítico: los parámetros del láser necesaria para un lugar adecuado puede variar con el grosor de los tejidos y las condiciones ambientales de humedad. Ajuste el "Power" y la configuración de "Duración" para alcanzar el tamaño requerido fundido lugar de polímeros para microdissecting células individuales o múltiples.]
- Para maximizar la especificidad, microdissect células con un solapamiento mínimo y una fuerte fluorescencia. Cada cápsula es capaz de capturar numerosos cuerpos de la célula. [Paso Crítico: Para evitar la degradación del ARN, limitar el tiempo total de análisis, incluyendo la deshidratación y microdisección a menos de 45 minutos]
- Una vez que todas las células de interés han sido capturados, levante la tapa del SA LCM con las células microdissected y lo colocó en un portaobjetos limpio para confirmar la presencia de las células capturadas y una inspección visual de la tapa de la presencia de células no deseadas o escombros.
4. Aislamiento de ARN de las células derivadas de LCM
- Coloque la tapa que contiene las células microdissected a un ExtracSure (Molecular Devices) del dispositivo. Añadir 12μl de tampón de extracción de RNA (PicoPure, Molecular Devices) a la superficie de la PAC que contiene las células y conectar una invertida de paredes delgadas tubo de reacción (GeneAmp, Applied Biosystems) en el dispositivo ExtracSure. Coloque el conjunto en una bandeja de alineación (Molecular Devices) y cubrir con un bloque de incubación (Molecular Devices) pre-calentado a 42 ° C dentro de una incubadora.
- Tras una incubación de 30 minutos, centrifugar los tubos que contienen los extractos a 800 (x) g durante 2 minutos. Cerrar los tubos y almacenar los extractos de células a -80 ° C hasta que esté listo para la purificación del RNA.
- Extraer y purificar el ARN columna de acuerdo con la PicoPure (Molecular Devices) las instrucciones del kit de extracción de RNA. DNasa tratamiento es opcional, y se puede realizar en la columna durante la purificación del RNA según sea necesario. Si es necesario, varias muestras de LCM se pueden agrupar juntos durante la purificación en una sola columna para aumentar el rendimiento final de ARN y puede ser eluido en un volumen pequeño (11-30 l) de tampón de elución (PicoPure, Molecular Devices) y almacenados a -80 ° C hasta que esté listo para su uso. Si se desea una alícuota de 1 l se puede utilizar para evaluar la calidad total de ARN en un Bioanalyzer 2100 (Agilent Technologies, Inc.).
Resultados representante
Láser captura microdissection (LCM) se utilizó para aislar único, específico de la clase o múltiples Drosophila neuronas da a partir de larvas de tercer estadio (Figura 1). LCM permite un alto grado de precisión y especificidad en el aislamiento de los cuerpos de las células Drosophila da la neurona (Figura 2a-c). Por otra parte, el ARN total purificado a partir de estas neuronas aisladas da se encontró que era de excelente calidad, como se indica por la presencia de fuerte 5.8S, 18S y 28S del RNA ribosomal picos cuando se analiza en un Agilent 2100 Bioanalyzer (Agilent Technologies, Inc.) (Figura 2d).
Para evaluar el enriquecimiento neuronal específica de las células aisladas se realizó cuantitativa en tiempo real PCR con transcripción inversa (QRT-PCR) utilizando los genes específicos neuronal marcador, elav. Para los análisis de QRT-PCR, se ha calculado los niveles relativos de expresión elav en el LCM microdissected las neuronas y da expresión normalizada esta a la de nuestro control endógeno (rp49) y en relación con el ARN total aislado a partir de larvas enteras utilizando el método ΔΔCt 23. Estos análisis revelaron más de 2,5 veces en el enriquecimiento de los niveles relativos de elav en LCM micro-disección da muestras de las neuronas en comparación con la totalidad de animales (Figura 3).
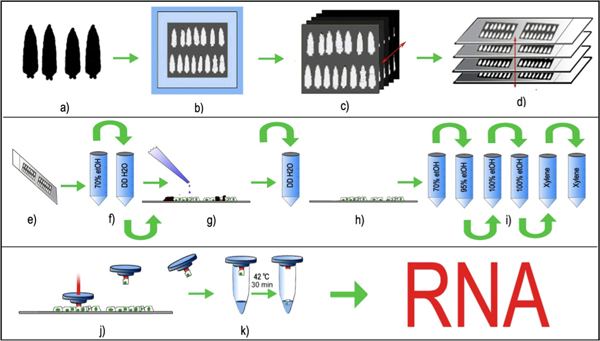
Figura 1: LCM de Drosophila neuronas periféricas. (A) emparejados por edad larvas de tercer estadio se seleccionan, se lavan y (b) incrustado en una cryomold con octubre y congelado a -80 ° C, (c) 8μm secciones de tejido de serie se crean usando un criostato estándar y (d) colocar de manera uniforme en diapositivas limpiar el cristal. Las diapositivas de cristal con los cortes de tejido fijado se almacenan a -80 ° C antes de la LCM de procesamiento. (E, f) Inmediatamente antes de la LCM, las secciones de tejido se descongelan y se fija brevemente en etanol al 70% seguido de enjuague breve en ddH 2 O. (g) Los portaobjetos se incuban brevemente con tripsina y se enjuaga con ddH2O para eliminar las cutículas (negro) de las secciones de las larvas. (h, i) las secciones de tejido sin cutícula larval luego son deshidratados en un gradiente de etanol y se aclaró finalmente en xileno . (j) La tapa de LCM con un polímero termolábiles se coloca en la sección de los tejidos y el láser es pulsado en el cuerpo de la célula fluorescente seleccionado. El pulso de láser funde el polímero y envuelve el cuerpo de la celda seleccionada. La tapa de polímero, junto con el cuerpo de la célula capturada se levantó, y (k) buffer de extracción de RNA se añade a la celda. La célula capturada, junto con el tampón de extracción de ARN se incuba a 42 ° C durante 30 minutos y pueden ser almacenadas a -80 ° C, o directamente procesado para la purificación del RNA.
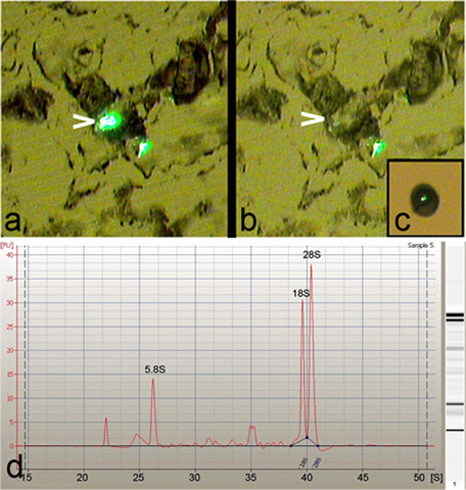
Figura 2: LCM facilita la captura de alta precisión de las neuronas da. (A) imagen representativa de una deshidratación y la tripsina tratados 8 micras de sección de tejido antes de la realización de LCM, que muestra a dos clases IV-da neuronas marcadas con GFP por el PPK-GAL4, UASmCD8:: GFP cepa reportero. Tenga en cuenta que una de las neuronas se pone de relieve (cabeza de flecha) para la captura. (B) el cuerpo celular de la neurona resaltado (cabeza de flecha) se limpia de micro-disección con una alta especificidad de la sección de tejido. (C) final a la vista de una sola clase -IV da neurona capturado en la tapa del LCM. (d) de Agilent 2100 Bioanalyzer (Agilent Technologies, Inc.) electroferograma de ARN total aislado de LCM derivados de las neuronas da, mostrando una excelente calidad de ARN, como se indica por la presencia de fuerte 5.8S, 18S y 28S rRNA picos.
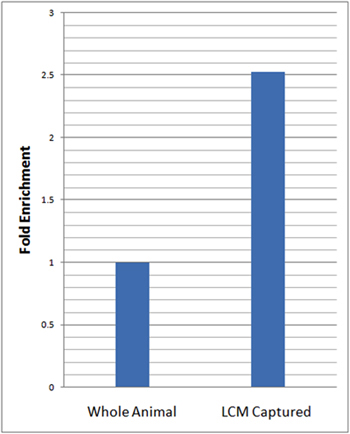
Figura 3:. QRT-PCR revela enriquecimiento sustancial de la expresión del gen marcador neuronal en las neuronas LCM capturado da en relación con los animales todo QRT-PCR análisis de neuronas específicas de la expresión del gen marcador (elav) en LCM capturado da las neuronas (21-7-GAL4, UAS-mCD8:: GFP) y la totalidad de animales en edad larvas de tercer estadio emparejado se realizó por triplicado. Los niveles relativos de expresión en elav LCM capturado neuronas da se normalizaron con el control endógeno (rp49) y en relación con las larvas de todo el método de ΔΔCt 23. Un enriquecimiento de 2,5 veces en los niveles relativos de elav en LCM capturado da muestras de las neuronas se observó en relación con la totalidad de animales.
Solución de problemas
Problema: degradados, o de baja calidad del ARN.
Asegurar condiciones RNasa libre en todo experimento. Intente reducir la cantidad de tiempo dedicado a la LCM por diapositiva a 30 minutos. Mantenga las diapositivas y las muestras en hielo seco, excepto cuando se realiza LCM. Evite descongelar las secciones de tejido, una vez que se cortan.
Problema: La mayoría de las células se pierden de la diapositiva durante el tratamiento con tripsina (paso 17-18).
Trate de reducir el tiempo de tratamiento con tripsina. Trate de reducir la concentración de tripsina.
Problema: Presencia de la cutícula y otros no específicos restos de tejido en el polímero de la tapa.
Trate de eliminar los restos de tejido por borrar la superficie del polímero con el lado pegajoso de una nota adhesiva 22.
Problema: Baja eficiencia LCM.
Intente aumentar el tiempo de incubación en el 100% de etanol y xileno. Reducir la humedad ambiente utilizando deshumidificadores.
Access restricted. Please log in or start a trial to view this content.
Discusión
El protocolo presentado en este documento se describe nuestro método optimizado para el aislamiento de las neuronas de Drosophila periféricos a través de LCM. Aunque este protocolo de LCM fue diseñado para el aislamiento específico de neuronas individuales, específicos de la clase o múltiples Drosophila da a partir de la tercera fase estadio larval de desarrollo, modificaciones menores del protocolo podría ser fácilmente adaptado para la captura de otros tipos de células de todo el desarrollo...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Agradecemos a los Dres. Yuh-Nung Jan y Grueber Wes para proporcionar poblaciones de moscas utilizadas en este estudio, y Virginia Espina, el Dr. Emanuel Petricoin y el Dr. Lance Liotta para obtener ayuda con LCM. Los autores agradecen la F. Thomas y Kate Miller Jeffress Memorial Trust para el apoyo de esta investigación (DNC) y la Universidad George Mason Provost Oficina s (EPRI).
Access restricted. Please log in or start a trial to view this content.
Materiales
Equipos:
- Criostato
- Tubo de 50 ml cónicos para la fijación de diapositivas, lavado, tratamiento con tripsina y etanol / deshidratación xileno
- -80 ° C congelador
- Incubadora
- PixCell IIe Instrumento LCM con Fluor 300 óptica de epifluorescencia optimizado para EGFP (Molecular Devices, Molecular Devices)
Referencias
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Parrish, J. Z., Emoto, K., Kim,, Jan, Y. N. Mechanisms that regulate establishment, maintenance, and remodeling of dendritic fields. Annu. Rev. Neurosci. 30, 399-423 (2007).
- Wang, X., Starz-Gaiano, M., Bridges, T., Montell, D. Purification of specific cell populations from Drosophila tissues by magnetic bead sorting, for use in gene expression profiling. Nature Protocols. , (2008).
- Iyer, E. P. R., Iyer, S. C., Sulkowski, M. J., Cox, D. N. Isolation and purification of Drosophila peripheral neurons by magnetic bead sorting. J Vis Exp. 34, 2912-2917 (2004).
- Tirouvanziam, R., Davidson, C. J., Lipsick, J. S., Herzenberg, L. A., Tirouvanziam, R., Tirouvanziam, R. Fluorescence-activated cell sorting (FACS) of Drosophila hemocytes reveals important functional similarities to mammalian leukocytes. Proc. Natl. Acad. Sci. 101, 2912-2917 (2004).
- Shigenobu, S., Arita, K., Kitadate, Y., Noda, C., Kobayashi, S. Isolation of germline cells from Drosophila embryos by flow cytometry. Dev. Growth Differ. 48, 49-57 (2006).
- Reeves, N., Posakony, J. W. Genetic programs activated by proneural proteins in the developing Drosophila PNS. Dev. Cell. 8, 413-425 (2005).
- Jinushi-Nakao, S. Knot/Collier and Cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Yang, Z., Edenberg, H. J., Davis, R. L. Isolation of mRNA from specific tissues of Drosophila by mRNA tagging. Nucl. Acids Res. 33, (2005).
- Appay, V. Sensitive Gene Expression Profiling of Human T Cell Subsets Reveals Parallel Post-Thymic Differentiation for CD4+ and CD8+ Lineages. J. Immunol. 179, 7406-7414 (2007).
- Ginzinger, D. G. Gene quantification using real-time quantitative PCR: An emerging technology hits the mainstream. Exp. Hematol. 30, 503-512 (2002).
- Keays, K. M., Owens, G. P., Ritchie, A. M., Gilden, D. H., Burgoon, M. P. Laser capture microdissection and single-cell RT-PCR without RNA purification. J. Immunol. Methods. 302, 90-98 (2005).
- Volgin, D. V., Swan, J., Kubin, L. Single-cell RT-PCR gene expression profiling of acutely dissociated and immunocytochemically identified central neurons. J. Neurosci. Methods. 136, 229-236 (2004).
- Emmert-Buck, M. R. Laser capture microdissection. Science. 274, 998-1001 (1996).
- Xiao, W. Gene expression profiling in embryonic mouse lenses. Mol. Vis. 12, 1692-1698 (2006).
- Scharschmidt, T. Analysis of human osteoarthritic connective tissue by laser capture microdissection and QRT-PCR. Connect. Tissue Res. 48, 316-323 (2007).
- Spletter, M. L. regulates Drosophila olfactory projection neuron identity and targeting specificity. Neural Dev. 2, 14-14 (2007).
- Hoopfer, E. D., Penton, A., Watts, R. J., Luo, L. Genomic analysis of Drosophila neuronal remodeling: a role for the RNA-binding protein Boule as a negative regulator of axon pruning. J. Neurosci. 28, 6092-6103 (2008).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. USA. 104, 5199-5204 (2007).
- Espina, V. Laser capture microdissection. Nat. Prot. 1, 586-603 (2006).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25, 402-408 (2001).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados