É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Laser Microdissecção Captura de Drosophila Neurônios periféricos
Neste Artigo
Resumo
Neste vídeo-artigo apresentamos um método para isolar um ou vários Drosophila da a partir de larvas de terceiro estádio usando a captura de infravermelho (IR) da classe Laser Microdissecção Capture (LCM). RNA obtido a partir de neurônios isolados podem ser facilmente usados para aplicações a jusante, incluindo qRT-PCR ou microarray análises.
Resumo
A arborização dendrítica (da) neurônios do sistema nervoso periférico Drosophila (PNS) fornecer um sistema modelo excelente para investigar os mecanismos moleculares subjacentes à classe específico 1,2 morfogênese dendrite. Para facilitar a análise molecular de classe específico da neurônio desenvolvimento, é vital para obter essas células em uma população pura. Embora uma gama de células diferentes, e específicos do tecido técnicas de isolamento de RNA existem para células Drosophila, incluindo a purificação de células grânulo magnético baseado 3,4, separação de células fluorescentes Ativado (FACS) 5-8, e proteína RNA ligação estratégias baseadas 9, nenhum dos estes métodos podem ser facilmente utilizadas para isolar um ou vários de classe específica de neurônios da drosófila com um alto grau de precisão espacial. Laser Microdissecção Capture (LCM) emergiu como uma ferramenta extremamente poderosa que pode ser usado para isolar tipos específicos de células a partir de secções de tecido com um alto grau de resolução espacial e precisão. RNA obtido a partir de células isoladas podem então ser usados para análises incluindo qRT-PCR e perfil de expressão microarray dentro de um tipo de célula dada 10-16. Até à data, LCM não tem sido amplamente aplicado na análise de tecidos e células Drosophila 17,18, incluindo os neurônios da na terceira fase larval estádio de desenvolvimento.
Aqui apresentamos o nosso protocolo otimizado para o isolamento de neurônios da drosófila usando a classe infravermelho (IR) da LCM. Este método permite a captura de único, específico de classe ou múltiplos neurônios da alta especificidade e com resolução espacial. Pareados por idade larvas de terceiro estádio expressando um UAS-mCD8:: GFP transgene 19 sob o controle de qualquer um da classe IV da neurônio específico ppk-GAL4 20 driver ou o pan-da neurônio específico 21-7-21 GAL4 motorista foram utilizados para estes experimentos. RNA obtido a partir de neurônios isolados da é de qualidade muito alta e pode ser usado diretamente para aplicações a jusante, incluindo qRT-PCR ou microarray análises. Além disso, este protocolo LCM podem ser facilmente adaptadas para capturar outros tipos de células Drosophila um vários estágios de desenvolvimento depende do tipo específico de célula, padrão de expressão GAL4-driven da GFP.
Protocolo
Comentários gerais sobre LCM de Drosophila periférica Neurônios
Permitir que a partir de 6 horas, até uma semana ou mais para LCM, dependendo do tipo de tecido eo número de células necessárias.
Todos os procedimentos são realizados em estrita RNAse-free condições seguintes procedimentos padrão. Larvas expressar tanto 21-7-GAL4, UAS-mCD8:: GFP ou ppk-GAL4, UAS-mCD8:: Linhas repórter GFP transgênicas foram utilizados para esses experimentos.
1. Preparando as larvas
- Coletar 30-40 pareados por idade larvas de terceiro estádio e lave-os em DDH 2 O seguido por lavagens em breve Fora RNAse (Sigma-Aldrich), e uma lavagem final em DDH 2 O RNAse para remover Away. Wick o excesso DDH 2 O completamente com um Kimwipe limpa antes de incorporar as larvas em outubro
- Tome um molde incorporação limpa tecido e camada com uma camada (1,5-2mm) fina de outubro, apenas o suficiente para cobrir uma única camada de larvas.
- Antes de incorporar as larvas, se necessário, arrefecer o OCT para 0 ° C nos moldes de incorporação do tecido. Fazer isso colocando o molde contendo outubro em um bloco de gelo. Isto ajudará a reduzir o movimento larval durante o processo de incorporação.
- Coloque as larvas limpa no outubro de pré-resfriado e organizá-los em paralelo um ao outro. Uma vez que as larvas foram organizados, lentamente preencher o molde com outubro, sem perturbar o arranjo larval. Snap congelar o molde, colocando-o em um bloco de gelo seco. [Passo Crítico:. Snap-congelante as larvas imediatamente para reduzir o movimento] Este método permitirá que as larvas de estar em um único plano, maximizando o número de células disponíveis por seção para captura.
Se for necessário para preservar a morfologia do tecido para identificar as células de interesse, ou se o número esperado de células por seção é considerada satisfatória em seguida, avance directamente para o Passo 11.
Alternativamente, se as células são rotulados especificamente e podem ser identificados com um marcador facilmente identificáveis, tais como GFP ou RFP, mas o número de células por seção for considerada baixa, então 5-10 passos podem ser úteis para aumentar o número de células disponíveis para a captura por seção. Estes são passos opcional e deve ser considerado apenas se for necessário, como um método para aumentar o número de neurônios da disponíveis para LCM por seção, quando o outro método não fornece resultados favoráveis. [Atenção: Este método pode perturbar a morfologia dos tecidos em geral e tornar a identificação de tecidos com base na localização espacial específica muito difícil.]
- Lavar 50-70 larvas de terceiro estádio como descrito na Etapa 1. Coloque as larvas em um microtubo de 1,5 ml contendo 500 mL de RNAse 1X PBS.
- Dounce as larvas utilizando um pilão de polipropileno (EUA Científica), com 6-7 lento golpes poderosos.
- Centrifugar a solução a 16.000 (x) g por 5-10 segundos (até as cutículas larval sossegar até o fundo do tubo de microcentrífuga]. Desprezar o sobrenadante. O pellet deve consistir principalmente de cutícula larval em que o PNS, incluindo os neurônios da , está fortemente aderido.
- Lave a cutícula pellet 2-3 vezes em 1X PBS eo pellet ressuspender em 500 mL de 1X PBS. Girar a solução a 16.000 (x) g por 1 minuto para formar uma pelota compacta. Aspirar o sobrenadante completamente usando uma multa Pasteur pipeta.
- Remova cuidadosamente o sedimento do tubo de microcentrífuga com uma espátula limpa, e pavio fora da PBS em excesso com um lenço de papel Kimwipe limpo. [Nota: É importante manter o pellet o mais compacto possível para aumentar o rendimento das células]. Coloque o compacto cutícula pellet em um molde de plástico contendo uma fina camada de outubro (aproximadamente 1mm).
- Delicadamente espalhar-se o sedimento em uma área circular fina. Preencher o molde com outubro, e congelar o tecido, como descrito na Etapa 4.
- Utilizando um criostato, cortar seções congeladas a espessura 5-8 mM na planície, rotulado, sem carga, RNAse lâminas de microscópio livre vidro. [Passo Crítico: Posicione a cortes de tecido, perto do centro do slide.]
- Armazenar os slides diretamente em gelo seco ou a -80 ° C em um ambiente limpo deslize-box até que esteja pronto para microdissecção. Executar LCM de preferência dentro de uma semana após o corte do tecido.
PONTO PAUSE
2. Remoção de desidratação e congelados a partir da cutícula larval Seções
[Passo Crítico: Todas as soluções para a desidratação deve ser renovada antes de cada sessão LCM. Desidratação completa de cortes de tecidos congelados larval é essencial para alcançar a eficiência ideal microdissecção]
- Retire as lâminas contendo os cortes de tecidos congelados larval do freezer -80 ° C e colocá-los em gelo seco.
- Remover um único slide de gelo seco e imediatamente colocá-lo diretamenteem um tubo de 50 ml cheio de fixador de etanol 70%, seguido por um curto enxágüe em RNAse DDH 2 O de acordo com os tempos recomendados apresentados na Tabela 1.
- A presença de cutícula larval nas seções congeladas pode prejudicar a eficiência da captação eficiente, impedindo LCM contato cap células que podem levar à não-específica de captura. Se necessário, realizar os seguintes passos (4-5) para limpar a cutícula das seções do tecido.
- Suavemente pipeta 50 ul de tripsina 2,5% diretamente sobre as secções de tecido e incubar por 5-30 segundos à temperatura ambiente. [Passo Critical: Esse passo pode exigir de otimização. O tempo de incubação depende do tecido a ser microdissecção e espessura de corte. Mais de incubação pode limpar tudo, incluindo as células de interesse, enquanto que uma incubação é curto, pode ser insuficiente para remover a cutícula]
- Lave as seções brevemente em um tubo de 50 ml contendo RNAse-free DDH 2 O para remover tripsina, e fragmentos de cutícula frouxamente aderido.
- Mergulhar as lâminas seqüencialmente em cada um dos restantes etanol e xileno soluções para os horários recomendados (Tabela 1) para completar o processo de desidratação.
- Seguindo o gradiente de desidratação, as lâminas são brevemente seco sob uma corrente de ar suave para 60-120 segundos à temperatura ambiente antes de executar LCM. [Cuidado: Seque o xileno completamente as secções de tecido antes de realizar LCM. Xileno é conhecido por dissolver a LCM cap polímero resultando em insuficiência microdissecção].
| Etanol 70% (Fixação) | 10/03 Segundos |
| 2 O DDH | Segundos 10/05 |
| Incubação Tripsina 2,5% | Segundos 30/05 |
| 2 O DDH | Segundos 10/05 |
| Etanol 70% | 60 Seconds |
| Etanol 95% | 60 Seconds |
| O etanol 100% | 120 Seconds |
| O etanol 100% | 120 Seconds |
| Xileno 100% | 120 Seconds |
| Xileno 100% | 120 Seconds |
| Ar seco em um fluxo de ar leve | 60-120 Segundos |
Tabela 1: Procedimento recomendado para a desidratação LCM de cortes de tecidos congelados larval.
3. Laser Microdissecção Captura
PixCell IIe instrumento LCM equipado com Fluor 300 óptica de epifluorescência otimizado para EGFP foi usado para a realização do LCM.
[Passo Crítico: Se possível, execute as microdissecção em uma sala com controle de umidade para evitar qualquer redução na eficiência microdissecção devido ao aumento da umidade. Humidade ambiente é um fator crítico que afetam a eficiência microdissecção. Humidade ambiente de baixa pode causar um aumento static-se apegam resultando em não-específico de captura, enquanto humidade ambiente elevada pode resultar em eficiência microdissecção baixo. Conseguimos eficiência LCM ideal entre 25-50% as condições de umidade relativa.]
- Ligue a energia para o microscópio e caixa de controle a laser.
- Carregar o conjunto do suporte CapSure tampa com HS LCM tampas (dispositivos Molecular): Dois cartuchos de tampas LCM pode ser carregado em uma hora.
- Abra o software de dispositivos moleculares e insira os detalhes experiência, incluindo número do slide e número de lote Cap.
- Carregar um novo HS cap LCM do cartucho no instrumento PixCell LCM IIe e posicioná-lo corretamente com relação ao joystick para garantir o posicionamento adequado da tampa em relação à área de captura.
- Coloque a lâmina de microscópio contendo fresco desidratado secções de tecido larval no palco microscópio para microdissecção.
- Localizar as células fluorescente etiquetado com o oculares ou a tela do computador. Devido à elevada especificidade de ppk-GAL4, UAS-mCD8:: GFP linha repórter transgênicos, a classe IV da neurônios podem ser facilmente identificados por GFP fluorescência.
- Assunto para o tecido usando LCM CapSure HS LCM tampas [para um conjunto detalhado de instruções para a configuração do instrumento, focalizando o laser e realizando LCM ver referência 22].
- Ajustar o "Power" e "Duração" parâmetros do laser de pulso para alcançar um ponto de polímero precisa derretido, cujo tamanho corresponde ao tamanho selecionado a laser spot. Ajustar as configurações para personalizar o tamanho da área de polímeros derretido. Os seguintes parâmetros foram usados para microdissecting única classe IV da neurônios: Diâmetro 7,5 ponto M, a força do laser 30-50 mW, tempo de laser e 2-4 e 1-2 ms shots por célula foram utilizados. [Passo Crítico: os parâmetros do laser necessária para um local adequado pode variar com a espessura do tecido e as condições de umidade ambiente. Ajustar o "Power" e "Duração" configurações para alcançar o tamanho exigido local derreteu polímero para microdissecting células únicas ou múltiplas.]
- Para maximizar a especificidade, microdissect células com sobreposição mínima e uma fluorescência forte. Cada cápsula é capaz de capturar corpos celulares numerosos. [Passo Crítico: Para evitar a degradação do RNA, limitar o tempo de análise total, incluindo a desidratação e microdissecção para menos de 45 minutos]
- Uma vez que todas as células de interesse foram capturados, levante a tampa HS LCM com as células microdissecção e colocou-o sobre uma lâmina limpa para confirmar a presença das células capturado e inspecionar visualmente a tampa para a presença de células indesejáveis ou detritos.
4. RNA isolamento de células derivadas LCM
- Coloque a tampa contendo as células microdissecção a um dispositivo (dispositivos Molecular) ExtracSure. Adicionar 12μl de extração de RNA buffer (PicoPure, Dispositivos Molecular) para a superfície cap contendo as células e conectar um tubo de reação invertida de paredes finas (GeneAmp, a Applied Biosystems) para o dispositivo ExtracSure. Coloque o conjunto em uma bandeja de alinhamento (dispositivos Molecular) e cobri-lo com um bloco de incubação (dispositivos Molecular) pré-aquecido a 42 ° C dentro de uma incubadora.
- Após incubação de 30 minutos, centrifugar os tubos contendo os extratos a 800 (x) g por 2 minutos. Fechar os tubos e armazenar os extratos de células a -80 ° C até que esteja pronto para a purificação de RNA.
PONTO PAUSE
- Extrair e purificar o RNA coluna de acordo com o PicoPure (dispositivos Molecular) RNA instruções do kit de extração. Tratamento DNAse é opcional, e pode ser realizada na coluna durante a purificação RNA, se necessário. Se necessário, as amostras de LCM múltiplos podem ser agrupados durante a depuração em uma única coluna para aumentar o rendimento final e RNA podem ser eluídos em um pequeno volume (11-30 mL) de tampão de eluição (PicoPure, Dispositivos Molecular) e armazenadas a -80 ° C até que esteja pronto para uso. Se desejar uma alíquota de 1 ml pode ser usado para avaliar a qualidade do RNA total em um Bioanalyzer 2100 (Agilent Technologies, Inc.).
Resultados representante
Laser microdissecção de captura (LCM) foi usado para isolar único, específico de classe ou múltiplos neurônios da Drosophila de larvas de terceiro estádio (Figura 1). LCM permite um alto grau de precisão e especificidade no isolamento de Drosophila da corpos celulares de neurônios (Figura 2a-c). Além disso, o RNA total purificado destas neurônios isolados da foi encontrado para ser de excelente qualidade, como indicado pela presença de 5.8S afiada, 18S e 28S ribossomal RNA picos quando analisado em um Agilent 2100 Bioanalyzer (Agilent Technologies, Inc.) (Figura 2d).
Para avaliar o enriquecimento neuronal específico de nossas células isoladas foi realizada quantitativa em tempo real transcrição reversa PCR (qRT-PCR), utilizando o gene marcador neuronal específica, elav. Para as análises qRT-PCR, foram calculados os níveis relativos de expressão elav no LCM microdissecado neurônios da expressão e esta normalizada para que do nosso controle endógeno (rp49) e relativamente ao RNA total isolado de larvas inteiro usando o método ΔΔCt 23. Essas análises revelaram mais de 2,5 vezes no enriquecimento dos níveis relativos de elav no LCM micro-dissecados amostras da neurônio, em comparação com animais inteiros (Figura 3).
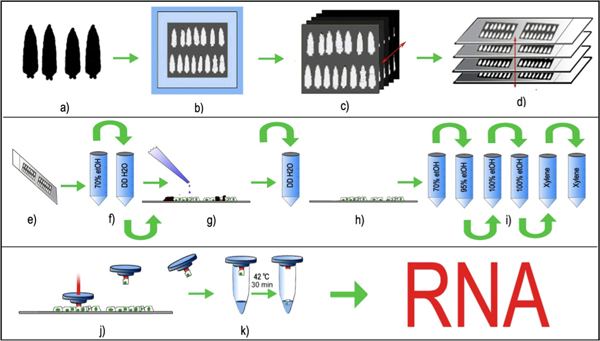
Figura 1: LCM de neurônios periféricos Drosophila. (A) Idade combinado larvas de terceiro estádio são selecionados, lavados e (b) incorporado em um cryomold com outubro e congeladas a -80 ° C, (c) 8μm cortes de tecido de série são criados utilizando um criostato padrão e (d) colocado uniformemente sobre lâminas de vidro limpo. As lâminas de vidro com as secções de tecido afixadas são armazenadas a -80 ° C antes da LCM processamento. (E, f) Imediatamente antes LCM, as secções de tecido são descongeladas e brevemente fixadas em etanol 70% seguido de enxágüe em breve DDH 2 O. (g) Os slides são brevemente incubadas com tripsina e lavadas com DDH 2 O para remover cutículas (preto) das seções larval. (h, i) seções do tecido sem cutícula larval são, então, desidratadas em gradiente de etanol e, finalmente, diafanizadas em xilol . (j) O cap LCM com um polímero termolábil é colocado na secção de tecido eo laser é pulsada sobre o corpo da célula selecionada fluorescente. O pulso de laser derrete o polímero e engole o corpo da célula selecionada. A tampa de polímero, juntamente com o corpo da célula capturada é levantado, e (k) tampão de extração de RNA é adicionada à célula. A célula capturado, juntamente com o tampão de extração de RNA é incubada a 42 ° C por 30 minutos e podem ser armazenadas a -80 ° C, ou processado diretamente para a purificação de RNA.
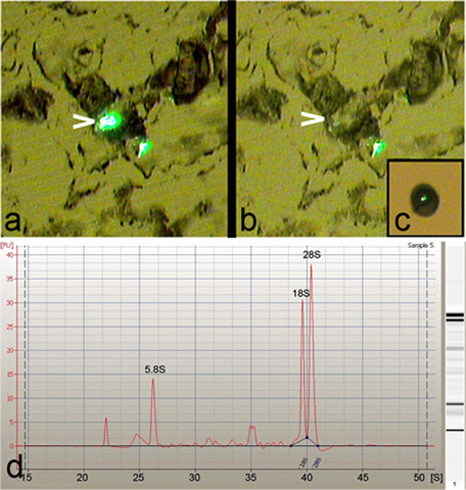
Figura 2: LCM facilita a captura de alta precisão de neurônios da. (A) Imagem representativa de um desidratados e tratados tripsina 8 secção de tecido antes da LCM micron desempenho, mostrando dois neurônios classe IV da rotulados com GFP pela ppk-GAL4, UASmCD8:: GFP tensão repórter. Note, um dos neurônios é destaque (seta) para a captura. (B) o corpo celular do neurônio destaque (seta) é limpa micro-dissecados com alta especificidade da secção de tecido. (C) Fim-de vista de uma única classe -IV da neurônio capturados na tampa da LCM. (d) Agilent 2100 Bioanalyzer electroferograma (Agilent Technologies, Inc.) de RNA total isolado de neurônios derivados da LCM-, mostrando qualidade RNA excelente como indicado pela presença de 5.8S afiada, 18S e 28S rRNA picos.
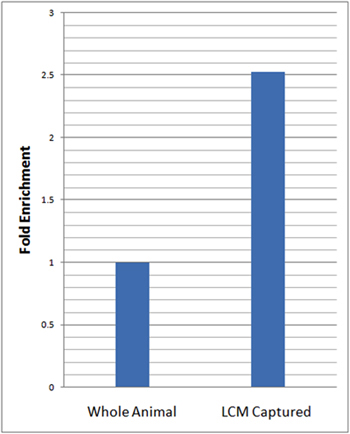
Figura 3:. QRT-PCR revela enriquecimento substancial de expressão neuronal gene marcador em neurônios da LCM capturado em relação ao animal inteiro qRT-PCR análises de neurônio-específica a expressão do gene marcador (elav) em LCM capturado da neurônios (21-7-GAL4, UAS-mCD8:: GFP) e animais inteiros em idade correspondente larvas de terceiro instar foi realizado em triplicata. Níveis relativos de expressão em elav LCM capturado da neurônios foram normalizados para o controle endógeno (rp49) e em relação a larvas inteiro usando o método ΔΔCt 23. A enriquecimento de 2,5 vezes nos níveis relativos de elav no LCM capturado amostras da neurônio foi observada em relação a animais inteiros.
Solução de problemas
Problema: RNA degradado, ou de baixa qualidade.
Garantir RNAse condição livre durante todo experimento. Tente reduzir quantidade de tempo gasto em LCM por slide a 30 minutos. Manter os slides e as amostras em gelo seco, exceto ao realizar LCM. Evitar o descongelamento das secções de tecido, uma vez que são cortadas.
Problema: A maioria das células são perdidos a partir do slide durante a tripsina tratamento (etapa 17-18).
Tente reduzir o tempo de tratamento de tripsina. Tente reduzir a concentração de tripsina.
Problema: Presença de cutícula e outros restos de tecido não-específicos no polímero cap.
Tente remover os escombros do tecido borrando a superfície do polímero com o lado brega de uma nota adesiva 22.
Problema: a eficiência LCM Low.
Tente aumentar o tempo de incubação em etanol 100% e xilenos. Reduzir a umidade do quarto usando desumidificadores.
Access restricted. Please log in or start a trial to view this content.
Discussão
O protocolo aqui apresentado descreve o nosso método otimizado para o isolamento de neurônios periféricos Drosophila via LCM. Embora este protocolo LCM foi projetado para o isolamento específico de único, específico de classe ou múltiplos neurônios da Drosophila a partir da fase de terceiro instar larval de desenvolvimento, pequenas modificações do protocolo pode ser facilmente adaptado para a captura de outros tipos de células Drosophila desenvolvimento de todos os estágios usando...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Agradecemos a drs. Yuh-Nung Jan e Wes Grueber para a prestação de stocks voar utilizados neste estudo, e Virginia Espina, Dr. Emanuel Petricoin e Dr. Lance Liotta para assistência com LCM. Os autores agradecem o F. Thomas e Kate Miller Jeffress Memorial Trust para apoio a esta pesquisa (DNC) e George Mason University Provost Escritório s (EPRI).
Access restricted. Please log in or start a trial to view this content.
Materiais
Equipamento:
- Criostato
- 50 tubo cônico ml para a fixação de slide, lavagem de tratamento, tripsina e etanol / xileno desidratação
- -80 ° C freezer
- Incubadora
- PixCell IIe Instrumento LCM com Fluor 300 óptica de epifluorescência otimizado para EGFP (Molecular Devices-Molecular Devices)
Referências
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Parrish, J. Z., Emoto, K., Kim,, Jan, Y. N. Mechanisms that regulate establishment, maintenance, and remodeling of dendritic fields. Annu. Rev. Neurosci. 30, 399-423 (2007).
- Wang, X., Starz-Gaiano, M., Bridges, T., Montell, D. Purification of specific cell populations from Drosophila tissues by magnetic bead sorting, for use in gene expression profiling. Nature Protocols. , (2008).
- Iyer, E. P. R., Iyer, S. C., Sulkowski, M. J., Cox, D. N. Isolation and purification of Drosophila peripheral neurons by magnetic bead sorting. J Vis Exp. 34, 2912-2917 (2004).
- Tirouvanziam, R., Davidson, C. J., Lipsick, J. S., Herzenberg, L. A., Tirouvanziam, R., Tirouvanziam, R. Fluorescence-activated cell sorting (FACS) of Drosophila hemocytes reveals important functional similarities to mammalian leukocytes. Proc. Natl. Acad. Sci. 101, 2912-2917 (2004).
- Shigenobu, S., Arita, K., Kitadate, Y., Noda, C., Kobayashi, S. Isolation of germline cells from Drosophila embryos by flow cytometry. Dev. Growth Differ. 48, 49-57 (2006).
- Reeves, N., Posakony, J. W. Genetic programs activated by proneural proteins in the developing Drosophila PNS. Dev. Cell. 8, 413-425 (2005).
- Jinushi-Nakao, S. Knot/Collier and Cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Yang, Z., Edenberg, H. J., Davis, R. L. Isolation of mRNA from specific tissues of Drosophila by mRNA tagging. Nucl. Acids Res. 33, (2005).
- Appay, V. Sensitive Gene Expression Profiling of Human T Cell Subsets Reveals Parallel Post-Thymic Differentiation for CD4+ and CD8+ Lineages. J. Immunol. 179, 7406-7414 (2007).
- Ginzinger, D. G. Gene quantification using real-time quantitative PCR: An emerging technology hits the mainstream. Exp. Hematol. 30, 503-512 (2002).
- Keays, K. M., Owens, G. P., Ritchie, A. M., Gilden, D. H., Burgoon, M. P. Laser capture microdissection and single-cell RT-PCR without RNA purification. J. Immunol. Methods. 302, 90-98 (2005).
- Volgin, D. V., Swan, J., Kubin, L. Single-cell RT-PCR gene expression profiling of acutely dissociated and immunocytochemically identified central neurons. J. Neurosci. Methods. 136, 229-236 (2004).
- Emmert-Buck, M. R. Laser capture microdissection. Science. 274, 998-1001 (1996).
- Xiao, W. Gene expression profiling in embryonic mouse lenses. Mol. Vis. 12, 1692-1698 (2006).
- Scharschmidt, T. Analysis of human osteoarthritic connective tissue by laser capture microdissection and QRT-PCR. Connect. Tissue Res. 48, 316-323 (2007).
- Spletter, M. L. regulates Drosophila olfactory projection neuron identity and targeting specificity. Neural Dev. 2, 14-14 (2007).
- Hoopfer, E. D., Penton, A., Watts, R. J., Luo, L. Genomic analysis of Drosophila neuronal remodeling: a role for the RNA-binding protein Boule as a negative regulator of axon pruning. J. Neurosci. 28, 6092-6103 (2008).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. USA. 104, 5199-5204 (2007).
- Espina, V. Laser capture microdissection. Nat. Prot. 1, 586-603 (2006).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25, 402-408 (2001).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados