Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Лазерная Захват микродиссекции Drosophila Периферийные Нейроны
В этой статье
Резюме
В этом видео-работе предлагается метод выделения одной или нескольких Drosophila Да нейроны от третьего возраста личинок через ИК-захвата (ИК) класса лазерной Захват микродиссекция (LCM). РНК получена из изолированных нейронов могут быть легко использованы для последующих применений, включая QRT-PCR или микрочипов анализа.
Аннотация
Дендритные разветвление (да) нейронов дрозофилы периферической нервной системы (ПНС) обеспечивают отличную модель системы, в которой для расследования молекулярные механизмы, лежащие класса конкретных дендритов морфогенеза 1,2. Для облегчения молекулярный анализ класса конкретных да нейрона развития, жизненно важно, чтобы получить эти клетки в чистое населения. Хотя спектр различных клетки, ткани и конкретных методов изоляции РНК существуют для клеток дрозофилы, в том числе магнитные бусины основанные очистки ячейки 3,4, флуоресцентная Активированный сортировки клеток (FACS) 5-8, и РНК, белок стратегий 9, ни одна из эти методы могут быть легко использованы для выделения одного или нескольких классов конкретных дрозофилы да нейронов с высокой степенью пространственной точностью. Лазерная Захват микродиссекция (LCM) стала чрезвычайно мощный инструмент, который может быть использован для выделения специфических типов клеток из ткани участки с высокой степенью пространственного разрешения и точности. РНК получена из изолированных клеток могут быть использованы для анализа в том числе QRT-PCR и микрочипов профилирование экспрессии в течение определенного типа клеток 10-16. На сегодняшний день, НОК не была широко применяются в анализе тканей и клеток дрозофилы 17,18, в том числе да нейронов на третьем личиночного возраста стадии развития.
Здесь мы представляем наш оптимизированный протокол для изоляции нейронов дрозофилы да использованием инфракрасного (ИК) класс LCM. Этот метод позволяет захватывать одиночных, классовые или нескольких да нейроны с высокой специфичностью и пространственным разрешением. Возраст соответствием третьего возраста личинок выражения UAS-mCD8:: GFP 19 трансгенов, находящихся под контролем либо класс IV-да-нейрон конкретных ППК-GAL4 20 водителя или пан-да-нейрон конкретных 21-7-21 GAL4 водитель были использованы для этих экспериментов. РНК получена из изолированных нейронов, да очень высокого качества и могут быть непосредственно использованы для последующих применений, включая QRT-PCR или микрочипов анализа. Кроме того, этот протокол LCM могут быть легко приспособлены для захвата другой клетки дрозофилы типов различных этапах развития зависит от типа клеток конкретных, GAL4 управляемой выражение структуры GFP.
протокол
Общие замечания по НОК дрозофилы периферических нейронов
Позвольте от 6 часов до недели или дольше для LCM в зависимости от типа ткани и количества клеток требуется.
Все процедуры проводятся в строго РНКазы без условий следующие стандартные процедуры. Личинки выражения либо 21-7-GAL4, UAS-mCD8:: GFP или ППК-GAL4, UAS-mCD8:: GFP линий трансгенных репортера были использованы для этих экспериментов.
1. Подготовка личинок
- Сбор 30-40 соответствующего возраста личинок третьего возраста и мыть их в DDH 2 O следует краткое полосканий в РНКазы Гости (Sigma-Aldrich), а последней промывки в DDH 2 O, чтобы удалить РНКазы Away. Вика излишки DDH 2 O полностью с чистой Kimwipe перед вложением личинок в октябре
- Возьмите чистую форму вложения тканей и слой его тонким (1,5-2мм) слой октября, как раз достаточно, чтобы покрыть одним слоем личинок.
- До вложение личинки, если это необходимо, прохладном октября до 0 ° С в формах ткани вложение. Сделайте это путем размещения плесень содержащие октября на кусок льда. Это поможет уменьшить личиночной движения во время вложение процесса.
- Место чистой личинок на предварительно охлажденные октября и расположить их параллельно друг другу. Как только личинки были устроены, медленно заполнить форму с октября, не нарушая личиночной договоренности. Привязка заморозить форму, разместив его на сухой блок льда. [Важнейший шаг:. Оснастку заморозить личинок мгновенно уменьшить движение] Этот метод позволит личинки находиться в одной плоскости, увеличивая количество клеток доступны в разделе для захвата.
Если это необходимо для сохранения тканей для выявления морфологии клетки интерес, или, если ожидаемое число клеток на раздел признана удовлетворительной, то перейдем непосредственно к шагу 11.
Либо, если клетки помечены конкретно и может быть отождествлен с легко идентифицировать маркер, таких как GFP и RFP, но количество клеток в каждой секции находится на низком уровне, то шаги 5-10 может быть полезна для увеличения числа доступных ячеек для захвата в разделе. Эти дополнительные шаги и должны рассматриваться только в случае необходимости, как способ увеличения числа нейронов да доступна для LCM на секцию, когда другие методы не в состоянии обеспечить благоприятные результаты. [Предостережение: Этот метод может нарушить общую морфологию тканей и делают ткань идентификации на основе конкретных пространственное положение очень трудно.]
- Вымойте 50-70 личинок третьего возраста, как описано в шаге 1. Место личинок в 1,5 мл микроцентрифужную пробирку, содержащую 500 мкл РНКазы свободной 1X PBS.
- Dounce личинки использованием полипропилена пестиком (США Scientific), с 6-7 медленных мощных ударов.
- Центрифуга решение на 16 000 (х) г в течение 5-10 секунд (пока личиночной кутикулы осесть на дно микроцентрифужную трубка]. Удалите супернатант. Гранулы должны в первую очередь состоят из личиночной кутикулы которой ПНС, в том числе да нейронов , тесно привязаны.
- Вымойте кутикулы гранулы 2-3 раза в 1X PBS и ресуспендируют осадок в 500 мкл 1X PBS. Спиновые решение на 16 000 (х) д в течение 1 минуты, чтобы сформировать компактный шарик. Аспирируйте супернатант полностью с помощью тонкой пипетки Пастера.
- Осторожно выньте шарик из микроцентрифужную трубки с помощью чистой лопаточки и фитиль излишки PBS, используя чистую ткань Kimwipe. [Примечание: Важно держать шарик как можно компактнее увеличить выход ячейки]. Место компактного кутикулы гранул на пластиковые формы, содержащей тонкий слой октября (1 мм приблизительно).
- Аккуратно распространено гранул в тонкой круговой области. Заполните форму с октября, и заморозить ткань, как описано в шаге 4.
- Использование криостат, разрезать на замороженных срезах толщиной 5-8 мкм на равнине, помечены, незаряженные, РНКазы свободной слайды микроскопом стекла. [Важнейший шаг: Должность срезах тканей недалеко от центра слайда.]
- Магазин слайды прямо на сухом льду или при температуре -80 ° С в чистой слайд-поле вплоть до момента его микродиссекции. Выполните LCM предпочтительно в течение недели после перерезки ткани.
ПАУЗА ТОЧКА
2. Обезвоживание и кутикулы Удаление из замороженных личинок Разделы
[Важнейший шаг: Все решения для обезвоживания должны быть готовы свежие перед каждым LCM сессии. Полное обезвоживание замороженных личиночной разделах ткани имеет важное значение для достижения оптимальной эффективности микродиссекции]
- Удалить слайды содержащие замороженных личиночной разделах ткани -80 ° C морозильника и поместить их в сухом льду.
- Удалить один слайд из сухого льда и сразу же поместить его непосредственнов 50 мл коническую трубку, наполненную 70% этанола фиксатор, а затем прополоскать в короткие РНКазы свободной DDH 2 O в соответствии с рекомендуемыми раз представлены в таблице 1.
- Наличие личиночной кутикулы в замороженных срезах может привести к снижению эффективности улавливания, препятствуя эффективной LCM колпачок-клеточной контакт, который может привести к неспецифическим захвата. При необходимости проводят следующие шаги (4-5), чтобы очистить от кутикулы срезах тканей.
- Аккуратно пипетки 50 мкл 2,5% трипсина непосредственно на срезах тканей и инкубировать в течение 5-30 секунд при комнатной температуре. [Важнейший шаг: Этот шаг может потребовать оптимизации. Инкубационный период зависит от ткани, которая будет микродиссекции и раздел толщины. Более инкубации может очистить все, включая клетки интереса, а короткий инкубационный может быть недостаточно для удаления кутикулы]
- Промыть разделах кратко в 50 мл коническую трубку с РНКазы без DDH 2 O, чтобы удалить трипсина, и свободно придерживаться фрагменты кутикулы.
- Dip слайды последовательно в каждом из оставшихся этанола и ксилола решения рекомендуется раза (табл. 1) завершить процесс обезвоживания.
- После обезвоживания градиент, слайды, кратко сушат под мягкий поток воздуха 60-120 секунд при комнатной температуре до выполнения LCM. [Предостережение: Сухой ксилол полностью из ткани разделов перед выполнением LCM. Ксилол, как известно, растворяет LCM крышка полимера в результате отказа микродиссекции].
| 70% этанола (Fixative) | 3-10 секунд |
| DDH 2 O | 5-10 секунд |
| 2,5% трипсина Инкубационный | 5-30 секунд |
| DDH 2 O | 5-10 секунд |
| 70% этанола | 60 секунд |
| 95% этанола | 60 секунд |
| 100% этанола | 120 секунд |
| 100% этанола | 120 секунд |
| 100% Ксилол | 120 секунд |
| 100% Ксилол | 120 секунд |
| Воздух сухой мягкий воздушный поток | 60-120 секунд |
Таблица 1: Рекомендуемая процедура LCM обезвоживание замороженных личиночной разделах ткани.
3. Лазерная Захват микродиссекция
PixCell IIe LCM инструмент, оснащенный Fluor 300 epifluorescence оптика оптимизирована для EGFP был использован для выполнения LCM.
[Важнейший шаг: Если возможно, выполнять микродиссекции в контролируемой влажностью комнату, чтобы предотвратить любое сокращение микродиссекции эффективность из-за повышенной влажности. Влажности помещения является одним из важнейших факторов, влияющих на микродиссекции эффективности. Низкая влажность может привести к комнате увеличилась статического цепляться в результате неспецифического захвата, в то время как высокая влажность комнате может привести к низкой эффективности микродиссекции. Мы достигли оптимальной эффективности LCM между 25-50% относительной влажности.]
- Включите питание для микроскопа и ящик управления лазером.
- Нагрузка держатель CapSure крышки сборки с HS LCM колпачков (Molecular Devices): Два картриджа крышек LCM может быть загружен в одно время.
- Открытое программное обеспечение устройств молекулярной и введите эксперимент подробную информацию, включая номер слайда и номер Cap много.
- Загрузите новый HS LCM крышку с картриджа на PixCell IIe LCM инструмент и расположите его правильно по отношению к джойстик для обеспечения надлежащего позиционировании крышки по отношению к захвату территории.
- Место стекло микроскопа содержащие свеже обезвоженной личиночной разделах ткани на столике микроскопа для микродиссекции.
- Найдите флуоресцентно меченых клеток использовании окуляров или экране компьютера. Из-за высокой специфичности ППК-GAL4, UAS-mCD8:: GFP трансгенные репортер линии, класс IV-да-нейронов могут быть легко идентифицированы GFP флуоресценции.
- Тема ткани LCM использованием CapSure HS LCM шапки [для подробный набор инструкций для настройки инструмента, фокусировка лазера и выполнение LCM см. ссылку 22].
- Настройка "Power" и "Время" лазерного импульса параметров для достижения точной расплавленный полимер пятно, размер которого соответствует выбранному размер пятна лазера. Настройте параметры для настройки размеров расплавленной области полимера. Следующие параметры были использованы для microdissecting один класс IV-да-нейронов: диаметр пятна 7,5 мкм, лазерная прочность 30-50 мВт, лазерное время и 2-4 мс и 1-2 сгорячие товары в камере были использованы. [Важнейший шаг: лазерные параметры, необходимые для правильного пятна может меняться в зависимости от толщины ткани и условий влажности в помещении. Настройка "Power" и "Время" настройки для достижения необходимых расплавленный полимер месте размер microdissecting одной или нескольких клеток.]
- Для обеспечения максимальной специфичности, microdissect клетки с минимальным перекрытием и сильный флуоресценции. Каждая крышка способна захватывать многочисленных органов клетки. [Важнейший шаг: Чтобы избежать деградации РНК, ограничить общее время анализа, включая обезвоживание и микродиссекции до менее чем 45 минут]
- После того как все клетки интересом были захвачены в плен, поднимите HS LCM шапка с микродиссекции клетки и положил ее на чистую слайд, чтобы подтвердить наличие захваченных клеток и осмотрите крышку на наличие нежелательных клеток и мусора.
4. РНК изоляции от LCM клеток, полученных из
- Закрепите заглушку содержащие микродиссекции клетки ExtracSure (Molecular Devices) устройства. Добавить 12μl РНК буфера для экстракции (PicoPure, Molecular Devices), чтобы крышка поверхности, содержащей клетки и подключить перевернутой тонкостенных реакционную трубку (GeneAmp, Applied Biosystems) для ExtracSure устройства. Место сборки на выравнивание лоток (Molecular Devices) и покрыть ее инкубационный блок (Molecular Devices), предварительно нагретой до 42 ° С внутри инкубатора.
- После 30-минутной инкубации, центрифуги пробирки, содержащие экстракты на 800 (х) г в течение 2 минут. Закрыть труб и хранения клеточных экстрактов при -80 ° С до готовности для очистки РНК.
ПАУЗА ТОЧКА
- Извлечение и столбцов очистить РНК в соответствии с PicoPure (Molecular Devices) РНК инструкции добычи комплект. ДНКазы лечение не является обязательным, и может быть выполнена на колонку во время очистки РНК по мере необходимости. При необходимости, несколько образцов LCM могут быть объединены вместе во время очистки в одном столбце увеличить конечный выход РНК и может быть элюировали в небольшом объеме (11-30 мкл) элюции буфера (PicoPure, Molecular Devices) и хранили при -80 ° С до готовности к использованию. При желании 1 мкл могут быть использованы для оценки общего качества РНК на Bioanalyzer 2100 (Agilent Technologies, Inc.)
Представитель Результаты
Лазерная захвата микродиссекции (НОК) был использован для выделения одного, конкретного класса или нескольких дрозофилы да нейроны от третьего возраста личинок (рис. 1). LCM позволяет высокой степенью точности и конкретности в изоляции дрозофилы да клеточных тел нейронов (рис. 2а-в). Более того, общая РНК очищали от этих изолированных нейронов да оказался отличного качества, как указано наличие резких 5.8S, 18S и 28S рибосомных РНК пики, когда анализируются на Agilent 2100 Bioanalyzer (Agilent Technologies, Inc) (рис. 2d).
Для оценки нейронов конкретных обогащению наших изолированных клеток мы провели в режиме реального времени количественные обратной транскрипции ПЦР (QRT-PCR) с использованием нейронных ген-специфического маркера, elav. Для QRT-PCR анализ, мы рассчитали относительные уровни elav выражение в LCM микродиссекции да нейронов и нормированных это выражение, что и наши эндогенного контроля (rp49) и по отношению к общей РНК, выделенной из целого личинки использованием метода ΔΔCt 23. Эти анализы показали более 2,5 кратное обогащение в относительных уровней elav в LCM микро-расчлененный да нейрона образцов по сравнению с целых животных (рис. 3).
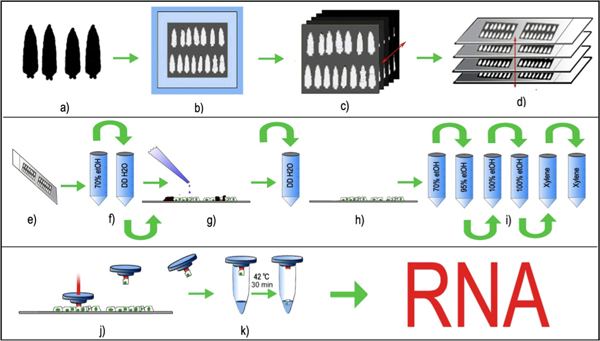
Рисунок 1: НОК дрозофилы нейронах периферической. () Возраст соответствует третьему возраста личинки выбираются, промывают и (б), встроенные в cryomold с октября и замораживали при -80 ° С, (с) 8 мкм серийных срезов ткани создаются с помощью стандартного криостата и (г), размещенные равномерно на чистые стеклянные пластинки. Стеклах с прикреплены тканевые срезы хранятся при температуре -80 ° C до LCM обработки. (Д, е) Непосредственно перед LCM, срезах тканей размораживают и кратко зафиксировано в 70% этанола их краткое промыть в DDH 2 O. (г) слайды кратко инкубировали с трипсином и промывали DDH 2 O для удаления кутикулы (черный) от личиночной разделов. (Л, я) срезах тканей без личиночной кутикулы затем далее обезвоживали в этаноле градиента и окончательно прояснилось в ксилоле . (к) LCM шапка с термолабильных полимера помещают на срез ткани и импульсного лазера на выбранный люминесцентные тела клетки. Лазерного импульса расплава полимера и охватывает выбранное тело клетки. Крышка полимера, наряду с захваченного тела клетки поднимается, и (к) РНК буфера для экстракции добавляется в ячейку. Захватили клетки, наряду с буфером добычи РНК инкубировали при 42 ° С в течение 30 минут и может быть либо хранили при -80 ° С, или непосредственно обработаны для очистки РНК.
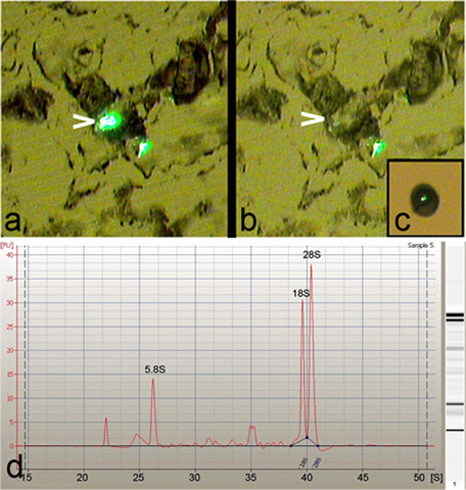
Рисунок 2: LCM обеспечивает высокую точность захвата нейронов да. (А) представитель образ обезвоженной и трипсина лечение 8 микрон срез ткани до выполнения LCM, показав два класса-IV да нейронов помечены GFP на ППК-GAL4, UASmCD8:: GFP репортер напряжения. Обратите внимание, что одним из нейронов выделена (стрелки) для захвата. (Б) Сотовые тело подчеркнул нейрона (стрелки) является чисто микро-расчлененный с высокой специфичностью из ткани разделе. (С) End-на зрения один класс -IV-да-нейрона, снятые на крышку LCM. (г) Agilent 2100 Bioanalyzer (Agilent Technologies, Inc) electropherogram от общего числа РНК, выделенной из LCM полученных нейронов да, показывая отличное качество РНК на что указывает наличие резких 5.8S, 18S и 28S рРНК пиков.
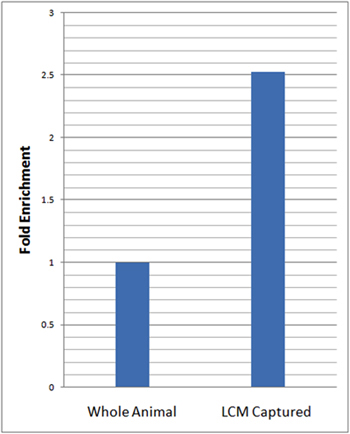
Рисунок 3:. QRT-PCR показывает существенное обогащение нейрональной экспрессии маркерного гена в LCM захватили да нейронов относительно целого животного QRT-PCR анализ нейрон-специфического маркера экспрессии генов (elav), в LCM захватили да нейронов (21-7-GAL4, UAS-mCD8:: GFP) и целых животных в соответствующей возрастной третьего возраста личинок проводили в трех экземплярах. Относительные уровни elav выражение в LCM захватили да нейроны были нормированы на эндогенного контроля (rp49) и относительно целого личинки использованием метода ΔΔCt 23. В 2,5 раза по обогащению в относительных уровней elav в LCM захватили да нейрона образцов наблюдалась относительно целых животных.
Поиск неисправностей
Проблема: РНК деградировали, или низкого качества.
Обеспечить свободный РНКазы состоянии в течение эксперимента. Попробуйте уменьшить количество времени, потраченное на LCM на слайд до 30 минут. Держите слайдов и образцов в сухом льду исключением случаев, когда выполнение LCM. Избегайте оттаивания срезах тканей, как только они вырезаются.
Проблема: Большинство клеток теряются из слайдов во время лечения трипсина (шаг 17-18).
Попробуйте уменьшить время обработки трипсином. Попробуйте уменьшить концентрацию трипсина.
Проблема: Наличие кутикулы и другие неспецифические ткани мусора на крышку полимера.
Попробуйте удалить ткань мусора на промокательной поверхности полимера с липкой стороне клей примечание 22.
Проблема: Низкая эффективность LCM.
Попробуйте увеличить время инкубации в 100% этанола и ксилолы. Сокращение влажности в помещении использованием осушителей.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Протокол, представленные здесь описывает наш оптимизированный метод изоляции дрозофилы периферические нейроны через LCM. Хотя этот протокол LCM был разработан для конкретной изоляции одного, конкретного класса или нескольких нейронов дрозофилы да от третьего возраста личино?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Мы благодарим доктора. Yuh-Нунг Ян и Уэс Grueber за предоставление летать запасы, используемые в этом исследовании, и Вирджиния Эспина, доктор Эмануэль Petricoin и доктор Ланс Лиотта за помощью в НОК. Авторы признают, Томас Ф. и Кейт Миллер Джеффресс Мемориального Фонда за поддержку этого исследования (РСК) и Университета Джорджа Мейсона проректор Офис (EPRI).
Access restricted. Please log in or start a trial to view this content.
Материалы
Оборудование:
- Криостат
- 50 мл коническую трубку для слайд фиксации, промывки, трипсина лечения и этанола / ксилола обезвоживания
- -80 ° С морозильной камерой
- Инкубатор
- PixCell IIe LCM Прибор с Fluor 300 epifluorescence оптика оптимизирована для EGFP (Molecular Devices-Molecular Devices)
Ссылки
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Parrish, J. Z., Emoto, K., Kim,, Jan, Y. N. Mechanisms that regulate establishment, maintenance, and remodeling of dendritic fields. Annu. Rev. Neurosci. 30, 399-423 (2007).
- Wang, X., Starz-Gaiano, M., Bridges, T., Montell, D. Purification of specific cell populations from Drosophila tissues by magnetic bead sorting, for use in gene expression profiling. Nature Protocols. , (2008).
- Iyer, E. P. R., Iyer, S. C., Sulkowski, M. J., Cox, D. N. Isolation and purification of Drosophila peripheral neurons by magnetic bead sorting. J Vis Exp. 34, 2912-2917 (2004).
- Tirouvanziam, R., Davidson, C. J., Lipsick, J. S., Herzenberg, L. A., Tirouvanziam, R., Tirouvanziam, R. Fluorescence-activated cell sorting (FACS) of Drosophila hemocytes reveals important functional similarities to mammalian leukocytes. Proc. Natl. Acad. Sci. 101, 2912-2917 (2004).
- Shigenobu, S., Arita, K., Kitadate, Y., Noda, C., Kobayashi, S. Isolation of germline cells from Drosophila embryos by flow cytometry. Dev. Growth Differ. 48, 49-57 (2006).
- Reeves, N., Posakony, J. W. Genetic programs activated by proneural proteins in the developing Drosophila PNS. Dev. Cell. 8, 413-425 (2005).
- Jinushi-Nakao, S. Knot/Collier and Cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Yang, Z., Edenberg, H. J., Davis, R. L. Isolation of mRNA from specific tissues of Drosophila by mRNA tagging. Nucl. Acids Res. 33, (2005).
- Appay, V. Sensitive Gene Expression Profiling of Human T Cell Subsets Reveals Parallel Post-Thymic Differentiation for CD4+ and CD8+ Lineages. J. Immunol. 179, 7406-7414 (2007).
- Ginzinger, D. G. Gene quantification using real-time quantitative PCR: An emerging technology hits the mainstream. Exp. Hematol. 30, 503-512 (2002).
- Keays, K. M., Owens, G. P., Ritchie, A. M., Gilden, D. H., Burgoon, M. P. Laser capture microdissection and single-cell RT-PCR without RNA purification. J. Immunol. Methods. 302, 90-98 (2005).
- Volgin, D. V., Swan, J., Kubin, L. Single-cell RT-PCR gene expression profiling of acutely dissociated and immunocytochemically identified central neurons. J. Neurosci. Methods. 136, 229-236 (2004).
- Emmert-Buck, M. R. Laser capture microdissection. Science. 274, 998-1001 (1996).
- Xiao, W. Gene expression profiling in embryonic mouse lenses. Mol. Vis. 12, 1692-1698 (2006).
- Scharschmidt, T. Analysis of human osteoarthritic connective tissue by laser capture microdissection and QRT-PCR. Connect. Tissue Res. 48, 316-323 (2007).
- Spletter, M. L. regulates Drosophila olfactory projection neuron identity and targeting specificity. Neural Dev. 2, 14-14 (2007).
- Hoopfer, E. D., Penton, A., Watts, R. J., Luo, L. Genomic analysis of Drosophila neuronal remodeling: a role for the RNA-binding protein Boule as a negative regulator of axon pruning. J. Neurosci. 28, 6092-6103 (2008).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. USA. 104, 5199-5204 (2007).
- Espina, V. Laser capture microdissection. Nat. Prot. 1, 586-603 (2006).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25, 402-408 (2001).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены