Method Article
Imagen de la posición vertical Drosophila Los embriones
En este artículo
Resumen
Aquí se presenta un protocolo de montaje para teñido Drosophila Embriones en una posición vertical que permite imágenes de secciones transversales mediante microscopía confocal.
Resumen
Varios conocidos gradientes morfogenéticos y los movimientos celulares se producen a lo largo del eje dorsal / ventral de la
Protocolo
1. Metodología de imágenes
- Derretir la glicerina gelatina en un baño de agua a 55 ° C grados durante 20-30 minutos hasta que se convierte en un líquido homogéneo. Remolino, pero no agitar el frasco para evitar la formación de burbujas.
- Mientras que la gelatina se derrite, aplique una fina capa de glicerina con una Kimwipe en un portaobjetos de vidrio limpio (opcional).
- Pipeta de 1 a 1,5 ml de glicerina derretido jalea con un P1000 corte punta de la pipeta en la superficie de la diapositiva para crear una primera capa fina. Pipeta con cuidado para evitar burbujas.
- Deje que la gelatina solidifique durante 5 minutos sobre una superficie horizontal, a continuación, colocar la placa a -20 ° C durante 5 minutos y proceder a la alineación del embrión. Otra forma es cubrir el portaobjetos con Saran Wrap y colocarlo a 4 ° C durante un máximo de 5 días.
- Pipeta una gota de embriones teñidos en 70% de glicerol / PBS u otro Antifade base de glicerol-medios de montaje (por ejemplo, o Slowfade Vectashield) en el lado de la cama de gelatina.
- Comenzar antes de la alineación de los embriones por separado a la transferencia de la caída de la superficie de la gelatina. Transferencia utilizando una aguja hipodérmica inclinada, con el lado inclinado como una cuchara.
- Alrededor de colocar los embriones a lo largo de 2 a 3 columnas. Si un embrión se queda atascado en la aguja, se revuelve en el desplegable que contiene los otros embriones para liberarlo. No pierdas el tiempo con cuidado la alineación en este momento. Deje algo de espacio entre las columnas.
- Alinear los embriones por deslizamiento en horizontal en el medio de gelatina con la ayuda de la aguja hipodérmica. Mientras desliza, orientar las cabezas y las colas en la misma dirección. Hacerlos paralelos entre sí a lo largo de la columna. Eliminar el exceso de glicerol PBS izquierda como un camino con un pedazo de Kimiwipe trenzado.
Nota: El exceso de glicerol hará que los embriones que se suelta encerrado dentro de gel, lo que resulta en la separación de las dos capas de gelatina, por lo que es difícil de cortar y montar. Por el contrario, la eliminación de glicerol demasiado se seca y se aplanan embriones. - Utilice una punta amarilla corte para esparcir una capa delgada de gel sobre los embriones (50-150 l, dependiendo de cuántos fueron alineados).
- Lugar de diapositivas en congelador a -20 ° C durante 10-20 minutos o almacenar a 4 ° C durante la noche. Asegúrese de que el gel está completamente rígido antes de cortar. De lo contrario, el bloque de embriones será muy difícil de extirpar. Los mejores resultados se obtienen para el corte al día siguiente.
- Bajo un microscopio de disección, utilice una hoja de afeitar para cortar completamente a través de la jalea en ambos lados de los embriones alineados. Mantenga la hoja de afeitar en un ángulo de 90 ° para realizar cortes rectos. Los cortes deben quedar muy cerca de los polos anterior y posterior de los embriones para evitar el exceso de gel que puede obstruir la imagen.
- Añadir 100-200 L de PBT frío (4 ° C, PBS 0,1% Tween 20) al lado de los recortes y cuidadosamente raspe la gelatina entre los embriones con una espátula.
Nota: El detergente en PBT ayuda a la eliminación de la jalea de la diapositiva sin dañar los embriones. - Usando una aguja, la transferencia del bloque de gelatina con embriones incrustado en un portaobjetos limpio para cortar más. Cortar los bloques más pequeños con embriones 5-7. Use PBT para moverse con facilidad alrededor de la manzana de gelatina. Por otra parte, colocar el bloque en una superficie de vidrio seco para dejar que se adhieren a los cristales, lo que crea más estabilidad, precisamente por el recorte de la jalea, si es necesario.
- Voltear vertical los embriones incrustados en la jalea con la ayuda de una cuchilla de afeitar y una aguja. Para la visualización al microscopio, proceder con cualquiera de los dos pasos siguientes, dependiendo del tipo de microscopio están siendo utilizados.
- Microscopio invertido: el lugar terminó bloques embrión en un cubreobjetos de largo, con embriones en una posición vertical. Asegúrese de que la parte del embrión con la menor cantidad de jalea estará en contacto más estrecho con el objetivo.
- Microscopio vertical: hacer dos pilas con cuatro n º 1 cubreobjetos pegados con pegamento que se utiliza como "apoyo" y colocar el bloque de embriones de glicerol en el medio de la "apoya". Puente de las pilas con un cubreobjetos de largo.
- Para el análisis confocal, comprobar la distancia de trabajo de los objetivos que se utilizarán para determinar si usted puede imaginar todo el camino a través del embrión o sólo parcialmente. Por ejemplo, D. embriones melanogaster han ~ 0,55 mm de longitud y puede ser enteramente imágenes utilizando un Zeiss 20x Plan-Apo o un objetivo de 40x LD Neo-Fluor. El siguiente sitio tiene información sobre los objetivos Zeiss disponible y te ofrece la opción de buscar objetivos, de acuerdo a las distancias de trabajo: https://www.micro-shop.zeiss.com/us/us_en/objektive.php
2. Resultados representante
Debido a que los embriones se mantienen intactas, este método puede ser usado para tomar mediciones precisas del tamaño del embrión y las distancias entre los patrones de expresión génica. En la Figura 1, se muestra una etapa de blastodermo embriones teñidos con la tinción nuclear con DAPI (azul), anti-proteína dorsal (rojo), el ARNm sog (amarillo) y ARNm sna (verde). Proces morfológicasses, como la invaginación del mesodermo (Figura 2A, B) y la migración de las células del mesodermo (Figura 3 y 4) también se pueden visualizar con este método. Z-posiciones diferentes a lo largo del eje DV se puede obtener al cambiar el plano focal, como se muestra en las figuras 2-4.
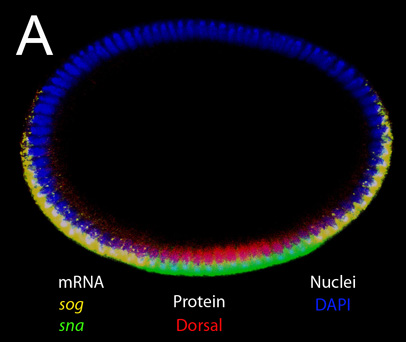
Figura 1. Vertical rebanada óptica de un embrión intacto en la etapa blastodermo. Doble tinción de ARNm y proteínas. MRNAs objetivo en las sondas in situ (SOG y SNA) y la proteína manchada por el anticuerpo primario (anti-dorsal) se indican en la figura. DAPI se utiliza para etiquetar los núcleos. Tenga en cuenta que la expresión de la SOG y la SNA se encuentran en el citoplasma apical, mientras que la expresión de la dorsal es de origen nuclear. Señales fuertes de las transcripciones sog nacientes que se encuentran en los núcleos también se puede ver en este aumento.
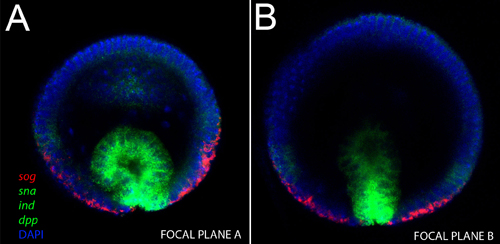
Figura 2. Imagen vertical de un embrión intacto gastrulating. Sondas de ARNm utilizados y sus respectivos colores se indican en la figura. A) Tenga en cuenta que en esta etapa, tres genes manchado con la misma fluor (SCN, sog y DPP, en verde), se expresan en dominios separados espacialmente. El mesodermo invaginación expresa SNA, la capa de neuroblast expresa ind y el ectodermo expresa DPP, mientras que la expresión sog todavía está presente en las regiones ventrales del sistema nervioso. B) En un plano más profundo confocal del embrión mismo, tomamos nota de la base de la invaginación del mesodermo sna expresa con fuerza, pero su región apical expresa los niveles más bajos.
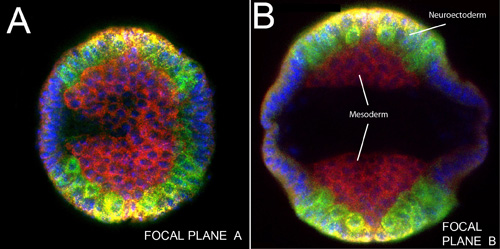
Figura 3. Imagen vertical de un embrión intacto con la banda de germen extendido sog ARN (amarillo);. Caracol, ind y mRNAs dpp (verde), la proteína dorsal (rojo). Los núcleos se tiñeron con DAPI (azul). A) del plano focal cerca de la cabeza del embrión. B) Otro plano focal en la región del tronco del embrión mismo. Tenga en cuenta la masa de las células del mesodermo lateral antes de la migración (en comparación con la Figura 4), situada cerca de la línea media ventral en ambos lados de un embrión de germen de banda extendida. Neuroblastos delaminación están marcados en verde (ind y SNA).
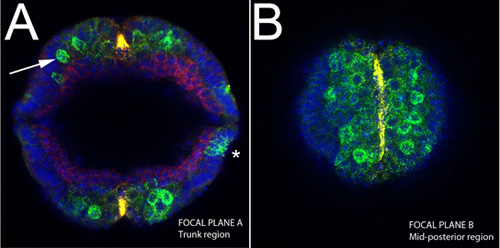
Figura 4. Imagen vertical de un embrión intacto durante la extensión de la banda de germen de sog ARN (amarillo);. Caracol, ind y mRNAs dpp (verde), la proteína dorsal (rojo). A) Nota de la neuroblastos delaminación del epitelio (flecha), teñido, tanto para ind y sna en esta etapa (verde). Tenga en cuenta también la expresión restringida de sog a la línea media ventral (amarillo). Expresión de dpp en este momento se puede ver en las caras laterales del embrión (asterisco). B) Sección óptica en el mismo embrión se muestra en A cerca del final de la longitud del embrión, que corresponde a mediados de la región posterior. Las células de la línea media ventral se tiñen para SOG.
Discusión
La toma de imágenes de sección transversal de los embriones de Drosophila puede ser un reto, ya que requiere ya sea una disección cuidadosa de la mano rebanadas 2 o el uso de los medios de comunicación integrados para el procesamiento de microtomo, que suele ser perjudicial para tinciones fluorescentes. Por otra parte, Z-pilas hechas en un microscopio confocal se puede utilizar para hacer la reconstrucción 3D de imágenes de corte transversal. Sin embargo, es mucho tiempo para hacer varias rebanadas delgadas confocal para una reconstrucción exacta en 3D y photobleaching se convierte en problemático. Otro motivo de preocupación cuando los embriones de imágenes que están montados longitudinalmente es la dispersión de la luz que se produce al llegar a más secciones del embrión, lo que también complica la toma de medidas precisas de las señales fluorescentes con el propósito de la cuantificación de los niveles de expresión de la proteína o ARNm 1. Incluso con un microscopio confocal de dos fotones, dispersión de la luz sigue siendo una preocupación debido a la opacidad del material de la yema en el centro del embrión, lo que hace que la selección de los medios de montaje para una transparencia óptima de la muestra a ser limitada.
Para evitar estos problemas, una nueva técnica llamada "final de" imágenes de embriones de posicionamiento vertical se ha desarrollado recientemente para la imagen en vivo y muestras fijas 4. En este trabajo, hemos desarrollado un nuevo protocolo para los embriones de montaje vertical que permite una preparación sencilla y visualización de embriones fijo o tejidos de cualquier tamaño y forma que se tiñen con múltiples sondas situ 3. Nuestro método consiste en utilizar un medio de montaje con consistencia gelatinosa que se utiliza para revestir los embriones alineados dentro de ella. Bloques de corte de este medio de montaje que contienen embriones incrustado se puede colocar en posición vertical antes de exponer en cualquier tipo de microscopio confocal.
Mediante la incorporación de los embriones en la gelatina y el posicionamiento verticalmente, que son capaces de tomar horizontal secciones transversales mediante microscopía confocal, en el cual las células a lo largo del eje dorsal-ventral del embrión se presentan simultáneamente. Esta es una mejora significativa para propósitos de cuantificación ya que los problemas de dispersión de luz y photobleaching de los tintes fluorescentes que se produce en la pila convencional Z-reconstrucción de embriones montado longitudinalmente se eliminan ahora. Por lo tanto, la cuantificación de los niveles de expresión del gen o la proteína a lo largo del eje dorsal-ventral es exacta, ya que las células ubicadas en contrario dorsal-ventral posiciones son imágenes al mismo tiempo y en el mismo confocal Z-posición. Además, el método descrito nos permite obtener una completa 2-D la imagen a través del eje dorsal-ventral de un embrión de 3-D sin necesidad de utilizar complejos métodos de cálculo se desenrolla para visualizar las células en diferentes posiciones a lo largo del eje DV 6.
Algunos de los pasos críticos incluyen la eliminación de exceso de glicerol después de alinear los embriones, para evitar la división entre las dos capas de gelatina. Sin embargo, si la muestra es muy deshidratada, la imagen resultante se deforme y tienen una morfología incorrecta. Además, si el medio de gelatina en todo el embrión se cortan en ángulo recto en lugar de, la imagen resultante puede parecer menos redondo y ovular más en forma, debido a una colocación incorrecta de los embriones en un ángulo de 90 grados. Por último, si la gelatina no se corta lo suficiente para que el embrión en los extremos anterior / posterior, no es posible obtener una imagen adecuada, porque la distancia de trabajo el objetivo sería utilizado principalmente para centrarse en la jalea y no del embrión.
Otro paso importante que puede ser necesario cuando la imagen a finales de embriones gastrulating es separar cuidadosamente las etapas de interés en el ámbito antes de la alineación de ellos. Por lo general, los embriones se clasifican de acuerdo a las características morfológicas que puede ser más fácil de reconocer cuando está en posición longitudinal.
Entre las modificaciones alternativas que se pueden hacer con este método es incluir un reactivo anti-fade (por ejemplo, p-fenilendiamina o PPD) en la segunda capa de gelatina para ayudar a proteger contra el photobleaching de los tintes fluorescentes.
Divulgaciones
Agradecimientos
Los autores están en deuda con Deborah Harris y MacKay Danielle. Apoyo a este trabajo fue proporcionado por el Departamento de Biología y la Facultad de Artes y Ciencias de la CWRU, y por el número de concesión del HHMI 52005866 para el apoyo de la educación universitaria en las ciencias biológicas.
Materiales
| Name | Company | Catalog Number | Comments |
| Glycerin Jelly mounting media | Electron Microscopy Sciences | 17998-10 | Contains low concentration of phenol as preservative and should be used in hood or in well ventilated area. Recipe for making your own media is described in Zander, 1997. |
| Zeiss LSM 700 Confocal | Carl Zeiss, Inc. | The following objectives were used: Plan-Apo 20x 0.8 M27 (WD 0.55mm); EC Plan-Neofluar 40x 1.3 oil (WD 0.21mm); LD Plan-Neofluar 0.6 Korr 40X (WD 2.9mm). | |
| Phosphate buffered saline with 0.1% Tween 20 (PBT) | |||
| Glass microscope slides | Fisher Scientific | 12-544-7 | |
| Glass cover slips | Electron Microscopy Sciences | 72204-02 | Size 1 ½ (specific for the objectives used in this work). |
| Glass cover slips (for making supports) | Fisher Scientific | 12-544-10 | Use four coverslips glued with superglue. |
| Dissection microscope | M5 Wild Heerbrugg Wild Makroskop | M420 | |
| Razor blade | Steel back single edge industrial blades | ||
| Spatula | Fisher Scientific | 21-401-10 | |
| Hypodermic needles | Fisher Scientific | 1482610 | 26 Gauge |
| Pipettes | Labnet International |
Referencias
- Ay, A., Fakhouri, W. D., Chiu, C., Arnosti, D. N. Image processing and analysis for quantifying gene expression from early Drosophila embryos. Tissue Engineering. 14, 1517-1526 (2008).
- Grβhans, J., Wieschaus, E. A genetic link between morphogenesis and cell division during formation of the ventral furrow in Drosophila. Cell. 101, 523-531 (2000).
- Kosman, D., Mizutani, C. M., Lemons, D., Cox, W. G., McGinnis, W., Bier, E. Multiplex detection of RNA expression in Drosophila embryos. Science. 305, 846-846 (2004).
- Witzberger, M. M., Fitzpatrick, J. A. J., Crowley, J. C., Minden, J. S. End-on imaging: a new perspective on dorsoventral development in Drosophila embryos. Developmental Dynamics. 237, 3252-3259 (2008).
- Zander, R. H. On mounting delicate bryophytes in glycerol. The Bryologist. 100, 380-382 (1997).
- Liberman, L. M., Reeves, G. T., Stathopoulos, A. Quantitative imaging of the Dorsal nuclear gradient reveals limitations to threshold-dependent patterning in Drosophila. Proc Natl Acad Sci U S A. 106 (52), 22317-2222 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados