Method Article
Вертикальная съемка Drosophila Эмбрионы
В этой статье
Резюме
Здесь мы представляем монтажа протокол для окрашенных Drosophila Эмбрионов в вертикальном положении, что позволяет изображения сечений с помощью конфокальной микроскопии.
Аннотация
Несколько известных морфогенетические градиенты и сотовых движения происходят вдоль спинной / вентральной оси
протокол
1. Методология изображений
- Растопить желе глицерина в 55 ° C степень водяной бане в течение 20-30 минут, пока она не станет однородной жидкости. Swirl, но не трясите бутылку, чтобы избежать образования пузырьков.
- В то время как желе расплавов, нанесите тонкий слой глицерина использованием Kimwipe на чистую предметное стекло (опционально).
- Внесите 1 до 1,5 мл расплавленного глицерин желе с помощью пипетки сократить P1000 наконечник на поверхность слайд, чтобы создать тонкий первый слой. Внесите тщательно, чтобы избежать пузырей.
- Пусть желе укрепить в течение 5 мин на горизонтальной поверхности, затем поместить слайд при температуре -20 ° С в течение 5 мин и приступить к эмбрион выравнивания. Кроме того, крышка слайд с Саран Wrap и поместить его на 4 ° С в течение 5 дней.
- Внесите небольшую каплю окрашенных эмбрионов в 70% глицерине / PBS или другими antifade на основе глицерина монтажа средств массовой информации (например, Slowfade или Vectashield) на стороне кровати желе.
- Начало предварительно выравнивания эмбрионов индивидуально переводя их из выпадающего на поверхность желе. Передача их с помощью наклонной иглы для подкожных инъекций, использованием наклонной стороне ложки.
- Грубо место эмбрионов вдоль 2 до 3 колонки. Если эмбрион застревает в иглу, размешайте его в раскрывающемся содержащие других эмбрионов, чтобы освободить его. Не тратьте время тщательно выравнивая их в этой точке. Оставьте немного пространства между колоннами.
- Совместите эмбрионов, сдвинув их по горизонтали на среду желе с помощью шприца. Хотя раздвижные, ориентироваться головы и хвосты в том же направлении. Сделать их параллельно друг другу вдоль колонны. Удалите излишки глицерина PBS слева, как тропа с кусок витой Kimiwipe.
Примечание: Превышение глицерина вызовет эмбрионы должны быть свободно заключенная в гель, в результате разделения двух слоев желе, что затрудняет резать и монтировать. И наоборот, удаляя слишком много глицерина будет сухой и придавить эмбрионов. - Используйте сократить желтый наконечник распространяться тонкий слой желе над эмбрионами (50-150 мкл, в зависимости от того, сколько были приведены в соответствие).
- Место слайда в морозильной камере -20 ° С в течение 10-20 мин или хранить его при температуре 4 ° С в течение ночи. Убедитесь в том, желе полностью жесткой перед сокращением. В противном случае блок эмбрионов будет очень трудно акциза. Наилучшие результаты для резки получены на следующий день.
- Под рассекает области, следует использовать лезвие, чтобы вырезать полностью через желе с обеих сторон выравниваются эмбрионов. Держите лезвие на 90 градусов, чтобы сделать прямые пропилы. Сокращения должны быть сделаны в непосредственной близости от переднего и заднего полюса эмбрионов, чтобы избежать избыточного желе, которые могут препятствовать визуализации.
- Добавить 100-200 мкл холодного PBT (4 ° С, PBS, 0,1% Твин-20) рядом с порезами и аккуратно соскоблить желе между эмбрионами с помощью шпателя.
Примечание: моющее средство в PBT помогает удаление желе из слайдов без повреждения эмбрионов. - Использование иглу, передача блока желе со встроенным эмбрионов на чистую слайд для дальнейшей резки. Вырезать мелкие блоки с 5-7 эмбрионов. Используйте PBT легко перемещать вокруг блока желе. Кроме того, место блока на сухую поверхность стекла, чтобы позволить этому придают стекла, что создает большую устойчивость именно для отделки желе, если это необходимо.
- Отразить вертикально эмбрионов встроенные в желе с помощью лезвия бритвы и иглы. Для визуализации под микроскопом, осуществляться на основе либо один из двух шагов ниже, в зависимости от типа микроскоп стенда используется.
- Инвертированный микроскоп: место готовых эмбриона блоков на долгое покровное, с эмбрионами в вертикальном положении. Убедитесь, что сторона эмбриона с наименьшим количеством желе будет находиться в более тесном контакте с целью.
- Вертикальный микроскоп: сделайте две стопки с четырьмя # 1 покровные склеенных суперклеем для использования в качестве "поддерживает" и место эмбриона блока в глицерина между "поддерживает". Мост стеки с помощью длинного покровного.
- Для конфокальной анализ, проверить рабочее расстояние цели, которые будут использоваться, чтобы узнать, можно ли изображение весь путь до конца эмбриона или только частично. Например, Д. MELANOGASTER эмбрионы ~ 0,55 мм в длину и может быть полностью отображаемого использованием Zeiss 20x План-Апо или 40x LD Нео-Fluor цели. Следующие веб-сайт содержит информацию об имеющихся целей Zeiss и дает вам возможность поиска целей в соответствии с рабочим расстоянием: https://www.micro-shop.zeiss.com/us/us_en/objektive.php
2. Представитель Результаты
Поскольку эмбрионы остаются нетронутыми, этот метод может использоваться, чтобы взять точные измерения размера эмбриона и расстояния между паттернами экспрессии генов. На рисунке 1, мы показываем бластодерма стадии эмбрионов окрашивали ядерным пятно DAPI (синий), анти-Спинной белка (красный), SOG мРНК (желтый) и СНС мРНК (зеленый). Морфологические процессорыСЭС, таких как инвагинации мезодермы (рис. 2а, б) и миграции мезодермального клетки (рис. 3 и 4) также могут быть визуализированы с помощью этого метода. Различные Z-позиции вдоль оси Д. В. может быть получен путем изменения фокальной плоскости, как показано на рисунках 2-4.
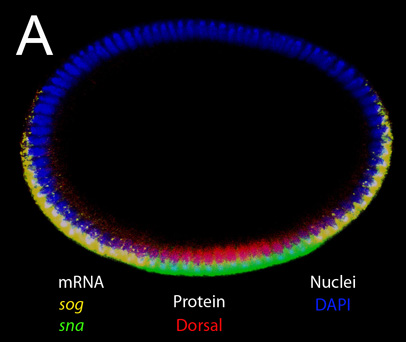
Рисунок 1. Вертикальный оптический кусочек нетронутой эмбриона в стадии бластодермы. Двойное окрашивание на мРНК и белка. Целевая мРНК на месте зонды (SOG и СНС) и белка окрашивали первичного антитела (анти-Спинной) указаны на рисунке. DAPI был использован для обозначения ядер. Обратите внимание, что выражение SOG и СНС расположены вершиной в цитоплазме, в то время как выражение Спинной ядерный. Сильные сигналы от SOG зарождающейся стенограмм, которые расположены в ядрах можно также рассматривать в этом увеличении.
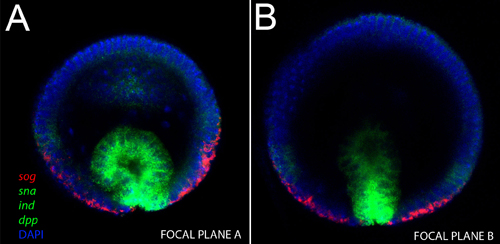
Рисунок 2. Вертикальная съемка нетронутыми gastrulating эмбриона. Зондов мРНК использовали и их цвета указаны на рисунке. ) Отметим, что на этой стадии, три гена, окрашивали же фтор (СНС, SOG и DPP, в зеленый цвет), выражаются в пространственно разделенных областях. Инвагинирующий мезодермы выражает СНС, нейробластов слоя выражает инд и эктодермы выражает DPP, а SOG выражении все еще присутствует в вентральной области нервной системы. Б) В глубоком конфокальной плоскости того же зародыша, отметим, база инвагинирующий мезодермы сильно выражает СНС, но его апикальной области выражает более низких уровнях.
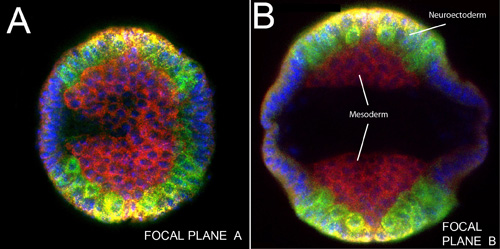
Рисунок 3. Вертикальная съемка нетронутыми эмбрион зародыш группу расширенного SOG РНК (желтый);. Улитка, инд и DPP мРНК (зеленый), Спинной белка (красный). Ядра окрашивали DAPI (синий). А) в фокальной плоскости вблизи эмбриона голову. B) Другой фокальной плоскости в багажнике области же эмбриона. Обратите внимание, масса мезодермального клетки до латеральной миграции (сравните с рис 4) плотно прилегающая к вентральной срединной линии по обе стороны зародышевой группа расширенной эмбриона. Расслоения нейробластов помечены зеленым цветом (инд и СНС).
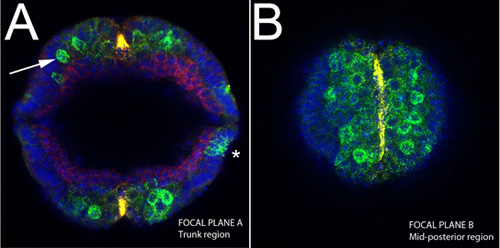
Рисунок 4. Вертикальная съемка нетронутыми эмбриона во время зародыш расширение группы SOG РНК (желтый);. Улитка, инд и DPP мРНК (зеленый), Спинной белка (красный). А) Примечание расслоения нейробластов из эпителия (стрелка), витражи, как для инд и СНС на данном этапе (зеленый). Отметим также ограничено выражением SOG на вентральной срединной линии (желтый). Выражение DPP на данном этапе можно увидеть на боковых сторон эмбриона (звездочка). B) Оптический раздел в том же эмбриона показано в конце эмбриона длиной, которая соответствует середине задней области. Вентральной срединной клетки окрашиваются для SOG.
Обсуждение
Принимая крест изображения разделе эмбрионов дрозофилы может оказаться непростой задачей, так как он требует либо осторожны рассечение руки ломтиками 2 или использование встроенных средств массовой информации для микротома обработки, которая, как правило, вредно для люминесцентных окрашивания. Кроме того, Z-стеки, сделанные в конфокальной микроскопии могут быть использованы для 3D-реконструкция сечения изображений. Однако, это занимает много времени, чтобы сделать несколько тонких ломтиков конфокальной для точной 3D-реконструкции и фотообесцвечивания становится проблематичным. Еще одна проблема, когда изображения эмбрионов, которые установлены продольно является рассеяние света, которое происходит при достижении глубоких участках эмбриона, который также затрудняет принятие точные измерения флуоресцентных сигналов с целью количественной оценки белка или экспрессии мРНК уровни 1. Даже с двухфотонного конфокальной микроскопии, рассеяния света все еще является проблемой из-за непрозрачности материала желтка в середине эмбрион, который делает выбор монтажных средств массовой информации для оптимальной прозрачности образца, будет ограниченным.
Чтобы обойти эти проблемы, новые технологии, называемой "End-на" изображение позиционирования эмбрионов вертикально недавно был разработан для изображения в реальном времени и фиксированных образцов 4. В данной работе мы разработали новый протокол для вертикально установленных эмбрионов, которое позволяет простым подготовки и визуализации фиксированных эмбрионов или тканей любого размера и формы, которые окрашивают несколько зондов на месте 3. Наш метод заключается в использовании установки средств массовой информации с желатиновой последовательности, которая используется для накрыть выровнены эмбриона внутри нее. Вырезать блоки этой монтажа сред, содержащих встроенный эмбрионы могут быть расположены вертикально перед изображениями в любом типе конфокальной микроскопии.
По вложения эмбрионов в желе и располагая их по вертикали, мы можем принять горизонтальное сечения с помощью конфокальной микроскопии, при котором клетки вдоль спинной-вентральной оси эмбриона представлены одновременно. Это значительное улучшение по количественной цели, поскольку проблемы рассеяния света и фотообесцвечивания флуоресцентных красителей, который происходит в обычной Z-Stack реконструкция продольно установленный эмбрионов в настоящее время устранены. Таким образом, количественная оценка экспрессии гена или белка вдоль спинной-вентральной оси является точной, так как клетки, расположенные на противоположных спинно-вентральной позиции изображаются в то же время и в то же конфокальной Z-позиции. Кроме того, описанный метод позволяет получить полную 2-D изображения по спинно-вентральной оси от 3-D эмбриона без использования сложных вычислительных методов разворачивания для визуализации клеток на различных позициях вдоль оси Д. В. 6.
Некоторые критические шаги включают удаления избытка глицерина после выравнивания эмбрионов, чтобы избежать раскола между двумя слоями желе. Однако, если образец слишком обезвоженной, результирующее изображение будет деформировано и неправильные морфологии. Кроме того, если средний желе вокруг эмбриона режется под углом, а не прямо, результирующее изображение может показаться менее круглыми и более овулярный в форме, из-за неверного позиционирования эмбрионов под углом, отличным от 90 градусов. Наконец, если желе не режется достаточно близкие к эмбрион на передних / задних концов, это не представляется возможным получить правильное изображение, поскольку рабочее расстояние цель была бы в основном используется для фокус в желе, а не эмбриона.
Еще один важный шаг, который может быть необходимо при изображении конце gastrulating эмбрион тщательно сортировать этапах интерес к сфере до приведения их в соответствие. Как правило, эмбрионы поставленный по морфологическим признакам, которые могут быть наиболее легко распознать, когда в продольном положении.
Среди альтернативных изменений, которые могут быть сделаны с помощью этого метода заключается во включении анти-Fade реагента (например, р-фенилендиамина или PPD), во второй слой желе для защиты от фотообесцвечивания флуоресцентных красителей.
Раскрытие информации
Благодарности
Авторы особенно признательны Дебора Харрис и Даниэль Маккей. Поддержка эта работа была предоставлена биологический факультет и колледж искусств и наук CWRU, и HHMI номер гранта 52005866 на поддержку высшее образование в области биологических наук.
Материалы
| Name | Company | Catalog Number | Comments |
| Glycerin Jelly mounting media | Electron Microscopy Sciences | 17998-10 | Contains low concentration of phenol as preservative and should be used in hood or in well ventilated area. Recipe for making your own media is described in Zander, 1997. |
| Zeiss LSM 700 Confocal | Carl Zeiss, Inc. | The following objectives were used: Plan-Apo 20x 0.8 M27 (WD 0.55mm); EC Plan-Neofluar 40x 1.3 oil (WD 0.21mm); LD Plan-Neofluar 0.6 Korr 40X (WD 2.9mm). | |
| Phosphate buffered saline with 0.1% Tween 20 (PBT) | |||
| Glass microscope slides | Fisher Scientific | 12-544-7 | |
| Glass cover slips | Electron Microscopy Sciences | 72204-02 | Size 1 ½ (specific for the objectives used in this work). |
| Glass cover slips (for making supports) | Fisher Scientific | 12-544-10 | Use four coverslips glued with superglue. |
| Dissection microscope | M5 Wild Heerbrugg Wild Makroskop | M420 | |
| Razor blade | Steel back single edge industrial blades | ||
| Spatula | Fisher Scientific | 21-401-10 | |
| Hypodermic needles | Fisher Scientific | 1482610 | 26 Gauge |
| Pipettes | Labnet International |
Ссылки
- Ay, A., Fakhouri, W. D., Chiu, C., Arnosti, D. N. Image processing and analysis for quantifying gene expression from early Drosophila embryos. Tissue Engineering. 14, 1517-1526 (2008).
- Grβhans, J., Wieschaus, E. A genetic link between morphogenesis and cell division during formation of the ventral furrow in Drosophila. Cell. 101, 523-531 (2000).
- Kosman, D., Mizutani, C. M., Lemons, D., Cox, W. G., McGinnis, W., Bier, E. Multiplex detection of RNA expression in Drosophila embryos. Science. 305, 846-846 (2004).
- Witzberger, M. M., Fitzpatrick, J. A. J., Crowley, J. C., Minden, J. S. End-on imaging: a new perspective on dorsoventral development in Drosophila embryos. Developmental Dynamics. 237, 3252-3259 (2008).
- Zander, R. H. On mounting delicate bryophytes in glycerol. The Bryologist. 100, 380-382 (1997).
- Liberman, L. M., Reeves, G. T., Stathopoulos, A. Quantitative imaging of the Dorsal nuclear gradient reveals limitations to threshold-dependent patterning in Drosophila. Proc Natl Acad Sci U S A. 106 (52), 22317-2222 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены