Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes en tiempo real de los leucotrienos B 4 La migración mediada por células y BLT1 interacciones con β-arrestina
En este artículo
Resumen
Este trabajo describe la metodología para determinar la respuesta quimiotáctica de los leucocitos a ligandos específicos e identificar las interacciones entre los receptores de superficie celular y proteínas citosólicas utilizando técnicas de imagen en vivo de la célula.
Resumen
Receptores acoplados a proteína G (GPCR) pertenecen a la familia de proteínas transmembrana siete y mediar en la transducción de señales extracelulares de respuestas intracelulares. GPCRs control de diversas funciones biológicas como la quimiotaxis, la liberación de calcio intracelular, regulación de los genes de una manera dependiente de ligando a través de heterotrimeric proteínas G 1-2. Unión del ligando induce una serie de cambios conformacionales que conducen a la activación de heterotrimeric G-proteínas que modulan los niveles de segundos mensajeros como el monofosfato de adenosina cíclico (cAMP), inositol trifosfato (IP3) y glicerol diacil (DG). Concomitante con la activación de la unión del ligando del receptor también inicia una serie de eventos para atenuar la señalización del receptor a través de la desensibilización, el secuestro y / o internalización. El proceso de desensibilización de GPCRs se produce a través de la fosforilación de los receptores de las quinasas del receptor de la proteína G (GRKs) y posterior unión de β-arrestins 3. β-arrestins son proteínas citosólicas y trasladar a la membrana de la activación de GPCR, la unión a receptores fosforilados (la mayoría de los casos) que, al facilitar la internalización del receptor 6.4.
Leucotrieno B 4 (LTB 4) es una molécula pro-inflamatoria lípidos derivados del ácido araquidónico vía y media sus acciones a través de GPCRs, LTB 4 receptor 1 (BLT1, un receptor de alta afinidad) y LTB 4 receptor 2 (BLT2, un receptor de baja afinidad ) 7-9. El LTB 4 BLT1 vía ha demostrado ser crucial en varias enfermedades inflamatorias, entre ellas, el asma, la artritis y la aterosclerosis 10-17. El presente documento describe las metodologías desarrolladas para controlar LTB 4-inducida por la migración de leucocitos y las interacciones de BLT1 con β-arrestina y translocación de los receptores en las células vivas mediante técnicas de microscopía 18-19.
La médula ósea procedentes de células dendríticas de ratones C57BL / 6 fueron aisladas y cultivadas como se describió anteriormente 20-21. Estas células se pusieron a prueba en vivo de imágenes de células métodos para demostrar LTB 4 migración celular inducida. El BLT1 humanos fue etiquetado con la proteína roja fluorescente (RFP BLT1-) en el C-terminal y β-arrestin1 etiquetados con una proteína fluorescente verde (β-arr-GFP) y se transfectaron los plásmidos, tanto en rata basófilos Leukomia (RBL-2H3) las líneas celulares 18-19. La cinética de la interacción entre estas proteínas y la localización se controlaron mediante microscopía de vídeo en directo de la célula. Las metodologías en el presente documento describe el uso de técnicas de microscopía para investigar las respuestas funcionales de los receptores de la proteína G de acoplamiento en las células vivas. El presente documento también describe el uso de software Metamorph para cuantificar la intensidad de fluorescencia para determinar la cinética de los receptores y las interacciones de las proteínas citosólicas.
Protocolo
Metodología
Descripción del Microscopio
Experimentos en vivo de imágenes de células realizó con TE-FM Epi-Fluorescencia sistema conectado al microscopio Nikon Eclipse TE300 invertido. El microscopio equipado con fase de calentamiento. Un fresco presión HQ digitales B / W CCD (Roper científico) de la cámara y LAMDA 10.02 óptico cambiador de filtros (compañía de Sutter instrumento) se une al microscopio. Longitudes de onda de excitación y emisión se controla con ruedas de filtros y control de Lamba 02.10 controlador rueda de filtros, Sutter Instruments Co. Tiempo de exposición de 500 ms debería ser suficiente para ver la RFP o GFP en células vivas. Hardware de control y adquisición de imágenes se controlan por software Metamorph. La elección de los filtros para el presente estudio son, conjuntos de filtros S525/40m S480/20x y S565/25x, S620/60m de las buenas prácticas agrarias y RFP, respectivamente; EGFP / DsRed doble tecnología dicroica, Chroma. Esta rueda de filtros con capacidad para seis conjuntos de filtros. Microscopio se conecta con el controlador de una etapa anterior Proscan con joystick. Todos estos accesorios puede ser controlado por el software Metamorph. El microscopio también se adjunta con Micromanipuladores para mantener la micropipeta.
A. Medición de los leucotrienos B 4 migración dirigida células dendríticas
Usando el microscopio por encima del ajuste descrito, hemos desarrollado métodos para seguir ligando dirigido la migración de células dendríticas en tiempo real. Dos micromanipulador (Narishige) se unen al microscopio. La quimiotaxis de médula ósea de ratón a células dendríticas (BMDCs) a LTB 4 gradiente se registró. Aquí se describen los métodos para preparar las pipetas con micro-micro-pipeta extractor, la carga del ligando en micro-pipeta y la creación de la quimiotaxis experimento en el escenario con calefacción del microscopio para controlar la migración direccional de las células. Este método puede ser aplicado para probar la eficacia de los distintos factores quimiotácticos en la inducción de la migración, así como efecto de los inhibidores de la quimiotaxis en células vivas. El aislamiento de BMDCs 21 de ratón se ha descrito en varias publicaciones incluyendo JoVe 22.
1. Preparación de BMDCs
- El plato del BMDCs (después de un cultivo de 10 días) en el plato cubre-fluoro fondo y que puedan crecer durante 16 horas antes del experimento.
- Se lavan las células con 3 ml de PBS 1X por lo menos 2 veces (mediante la adición de 3 ml de PBS 1X a la placa y de la aspiración del buffer).
- Añadir 2 ml de 1XPBS a la placa. Las células están listas para el experimento. Mantener las células en 37 ° C incubadora antes del experimento.
Preparación del ligando cargado micro pipeta:
- Fijar los tubos capilares de vidrio (vidrio estándar, de 0,75 mm x 0,4 mm, 6 ", Cat # 625500, AM Systems, INC) en el eje vertical extractor micropipeta (Narishige Internacional de EE.UU., Inc).
- Mantener la temperatura a 52 ° C y permitir que el vidrio se derrita y se separan para formar puntas afiladas borde.
- Fijar la pipeta en el soporte de micro-pipeta.
- Suavizar los bordes ásperos de las micro pipeta con Micro forjar M-900 (Narishige Internacional de EE.UU., Inc) observando al microscopio.
- Prepare por lo menos 10-20 pipetas para cada experimento. Nota: Las micropipetas también se pueden comprar a partir de instrumentos de precisión Mundial (TIP μ, T1801TW1F).
- Tener la concentración deseada (500 l de 100 LTB 4 nM en el experimento actual) del ligando en 1 ml del tubo effendorf y mantener la punta de micropipeta en la solución y permita que la solución para entrar en la micropipeta (rellenado).
- Tomar 1 ml de ligando y en la jeringa (1 cc jeringa de tuberculina) y poco a poco llenar el ligando con Micro-Fill aguja (MF 28G-5, Instrumentos del Mundo de Precisión) en micro pipeta de arriba.
- Conecte el tubo, lo que encaja perfectamente con la pipeta para pipeta y el tubo a la aguja (21 G 11 / 2) conectado a una jeringa de 1 ml, que se llena con el ligando.
- Ahora, mueva con cuidado el ligando lleno de micro-pipeta para la platina del microscopio y fijar en micro manipuladores.
- Aplicar muy poca presión de la jeringa para hacer ligando esté liberando lentamente de la punta.
- Llevar el BMDCs inmaduros plateado para el microscopio y mantenerlos en la placa calentada (37 ° C) el escenario.
- Retire la tapa de plato de flúor.
- El enfoque de la lente de las células utilizando aceite de inmersión objetivo 60X.
- Con cuidado, reducir el ligando cargado pipeta con 'Manual de Manipulador de grueso MN-188NE a la proximidad de las células.
- El enfoque de la pipeta con 'Micromanipulador hidráulico Bellas MN-188 NE.
- Aplicar muy poca presión de la jeringa para asegurarse de que está ligando la liberación en el plato.
- Establezca los parámetros de adquisición de imágenes para la adquisición de brillantes presentado (10 ms de exposición) en cada 15 segundos durante 2 horas utilizando el software Metamorph.
- Mantener la vigilancia cada 30 minutos por progression de la migración hacia el ligando.
- Si las células están llenas de punta de la pipeta, cambiar la ubicación de la punta en el plato para continuar con la migración de experimento.
B. Medición de GPCR (BLT1) y proteína citosólica (β-arrestina) Interacciones, translocación en las células vivas
1. Preparación de construcciones de ADN plásmido
Los detalles de las construcciones de ADN plásmido se describe en Jala et al. (2005) 18.
2. Transfección de los Derechos Humanos BLT1-PP y β-arrestina-GFP en células RBL-2H3
- Mantener la rata basófilos Leukomia (RBL-2H3) células (60 a 70% de confluencia) a 37 ° C en una atmósfera húmeda de aire del 95%, 5% de CO 2 como monocapas en medios de cultivo (DMEM suplementado con FBS al 15%, 2 mM L-glutamina, 100 U / mL de penicilina y 100 ug / ml de estreptomicina) en frascos T75.
- Separar las células de la antena / frascos con 6 mL de tripsina-EDTA (0,05% de tripsina, 0,53 mM EDTA) y el período de incubación de 5 min a 37 ° C en una atmósfera húmeda de aire del 95%, 5% de CO 2. Agitar suavemente los frascos para controlar el grado de desprendimiento de las células.
- Agregar 6 ml de medio de cultivo al frasco que contiene 6 ml de tripsina-EDTA y recoger las células mediante la mezcla de ellos con la pipeta hacia arriba y abajo varias veces. Transferencia de las células en 15 ml tubos falcon.
- Contar las células utilizando un hemocitómetro y tomar 4 x 10 6 células en tubos de 15 ml de centrífuga y centrifugar a 480 g rpm durante 3 min y se resuspenden en 200 l de los medios de transfección (DMEM, 20% de SFB, HEPES 50 mM). Si va a realizar 3 transfections, preparar las células y los medios de comunicación tranfection en consecuencia el número de células cada vez mayor y el volumen de medio de transfección.
- Prepare los plásmidos que se transfectadas en las concentraciones de al menos 1,5 mg / mL. Preparamos el ADN del plásmido mediante el uso de ADN plásmido QIAGEN Maxi kit. Añadir el individuo o la codificación de ADN plásmido humanos BLT1-RFP (25 mg) y β-arrestin1 GFP-(15 mg) a cubetas de electroforesis estéril, (Bio-Rad # 16552088), que tiene 0,4 cm de distancia entre los electrodos.
- Tome 200 l de las células se resuspendieron por encima y colocarlos en las cubetas que contienen hBLT1-RFP o β-arrestin1 GFP-o los dos juntos y mezclar suavemente con una pipeta mL estéril.
- Dejar las cubetas arriba a temperatura ambiente durante 10 min.
- Electroporar las células de Gene Emisores II con la tensión de 250 V y capacidad de 500 mF.
- Después de la electroporación que las células mantenerse a temperatura ambiente durante 10 min.
- Tomar 1 ml de medio de crecimiento normal y se mezcla con las células por electroporación en las cubetas.
- Distribución de 300 l de esta mezcla en 35 mm platos de cristal de cultivo de tejido de fondo (plato de flúor, instrumentos de precisión Mundial) que contiene 2 ml de medio de cultivo habitual y se incuba durante 1 hora a 37 ° C en una atmósfera húmeda de aire del 95%, 5% de CO 2. Permitir que las células se adhieran a fondo del plato.
- Vuelva a colocar los medios de comunicación después de 1 h de incubación con los medios de comunicación regular de crecimiento y les permite crecer a 37 ° C en una atmósfera húmeda de aire del 95%, 5% de CO 2 incubadora durante 18-24 horas.
3. Imágenes de células vivas
Adquisición de imágenes
- Después de 18-24 horas, lave el 2 células o 3 veces con 2 ml de agua tibia rojo fenol libre de RPMI con 10 mM HEPES, pH 7,55 (Agregue 2 ml de medio de calentamiento directamente a la placa y los medios de comunicación aspirado. Repita 2 o 3 veces). Añadir 1,8 ml de fenol caliente RPMI exento de rojo que contiene HEPES 10 mM.
- Lugar de 30 mm de vidrio cubreobjetos de fondo placas de cultivo que contienen células RBL-2H3, transfectadas con hBLT1-PP y β-arrestin1-GFP en la platina del microscopio climatizada (37 ° C).
- Recoger las imágenes de la celda con un aumento de 600x con objetivo Nikon 60 X Plan Apo 60X/1.4 aceite apertura numérica del objetivo de inmersión (disponible en nuestro sistema de microscopio).
- Pon una gota de aceite en la lente objetivo 60 x y el enfoque de las células con campo claro regulares de luz transmitida por tocar el fondo de la placa.
- Para controlar la fluorescencia de las proteínas transfectadas, cambiar de campo claro (luz transmitida) a filtros de fluorescencia (RFP filtro, si es que quieres ver o receptor de las buenas prácticas agrarias, si quieres ver β-arrestin1).
- Elija la celda brillante y saludable, que expresa hBLT1-RFP en la superficie celular con RFP filtro y capturar la imagen.
- A continuación, pasar a las buenas prácticas agrarias filtro y asegúrese de que β-arrestina-GFP se expresa en el citoplasma y la captura de la imagen. Luego color pseudo-tanto las imágenes, antes de tiempo transcurrido capturar imágenes de células vivas para asegurarse de que sangran a través de la fluorescencia no se está produciendo entre el PP y las buenas prácticas agrarias.
- Una vez que la elección de su celda de hecho, establecer los parámetros de acuerdo a su propósito el uso de software (Software Metamorph en este caso).
- En la manifestación actual, dieciséis bits de imágenes se adquieren con el vinora conjunto de intervalos de 1 X 1 en combinación con el Plan 60 X objetivo Nikon Apo 60X/1.4 aceite apertura numérica del objetivo de inmersión.
- Recoger las imágenes de fluorescencia de GFP PP y fluorocromos simultáneamente en 30 segundos el intervalo de tiempo (si las interacciones translocación / son demasiado rápidos, se puede reducir los intervalos de tiempo) de estas ruedas con filtros controlados por el software Metamorph.
- Los tiempos de exposición La cámara está ajustada a 1000 ms de RFP y las buenas prácticas agrarias. (Establecer los tiempos de exposición específicas de acuerdo a la intensidad de fluorescencia de RFP y las buenas prácticas agrarias).
- En primer lugar recoger las imágenes durante 1 minuto sin la adición de ligando, que actúa como punto de tiempo 0.
- Agregue el l 200 de ligando (a partir de un balance de 10 M a una concentración final de 1 mM) después de 1 minuto sin molestar a la placa / o la posición de la célula.
- Las imágenes de fluorescencia se recogen durante 60 minutos después de añadir el ligando y se almacena como imágenes TIFF con el orden creciente de los nombres de archivo.
- Todos estos archivos se pueden hacer como los archivos de la pila de imágenes de fluorescencia individual / combinado con marcas de tiempo con el software.
Proceso de imágenes y la cuantificación de la fluorescencia de las proteínas y localización
- Adquirir las imágenes con papel normal (sin células) con filtros de PP y GFP fluorescentes y guardarlas como imágenes de fondo. Utilizar estas imágenes para restar a partir de imágenes de datos reales obtenidos anteriormente.
- Prepare la pila de imágenes de forma individual para imágenes RFP y las buenas prácticas agrarias.
- Seleccionar / definir las distintas regiones (vs superficie citosólica) para medir la intensidad de la fluorescencia de GFP y RFP (BLT1 y translocación β-arrestina)
- Trace la intensidad de fluorescencia como la cantidad en función del tiempo. En este gráfico se proporcionará la información acerca de la cinética de la translocación de la molécula determinada.
Resultados representante
A. Medición de los leucotrienos B 4 migración dirigida células dendríticas
El método descrito en este protocolo se utilizó para determinar la migración de células dendríticas hacia los leucotrienos B 4 (Figura 1 y el video adjunto 1) 21. Podemos aplicar la misma metodología para determinar la capacidad quimiotáctica de las células de un ligando particular en las células vivas.
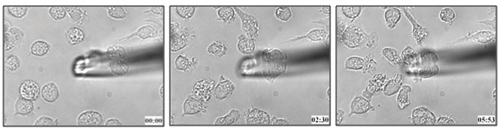
Figura 1. Médula ósea de ratón con células dendríticas derivadas de migración hacia el 100 nM LTB 4.
Video 1. Migración en vivo de células de BMDCs a LTB 4. Haga clic aquí para ver el vídeo .
B. Medición de GPCR (BLT1) y proteína citosólica (β-arrestina) Interacciones, translocación en las células vivas
Una vez finalizado este procedimiento, se puede obtener la siguiente información en los eventos de señalización de GPCR.
- La localización de los GPCR y proteínas citosólicas y el núcleo (Figura 2).
- Inducida por ligando la interacción de la superficie de GPCR (BLT1 en este caso) con la proteína citosólica (β-arrestina en este caso) (Fig. 3).
- Cinética de internalización del receptor y translocación de β-arrestina a la membrana seguido de la internalización, junto con los receptores (Figura 4) (Jala et al. 2005) 18.
- Se puede determinar el ligando dependiente estado de activación de los receptores en las células vivas (que se adjunta video 2) y determinar los motivos críticos o procesos involucrados en la activación de los receptores (Jala et al. 2005) 18.
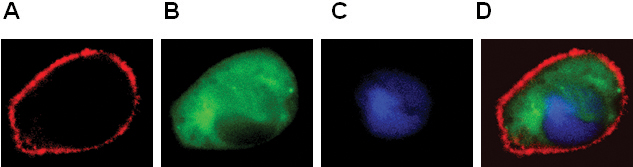
Figura 2. Expresión de BLT1-RFP (A), β-arrestina-GFP (B), pNuc PPC-(C) en células RBL-2H3. Color combinado imagen que se muestra en el panel D.
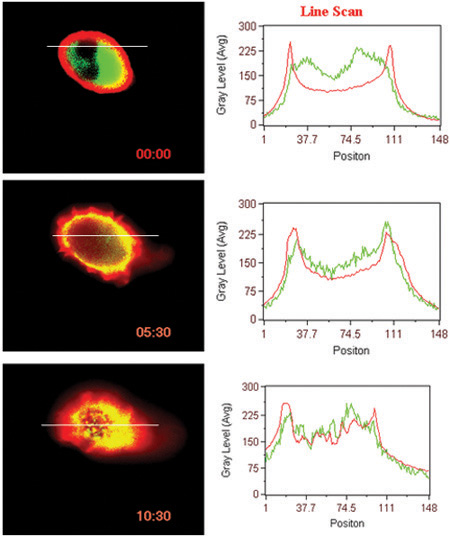
Figura 3. Translocación inducida por ligando del receptor y β-arrestina. Análisis de la línea de intensidad de fluorescencia en las células se muestran.
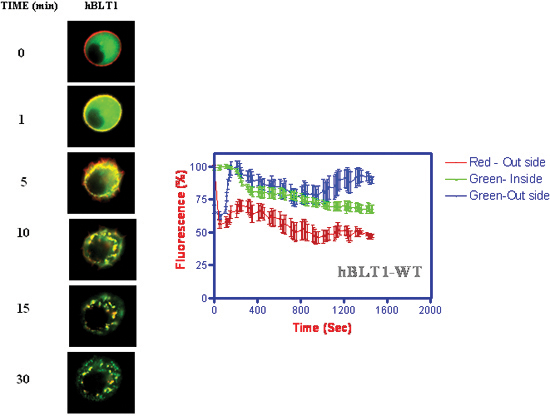
Figura 4. Cinética de la internalización del receptor y translocación de β-arrestina con la adición de 1 mM LTB 4. La intensidad de fluorescencia se mide en función del tiempo en la membrana y citosólicas lugares de la célula.
Video 2 imágenes en vivo de las células que expresan BLT1-PP y β-arrestina-GFP en la adición de 1 mM LTB 4. Haga clic aquí para ver el video
Discusión
Imágenes de células vivas es una poderosa herramienta para demostrar la función y las interacciones de las proteínas específicas que se producen en tiempo real. Los métodos descritos en este manuscrito muestra claramente que LTB 4 puede inducir una rápida migración de las células dendríticas. Estos métodos no sólo ampliar los aspectos de LTB 4 en función de diversos tipos de células, que permiten a los mismos métodos que se aplican a una variedad de otras quimiocinas y pruebas de su ...
Divulgaciones
Agradecimientos
La investigación es apoyada por los Institutos Nacionales de Salud subvenciones AI-52 381, CA138623 y Kentucky, el cáncer de pulmón Junta de Investigaciones y el apoyo institucional de James Graham Brown Cancer Center.
Materiales
| Name | Company | Catalog Number | Comments |
| Rat Basophilic Leukomia Cell line (RBL-2H3) or HEK293 cells. | ATCC | CRL-2256 | |
| Delbecco’s modified Eagle’s Medium (DMEM) | Invitrogen | 11995 | |
| Phenol red free RPMI or DMEM | Invitrogen | 11835-030 | |
| Fetal Bovine Serum | Invitrogen | 16000-044 | |
| L-Glutamine (200 mM) | Invitrogen | 25030 | |
| Penicillin-streptomycin (10000 U/mL) | Invitrogen | 15140 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300 | |
| HEPES (1M) | Invitrogen | 15630 | |
| 35 mm sterile glass coverslip-bottomed Fluoro dishes (0.17 mm thick) (WillCo-dish) | World Precision Instruments, Inc. | FD35-100 | |
| Sterile Gene Pulser Cuvette (0.4 cm electrode gap) (Bio-Rad) | Bio-Rad | 16552088 | |
| Gene Pulser II electroporater | Bio-Rad | ||
| TE-FM Epi-Fluorescence system attached to Nikon Inverted Microscope Eclipse TE300 | Nikon Instruments | ||
| Metamorph Software | Universal Imaging | ||
| Vertical Micro-pipette puller | Narishige International | ||
| Micro-Forge M-900 | Narishige International | ||
| Hadraulic Micromanipulator MO-188NE | Narishige International | ||
| Coarse Manual Manipulator, MN-188NE | Narishige International | ||
| cDNA constructs: | |||
| cDNA of G-Protein coupled receptor tagged with red fluorescence protein at C-terminus (hBLT1-RFP) | Jala et al 2005 | ||
| cDNA of cytosolic protein tagged with GFP (β-arrestin1-GFP in present study). | Jala et al 2005 |
Referencias
- Wess, J. G-protein-coupled receptors: molecular mechanisms involved in receptor activation and selectivity of G-protein recognition. FASEB J. 11, 346-354 (1997).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21, 90-113 (2000).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Lefkowitz, R. J. G. protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J Biol Chem. 273, 18677-18680 (1998).
- Shenoy, S. K., Lefkowitz, R. J. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signalling. Biochem J. 375, 503-515 (2003).
- . Beta-arrest or. Nature. 383, 447-450 (1996).
- Serhan, C. N., Haeggstrom, J. Z., Leslie, C. C. Lipid mediator networks in cell signaling: update and impact of cytokines. Faseb J. 10, 1147-1158 (1996).
- Tager, A. M., Luster, A. D. BLT1 and BLT2: the leukotriene B(4) receptors. Prostaglandins Leukot Essent Fatty Acids. 69, 123-134 (2003).
- Toda, A., Yokomizo, T., Shimizu, T. Leukotriene B4 receptors. Prostaglandins Other Lipid Mediat. 68-69, 575-585 (2002).
- Haribabu, B. Targeted disruption of the leukotriene B(4) receptor in mice reveals its role in inflammation and platelet-activating factor-induced anaphylaxis. J Exp Med. 192, 433-438 (2000).
- Subbarao, K. Role of leukotriene B4 receptors in the development of atherosclerosis: potential mechanisms. Arterioscler Thromb Vasc Biol. 24, 369-375 (2004).
- Jala, V. R., Haribabu, B. Leukotrienes and atherosclerosis: new roles for old mediators. Trends Immunol. 25, 315-322 (2004).
- Heller, E. A. Inhibition of atherogenesis in BLT1-deficient mice reveals a role for LTB4 and BLT1 in smooth muscle cell recruitment. Circulation. 112, 578-586 (2005).
- Miyahara, N. Requirement for leukotriene B4 receptor 1 in allergen-induced airway hyperresponsiveness. Am J Respir Crit Care Med. 172, 161-167 (2005).
- Terawaki, K. Absence of leukotriene B4 receptor 1 confers resistance to airway hyperresponsiveness and Th2-type immune responses. J Immunol. 175, 4217-4225 (2005).
- Shao, W. H., Del Prete, A., Bock, C. B., Haribabu, B. Targeted disruption of leukotriene B4 receptors BLT1 and BLT2: a critical role for BLT1 in collagen-induced arthritis in mice. J Immunol. 176, 6254-6261 (2006).
- Kim, N. D., Chou, R. C., Seung, E., Tager, A. M., Luster, A. D. A unique requirement for the leukotriene B4 receptor BLT1 for neutrophil recruitment in inflammatory arthritis. J Exp Med. 203, 829-835 (2006).
- Jala, V. R., Shao, W. H., Haribabu, B. Phosphorylation-independent beta-arrestin translocation and internalization of leukotriene B4 receptors. J Biol Chem. 280, 4880-4887 (2005).
- Jala, V. R., Haribabu, B. Real-time analysis of G protein-coupled receptor signaling in live cells. Methods Mol Biol. 332, 159-165 (2006).
- Del Prete, A., A, . Regulation of dendritic cell migration and adaptive immune response by leukotriene B4 receptors: a role for LTB4 in up-regulation of CCR7 expression and function. Blood. 109, 626-631 (2007).
- Salogni, L. Activin A induces dendritic cell migration through the polarized release of CXC chemokine ligands 12 and 14. Blood. 113, 5848-5856 (2009).
- Boudreau, J., Koshy, S., Cummings, D., Wan, Y. Culture of myeloid dendritic cells from bone marrow precursors. J Vis Exp. , (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados