Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В режиме реального времени Визуализация лейкотриена B 4 Опосредованного миграции клеток и BLT1 Взаимодействие с β-arrestin
В этой статье
Резюме
Эта статья описывает методологию для определения хемотаксиса лейкоцитов ответ на специфических лигандов и определить взаимодействие между рецепторами клеточной поверхности и цитозольного белков с использованием живых методов визуализации клеток.
Аннотация
G-protein coupled receptors (GPCRs) belong to the seven transmembrane protein family and mediate the transduction of extracellular signals to intracellular responses. GPCRs control diverse biological functions such as chemotaxis, intracellular calcium release, gene regulation in a ligand dependent manner via heterotrimeric G-proteins1-2. Ligand binding induces a series of conformational changes leading to activation of heterotrimeric G-proteins that modulate levels of second messengers such as cyclic adenosine monophosphate (cAMP), inositol triphosphate (IP3) and diacyl glycerol (DG). Concomitant with activation of the receptor ligand binding also initiates a series of events to attenuate the receptor signaling via desensitization, sequestration and/or internalization. The desensitization process of GPCRs occurs via receptor phosphorylation by G-protein receptor kinases (GRKs) and subsequent binding of β-arrestins3. β-arrestins are cytosolic proteins and translocate to membrane upon GPCR activation, binding to phosphorylated receptors (most cases) there by facilitating receptor internalization 4-6.
Leukotriene B4 (LTB4) is a pro-inflammatory lipid molecule derived from arachidonic acid pathway and mediates its actions via GPCRs, LTB4 receptor 1 (BLT1; a high affinity receptor) and LTB4 receptor 2 (BLT2; a low affinity receptor)7-9. The LTB4-BLT1 pathway has been shown to be critical in several inflammatory diseases including, asthma, arthritis and atherosclerosis10-17. The current paper describes the methodologies developed to monitor LTB4-induced leukocyte migration and the interactions of BLT1 with β-arrestin and , receptor translocation in live cells using microscopy imaging techniques18-19.
Bone marrow derived dendritic cells from C57BL/6 mice were isolated and cultured as previously described 20-21. These cells were tested in live cell imaging methods to demonstrate LTB4 induced cell migration. The human BLT1 was tagged with red fluorescent protein (BLT1-RFP) at C-terminus and β-arrestin1 tagged with green fluorescent protein (β-arr-GFP) and transfected the both plasmids into Rat Basophilic Leukomia (RBL-2H3) cell lines18-19. The kinetics of interaction between these proteins and localization were monitored using live cell video microscopy. The methodologies in the current paper describe the use of microscopic techniques to investigate the functional responses of G-protein coupled receptors in live cells. The current paper also describes the use of Metamorph software to quantify the fluorescence intensities to determine the kinetics of receptor and cytosolic protein interactions.
протокол
Методология
Описание микроскоп
Живая клетка экспериментов изображений производится с помощью FM-TE-эпи-флуоресценции систему, подключенную к инвертированный микроскоп Nikon Eclipse, TE300. Микроскоп оснащен отопления стадии. Прохладный оснастки HQ цифрового Ч / Б CCD (Roper Scientific) камеры и LAMDA 10-2 оптический фильтр чейнджер (Саттер инструмент компании) крепится к микроскопа. Возбуждение и излучение длиной волны контролируются с фильтром колеса и контролируется Ламба 10-2 фильтр контроллер колесо, Саттер инструменты Co Выдержка 500 мс должно быть достаточно, чтобы посмотреть в ППП или GFP в живых клетках. Аппаратное управление и получение изображений находятся под контролем программного обеспечения Метаморф. Выбор фильтров для настоящего исследования, наборы фильтров S480/20x, S525/40m и S565/25x, S620/60m для GFP и RFP, соответственно; EGFP / DsRed двойной дихроичных, Chroma Technology. Этот фильтр колесо может вместить до шести наборов фильтров. Микроскоп крепится До Проскан контроллер сцене с Джойстик. Все эти вложения аппаратных можно управлять с помощью программного обеспечения Метаморф. Микроскоп также прилагается с Микроманипуляторы провести микропипетки.
А. Измерение лейкотриена B 4 Режиссер Дендритные миграции клеток
Использование описанных выше микроскопом настройки, мы разработали методы для следующих лиганд направлена дендритных миграции клеток в реальном времени. Два микроманипуляторами (Narishige) прикреплены к микроскопа. Хемотаксис костного мозга мышей дендритных клеток (BMDCs) к LTB 4 градиент был записан. Здесь мы опишем методы для подготовки микро-пипетки с использованием микро-пипетки съемник, погрузка лиганда в микро-пипетки и настройка хемотаксис эксперимент на нагревательный столик микроскопа для контроля направленной миграции клеток. Этот метод может быть применен для проверки эффективности различных хемоаттрактантов в стимулировании миграции, а также эффект ингибиторов хемотаксиса в живых клетках. Изоляция BMDCs 21 от мыши был описан в ряде публикаций, включая Юпитер 22.
1. Подготовка BMDCs
- Пластина BMDCs (после культивирования в течение 10 дней) на нижней крышке блюдо фтор скольжения и дать им возможность расти в течение 16 ч перед экспериментом.
- Вымойте клеток с 3 мл 1X PBS по крайней мере в 2 раза (добавляя 3 мл 1X PBS к плите и аспирационных буфере).
- Добавить 2 мл 1XPBS к пластине. Клетки готов к эксперименту. Держите клеток в 37 ° С инкубатор до эксперимента.
Подготовка лиганд загружены микропипетки:
- Fix стеклянные капилляры (стекло стандарт, 0,75 мм х 0,4 мм, 6 ", Cat # 625500, А. М. Systems, INC) на вертикальной микропипетки съемник (Narishige Международный США, Inc).
- Поддерживать температуру 52 ° С и позволяют стекла для плавления и растащить по форме острия края.
- Fix пипетки на микро-пипетки держателя.
- Гладкая острые углы микропипетки использованием Micro подделать М-900 (Narishige International США, Inc), наблюдая под микроскопом.
- Подготовка по крайней мере 10-20 пипетки для каждого эксперимента. Примечание: микропипетки также можно приобрести от Всемирного точных приборов (μ TIP, T1801TW1F).
- Возьмите желаемой концентрации (500 мкл 100 нМ LTB 4 в текущем эксперименте) лиганда в 1 мл effendorf трубку и держать микро кончика пипетки в растворе и, чтобы раствор вступает в микропипетки (засыпка).
- Принимать по 1 мл лиганда и в шприц (1 мл туберкулиновые шприцы) и медленно заполнить лиганд использованием микро-Fill иглы (28G MF-5, инструменты Всемирного Precision) в микропипетки сверху.
- Прикрепите трубку, которая плотно прилегает к пипеткой пипетки и трубки иглы (21 G 11 / 2) прилагается к 1 мл шприца, который наполнен лиганда.
- Теперь, осторожно двигаться лиганд заполнены микро-пипетки на столик микроскопа и закрепить на микро-манипуляторов.
- Примените немного давление со шприца, чтобы убедиться, лиганд медленно выпуская из наконечника.
- Принесите покрытием незрелых BMDCs к микроскопу и держать их на обогреваемой пластине (37 ° C) стадии.
- Удалите крышку фтор блюдо.
- Фокус клеток с использованием масляной иммерсии 60X объектива.
- Осторожно, сбить лиганд загружены пипетки с помощью "грубой Руководство Манипулятор MN-188NE к близости клеток.
- Фокус пипетки с помощью "Гидравлические изобразительных микроманипулятора MN-188 NE '.
- Примените немного давление со шприца, чтобы убедиться, что лиганд выпускает в блюдо.
- Установите параметры получения изображений приобрести в ярко поданные (10 мс экспозиции) в каждые 15 секунд в течение 2 часов использования Метаморф программного обеспечения.
- Держите мониторинг каждые 30 мин для прogression миграции к лиганд.
- Если ячейки переполнены на кончике пипетки, изменить расположение кончика в пластине для продолжения миграции эксперимента.
В. Измерение GPCR (BLT1) и цитозольного белка (β-arrestin) взаимодействий, транслокации в живых клетках
1. Подготовка плазмидной конструкции ДНК
Детали ДНК плазмиды конструкции были описаны в Джала и соавт. (2005) 18.
2. Трансфекция по правам BLT1-ППП и β-Arrestin-GFP в RBL-2H3 Клетки
- Поддерживать Крыса базофильных Leukomia (RBL-2H3) клетки (от 60 до 70% слияния) при 37 ° C во влажной атмосфере на 95% из воздуха, 5% СО 2, как монослой культур в питательной среде (DMEM дополнена с 15% FBS, 2 мМ L-глутамина, 100 ед / мл пенициллина и 100 мкг / мл, стрептомицин) в колбах T75.
- Отсоедините клетки блюда / колбы с помощью 6 мл трипсина-EDTA (0,05% трипсина, 0,53 мМ ЭДТА) и инкубации в течение 5 мин при 37 ° C во влажной атмосфере 95% воздуха, 5% СО 2. Осторожно встряхните колб для мониторинга масштабов отрыва клеток.
- Добавить 6 мл питательной среды в колбе, содержащей 6 мл трипсина-EDTA и собирают клетки, смешивая их с помощью пипетки вверх и вниз несколько раз. Передача клеток в 15 мл труб сокола.
- Граф клеток с использованием гемоцитометра и принимать 4 х 10 6 клеток в 15 мл центрифужные пробирки и центрифуги на 480 г оборотов в минуту в течение 3 минут и ресуспендируют в 200 мкл трансфекции СМИ (DMEM, 20% FBS, 50 мМ HEPES). Если вы планируете выполнять 3 трансфекции, подготовить клетки и tranfection СМИ соответственно за счет увеличения числа клеток и объема трансфекции среду.
- Подготовка плазмиды для трансфекции в концентрации не менее 1,5 мкг / мкл. Мы готовим ДНК плазмиды с помощью QIAGEN Maxi ДНК плазмиды комплект. Добавить лицо или как плазмиды, кодирующей ДНК для человека BLT1-RFP (25 мкг) и β-arrestin1-GFP (15 мкг) в стерильную кювет электрофореза (Bio-Rad # 16552088), который имеет 0,4 см зазор между электродами.
- Возьмите 200 мкл выше ресуспендировали клетки и поместить их в кювет, содержащих либо hBLT1-RFP или β-arrestin1-GFP или оба вместе и смешивать их осторожно с 1 мл стерильной пипеткой.
- Оставьте выше кювет при комнатной температуре в течение 10 мин.
- Electroporate клеток в генной Pulser II с напряжением 250 В и емкостью 500 мкФ.
- После электропорации позволяют клеткам оставаться при комнатной температуре в течение 10 мин.
- Принимать по 1 мл регулярной среде рост и смешать его с электропорации клеток в кювет.
- Распределить 300 мкл этой смеси на 35 мм ткани со стеклянным дном культуры блюда (фтористый блюдо, инструменты Всемирного Precision), содержащий 2 мл регулярных средах роста и инкубировать в течение 1 часа при температуре 37 ° C во влажной атмосфере на 95% из воздуха, 5% СО 2. Разрешить клетки придерживаться нижней части блюда.
- Замените средств массовой информации после 1 ч инкубации с регулярными питательной среды и позволяют им расти при температуре 37 ° C во влажной атмосфере на 95% из воздуха, 5% СО 2 инкубатора в течение 18-24 часов.
3. Живая изображениями сотовый
Приобретение изображений
- После 18-24 часов, промыть клетки 2 или 3 раза с 2 мл теплой фенола красного свободной RPMI, содержащего 10 мМ HEPES, рН 7,55 (Добавить 2 мл теплой медиа непосредственно в тарелку и аспирации СМИ. Повторите 2 или 3 раза). Добавить 1,8 мл теплого фенола красного свободной RPMI, содержащего 10 мМ HEPES.
- Место 30 мм стекло покровное дном культуры блюд, содержащих RBL-2H3 клеток, трансфицированных hBLT1-ППП и β-arrestin1-GFP на нагревательный столик микроскопа (37 ° С).
- Сбор ячейка изображения при увеличении 600x с использованием 60 X цель Nikon Plan Apo 60X/1.4 числовой апертурой нефти погружения линз (в нашем микроскопе системы).
- Положите одну нефть упасть на 60 линзы цель х и сосредоточиться клетки с регулярными светлое поле проходящего света, прикоснувшись к нижней части пластины.
- Для контроля за флуоресценцию трансфекции белков, переход от светлого поля (проходящий свет) на флуоресцентный фильтр (RFP фильтр, если вы хотите увидеть рецепторов или GFP, если вы хотите увидеть β-arrestin1).
- Выберите яркие и здоровые клетки, которая выражает hBLT1-RFP на клеточной поверхности с помощью ППП фильтр и захвата изображений.
- Затем переход к GFP фильтр и убедиться, что β-arrestin-GFP выражается в цитоплазме и захвата изображений. Потом псевдо цвета и образы, перед съемкой время, прошедшее изображения в реальном времени клетка, чтобы убедиться, что кровотечение через флуоресценции не принимает, возникающие между ППП и GFP.
- После выбора мобильного сделал, установить параметры согласно вашей цели с помощью программного обеспечения (Software Метаморф в данном случае).
- В нынешней демонстрации, шестнадцать битных изображений приобретаются пришелра биннинга установлен в 1 X 1 в сочетании с 60 X цель Nikon Plan Apo 60X/1.4 числовой апертурой нефти погружения линз.
- Сбор флуоресцентные изображения для ППП и GFP флуорохромами одновременно на 30 сек интервал времени (если транслокация / взаимодействия являются слишком быстро, можно уменьшить интервалы времени) из них с помощью фильтра колеса управляемые программным обеспечением Метаморф.
- Раз экспозиции камеры установлен в 1000 мс для ППП и GFP. (Установите определенное время воздействия в соответствии с флуоресцентной интенсивности ППП и GFP).
- Первый сбор изображений в течение 1 мин без добавления лиганда, который служит в качестве временной точке 0.
- Добавить 200 мкл лиганда (со склада в 10 мкМ до конечной концентрации 1 мкМ) через 1 мин, не нарушая пластина / или сотовый позиции.
- Флуоресцентные изображения собираются в течение 60 мин после добавления лиганда и хранится в виде изображений TIFF с возрастающим порядком имен файлов.
- Все эти файлы могут быть сделаны как стек файлы с отдельными / комбинированной флуоресцентные изображения с метками времени с помощью программного обеспечения.
Процесс изображения и количественное определение флуоресценции белков и локализации
- Приобретать изображений с простым СМИ (без клеток) с ППП и GFP флуоресцентных фильтров и сохранить их в качестве фоновых изображений. Используйте эти образы вычесть из реальных изображений данные, полученные выше.
- Подготовка стека изображений индивидуально для ППП и GFP изображений.
- Выбор / определяем различных регионах (против цитозольного поверхности) для измерения интенсивности флуоресценции ППП и GFP (BLT1 и β-arrestin транслокации)
- Участок сумма интенсивности флуоресценции как функция времени. Этот график будет предоставлять информацию о кинетике транслокации данной молекулы.
Представитель Результаты
А. Измерение лейкотриена B 4 Режиссер Дендритные миграции клеток
Метод, описанный в этом протоколе была использована для определения дендритных миграции клеток к лейкотриен B 4 (рис. 1 и прилагается видео 1) 21. Мы можем применить аналогичные методологии для определения хемотаксиса способности клеток к определенному лиганд в живых клетках.
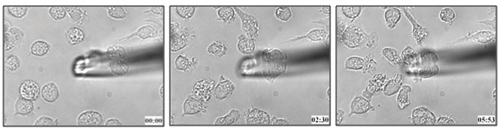
Рисунок 1. Костного мозга мышей дендритных миграции клеток к 100 нм LTB 4.
Видео 1. Живая клетка миграции BMDCs к LTB 4. Нажмите здесь для просмотра видео .
В. Измерение GPCR (BLT1) и цитозольного белка (β-arrestin) взаимодействий, транслокации в живых клетках
По завершении этой процедуры, можно получить следующую информацию в GPCR сигнальных событий.
- Локализация GPCR и цитозольного белков и ядра (рис. 2).
- Лиганд индуцированного взаимодействия поверхностных GPCR (BLT1 в данном случае) с цитозольного белка (β-arrestin в данном случае) (рис. 3).
- Кинетика интернализация рецепторов и β-arrestin транслокации к мембранным следуют интернализации вместе с рецепторами (рис. 4) (Джала и соавт. 2005) 18.
- Можно определить лиганд зависимый статус активации рецепторов в живых клетках (прилагается видео-2) и определения критических мотивов или процессы активации рецептора (Джала и соавт. 2005) 18.
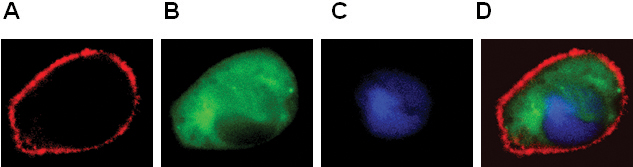
Рисунок 2. Выражение BLT1-RFP (А), β-arrestin-GFP (Б), pNuc-CFP (С) в RBL-2H3 клеток. Цвет комбинированное изображение показано на панели D.
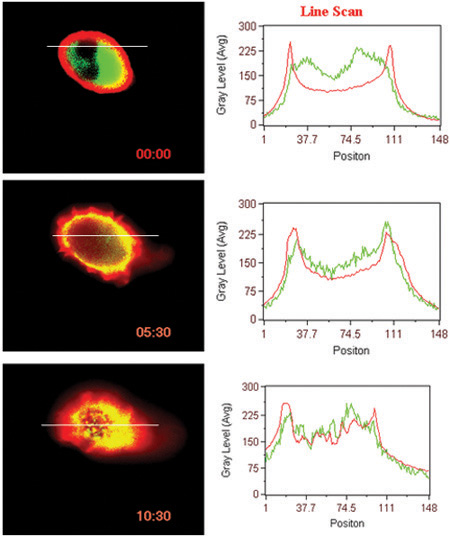
Рисунок 3. Лиганд индуцированных транслокации рецепторов и β-arrestin. Линия сканирования флуоресцентных интенсивности в клетки показано на рисунке.
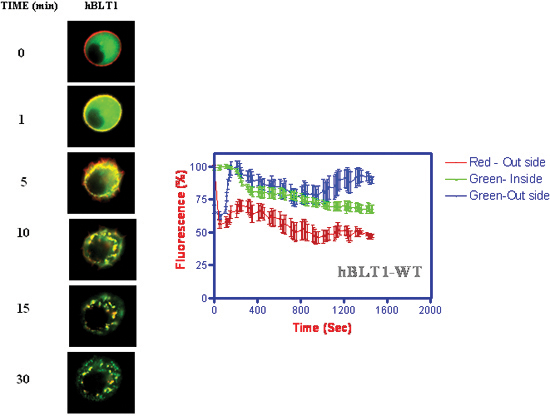
Рисунок 4. Кинетика интернализация рецепторов и β-arrestin транслокации при добавлении 1 мкМ LTB 4. Интенсивности флуоресценции измеряли как функцию времени на мембране и цитоплазме местах клетки.
Видео 2 Live изображений клеток, экспрессирующих BLT1-ППП и β-arrestin-GFP при добавлении 1 мкМ LTB 4. Нажмите здесь, чтобы посмотреть видео
Обсуждение
Живая клетка изображений является мощным инструментом для демонстрации функции и взаимодействие специфических белков, как они происходят в режиме реального времени. Методы, описанные в этой рукописи ясно показывают, что LTB 4 может вызвать быструю миграцию дендритных клеток. Эти ...
Раскрытие информации
Благодарности
Исследование поддержано Национальным институтом здоровья гранты АИ-52 381, CA138623 и Кентукки рака легких совета исследований и организационной поддержке со Джеймс Грэм Браун онкологический центр.
Материалы
| Name | Company | Catalog Number | Comments |
| Rat Basophilic Leukomia Cell line (RBL-2H3) or HEK293 cells. | ATCC | CRL-2256 | |
| Delbecco’s modified Eagle’s Medium (DMEM) | Invitrogen | 11995 | |
| Phenol red free RPMI or DMEM | Invitrogen | 11835-030 | |
| Fetal Bovine Serum | Invitrogen | 16000-044 | |
| L-Glutamine (200 mM) | Invitrogen | 25030 | |
| Penicillin-streptomycin (10000 U/mL) | Invitrogen | 15140 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300 | |
| HEPES (1M) | Invitrogen | 15630 | |
| 35 mm sterile glass coverslip-bottomed Fluoro dishes (0.17 mm thick) (WillCo-dish) | World Precision Instruments, Inc. | FD35-100 | |
| Sterile Gene Pulser Cuvette (0.4 cm electrode gap) (Bio-Rad) | Bio-Rad | 16552088 | |
| Gene Pulser II electroporater | Bio-Rad | ||
| TE-FM Epi-Fluorescence system attached to Nikon Inverted Microscope Eclipse TE300 | Nikon Instruments | ||
| Metamorph Software | Universal Imaging | ||
| Vertical Micro-pipette puller | Narishige International | ||
| Micro-Forge M-900 | Narishige International | ||
| Hadraulic Micromanipulator MO-188NE | Narishige International | ||
| Coarse Manual Manipulator, MN-188NE | Narishige International | ||
| cDNA constructs: | |||
| cDNA of G-Protein coupled receptor tagged with red fluorescence protein at C-terminus (hBLT1-RFP) | Jala et al 2005 | ||
| cDNA of cytosolic protein tagged with GFP (β-arrestin1-GFP in present study). | Jala et al 2005 |
Ссылки
- Wess, J. G-protein-coupled receptors: molecular mechanisms involved in receptor activation and selectivity of G-protein recognition. FASEB J. 11, 346-354 (1997).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21, 90-113 (2000).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Lefkowitz, R. J. G. protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J Biol Chem. 273, 18677-18680 (1998).
- Shenoy, S. K., Lefkowitz, R. J. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signalling. Biochem J. 375, 503-515 (2003).
- . Beta-arrest or. Nature. 383, 447-450 (1996).
- Serhan, C. N., Haeggstrom, J. Z., Leslie, C. C. Lipid mediator networks in cell signaling: update and impact of cytokines. Faseb J. 10, 1147-1158 (1996).
- Tager, A. M., Luster, A. D. BLT1 and BLT2: the leukotriene B(4) receptors. Prostaglandins Leukot Essent Fatty Acids. 69, 123-134 (2003).
- Toda, A., Yokomizo, T., Shimizu, T. Leukotriene B4 receptors. Prostaglandins Other Lipid Mediat. 68-69, 575-585 (2002).
- Haribabu, B. Targeted disruption of the leukotriene B(4) receptor in mice reveals its role in inflammation and platelet-activating factor-induced anaphylaxis. J Exp Med. 192, 433-438 (2000).
- Subbarao, K. Role of leukotriene B4 receptors in the development of atherosclerosis: potential mechanisms. Arterioscler Thromb Vasc Biol. 24, 369-375 (2004).
- Jala, V. R., Haribabu, B. Leukotrienes and atherosclerosis: new roles for old mediators. Trends Immunol. 25, 315-322 (2004).
- Heller, E. A. Inhibition of atherogenesis in BLT1-deficient mice reveals a role for LTB4 and BLT1 in smooth muscle cell recruitment. Circulation. 112, 578-586 (2005).
- Miyahara, N. Requirement for leukotriene B4 receptor 1 in allergen-induced airway hyperresponsiveness. Am J Respir Crit Care Med. 172, 161-167 (2005).
- Terawaki, K. Absence of leukotriene B4 receptor 1 confers resistance to airway hyperresponsiveness and Th2-type immune responses. J Immunol. 175, 4217-4225 (2005).
- Shao, W. H., Del Prete, A., Bock, C. B., Haribabu, B. Targeted disruption of leukotriene B4 receptors BLT1 and BLT2: a critical role for BLT1 in collagen-induced arthritis in mice. J Immunol. 176, 6254-6261 (2006).
- Kim, N. D., Chou, R. C., Seung, E., Tager, A. M., Luster, A. D. A unique requirement for the leukotriene B4 receptor BLT1 for neutrophil recruitment in inflammatory arthritis. J Exp Med. 203, 829-835 (2006).
- Jala, V. R., Shao, W. H., Haribabu, B. Phosphorylation-independent beta-arrestin translocation and internalization of leukotriene B4 receptors. J Biol Chem. 280, 4880-4887 (2005).
- Jala, V. R., Haribabu, B. Real-time analysis of G protein-coupled receptor signaling in live cells. Methods Mol Biol. 332, 159-165 (2006).
- Del Prete, A., A, . Regulation of dendritic cell migration and adaptive immune response by leukotriene B4 receptors: a role for LTB4 in up-regulation of CCR7 expression and function. Blood. 109, 626-631 (2007).
- Salogni, L. Activin A induces dendritic cell migration through the polarized release of CXC chemokine ligands 12 and 14. Blood. 113, 5848-5856 (2009).
- Boudreau, J., Koshy, S., Cummings, D., Wan, Y. Culture of myeloid dendritic cells from bone marrow precursors. J Vis Exp. , (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены