Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Real-time Imaging von Leukotrien B 4 Vermittelte Zellmigration und BLT1 Wechselwirkungen mit β-Arrestin
In diesem Artikel
Zusammenfassung
Dieses Papier beschreibt die Methodik auf die chemotaktische Reaktion von Leukozyten an spezifische Liganden zu bestimmen und zu identifizieren Wechselwirkungen zwischen den Rezeptoren auf der Zelloberfläche und zytosolischen Proteinen unter Verwendung von Live Cell Imaging Verfahren.
Zusammenfassung
G-Protein-gekoppelte Rezeptoren (GPCRs) gehören zu den sieben Transmembran-Protein-Familie und vermitteln die Transduktion der extrazellulären Signale an intrazelluläre Reaktionen. GPCRs Kontrolle vielfältigen biologischen Funktionen wie Chemotaxis, intrazellulären Calcium-Freisetzung, Genregulation in einem Liganden abhängigen Art und Weise über heterotrimeren G-Proteine 1-2. Ligandenbindung induziert eine Reihe von Konformationsänderungen führt zu einer Aktivierung der heterotrimeren G-Proteine, die Ebenen der Botenstoffe wie zyklisches Adenosinmonophosphat (cAMP), Inositol-Triphosphat (IP3) und Diacylglycerol (DG) modulieren. Einhergehend mit Aktivierung des Rezeptors Ligandenbindung löst auch eine Reihe von Veranstaltungen an den Rezeptor Signalgebung über Desensibilisierung, Zwangsverwaltung und / oder Internalisierung zu dämpfen. Die Desensibilisierung Prozess der GPCRs erfolgt über Rezeptor-Phosphorylierung durch G-Protein-Rezeptor-Kinasen (GRKs) und die anschließende Bindung von β-arrestins 3. β-arrestins sind cytosolische Proteine und Translokation zur Membran auf GPCR-Aktivierung, die Bindung an phosphorylierte Rezeptoren (meistens) gibt es durch die Erleichterung des Rezeptor-Internalisierung 4-6.
Leukotrien B 4 (LTB 4) ist ein pro-inflammatorischen Lipidmolekül aus Arachidonsäureweg und vermittelt seine Aktionen über GPCRs, LTB 4-Rezeptor 1 (BLT1, ein Rezeptor mit hoher Affinität) abgeleitet und LTB 4-Rezeptor-2 (BLT2, ein Rezeptor mit niedriger Affinität ) 7-9. Die LTB 4-BLT1 Weg hat sich gezeigt, kritisch zu sein in mehrere entzündliche Erkrankungen wie Asthma, Arthritis und Atherosklerose 10-17. Das vorliegende Papier beschreibt die Methoden entwickelt, um LTB 4-induzierte Leukozyten-Migration und die Wechselwirkungen von BLT1 mit β-Arrestin und Rezeptor-Translokation in lebenden Zellen mit Mikroskopie-Techniken 18-19 überwachen.
Knochenmark abgeleiteten dendritischen Zellen aus C57BL / 6 Mäuse wurden isoliert und kultiviert wie zuvor 20-21 beschrieben. Diese Zellen wurden im Live Cell Imaging-Methoden getestet, um LTB 4 induzierten Zellmigration zu demonstrieren. Der menschliche BLT1 wurde mit rot fluoreszierendes Protein (RFP-BLT1) am C-Terminus und β-arrestin1 mit grün fluoreszierende Protein (β-arr-GFP) markiert markiert und transfizierten der beiden Plasmide in Rat Basophile Leukomia (RBL-2H3)-Zelllinien 18-19. Die Kinetik der Wechselwirkung zwischen diesen Proteinen und Lokalisation wurden unter Verwendung lebender Zellen Video-Mikroskopie. Die Methoden in der aktuellen Papier beschreiben die Verwendung von mikroskopischen Techniken, um die funktionellen Antworten von G-Protein-gekoppelte Rezeptoren in lebenden Zellen zu untersuchen. Das vorliegende Papier beschreibt auch die Verwendung von Metamorph Software, um die Fluoreszenz-Intensitäten zu quantifizieren, um die Kinetik der Rezeptor und cytosolische Protein-Interaktionen zu bestimmen.
Protokoll
Methodik
Beschreibung von Mikroskop
Live Cell Imaging Experimente mit TE-FM Epi-Fluoreszenz-System an Nikon Inverses Mikroskop Eclipse-TE300. Das Mikroskop mit Heiztisch ausgestattet. Ein kühles Snap HQ digital B / W CCD (Roper Scientific) Kamera und LAMDA 10-2 optischen Filter-Wechsler (Sutter Instrument Company) ist Mikroskop angeschlossen. Anregungs-und Emissionswellenlänge mit Filter Räder kontrolliert und gesteuert von Lamba 10-2 Filterrad Controller sollte Sutter Instruments Co. Belichtungszeit 500 ms genug sein, um RFP oder GFP in lebende Zellen. Hardware-Steuerung und Erfassung von Bildern von Metamorph-Software gesteuert. Die Wahl der Filter für die vorliegende Studie, setzt Filter S480/20x, S525/40m und S565/25x, S620/60m für GFP und RFP zeigen; EGFP / DsRed Dual dichroitische, Chroma Technology. Das Filterrad bietet Platz für bis zu sechs Filter-Sets. Mikroskop ist mit Vor Proscan Bühne Controller mit Joy-Stick befestigt. Alle diese Hardware-Anhänge können von Metamorph-Software gesteuert werden. Das Mikroskop ist auch mit Mikromanipulatoren an der Mikropipetten zu halten.
A. Messung der Leukotrien B 4 Directed dendritische Zellen Migration
Mit den oben beschriebenen Mikroskop-Einstellung, entwickelten wir Methoden für die folgenden Liganden gerichtet dendritischen Zellen Migration in Echtzeit. Zwei Mikromanipulatoren (Narishige) sind an das Mikroskop angeschlossen. Die Chemotaxis von Knochenmark der Maus abgeleiteten dendritischen Zellen (BMDCs) in Richtung LTB 4 Gradient wurde aufgezeichnet. Hier beschreiben wir die Methoden der Mikro-Pipetten Vorbereitung mit Mikro-Pipette Puller, das Laden der Liganden in Mikro-Pipette und die Einrichtung der Chemotaxis Experiment auf der beheizten Bühne des Mikroskops zu direktionale Migration von Zellen zu überwachen. Diese Methode kann angewendet, um die Wirksamkeit verschiedener Lockstoffe bei der Induktion der Migration sowie Wirkung von Inhibitoren der Chemotaxis in lebenden Zellen zu testen. Die Isolierung von BMDCs 21 von Maus hat in mehreren Publikationen, darunter JoVE den 22. beschrieben.
1. Vorbereitung der BMDCs
- Plate BMDCs (nach Kultivierung für 10 Tage) auf das Deckglas unten Fluoro Teller und lassen sie für 16 Stunden vor dem Experiment zu wachsen.
- Waschen Sie die Zellen mit 3 ml 1X PBS mindestens 2-mal (durch Zugabe von 3 ml 1X PBS, um die Platte und das Absaugen des Puffers out).
- 2 ml des 1XPBS auf den Teller. Die Zellen sind nun bereit für das Experiment. Halten Sie die Zellen in 37 ° C Inkubator vor dem Experiment.
Vorbereitung der Ligand geladen Mikropipette:
- Fix die Glaskapillaren (Glass-Standard, 0,75 mm x 0,4 mm; 6 ", Kat. Nr. 625500, AM Systems, INC) auf der vertikalen Mikropipette Abzieher (Narishige International USA, Inc).
- Halten Sie die Temperatur bei 52 ° C und ermöglichen das Glas zu schmelzen und ziehen auseinander, um scharfe Kante Tipps zu bilden.
- Befestigen Sie die Pipette auf die Mikro-Pipettenhalter.
- Glätten Sie die Ecken und Kanten der Mikropipette mit Micro Schmiede M-900 (Narishige International USA, Inc) durch die Beobachtung unter dem Mikroskop.
- Bereiten Sie mindestens 10-20 Pipetten für jedes Experiment. Hinweis: Die Mikropipetten können auch von World Precision Instruments (μ TIP, T1801TW1F) erworben werden.
- Nehmen Sie gewünschte Konzentration (500 &mgr; l von 100 nM LTB 4 in der aktuellen Experiment) des Liganden in 1 mL effendorf Rohr und halten Sie die Mikro-Pipettenspitze in die Lösung und damit die Lösung in die Mikropipette (back-Füllung) geben.
- Nehmen Sie 1 mL von Ligand und in die Spritze (1 ccm Tuberkulin-Spritze) und langsam füllen den Liganden mit Micro-Fill-Nadel (MF 28G-5, World Precision Instruments) in Mikro-Pipette von oben.
- Befestigen Sie die Schläuche, die eng anliegt, um die Pipette zu Pipette und Schlauch zur Nadel (21 G 11 / 2), die an 1 ml-Spritze, die mit Liganden gefüllt ist.
- Nun vorsichtig bewegen den Liganden gefüllt Mikropipette auf dem Mikroskoptisch und fix auf Mikro-Manipulatoren.
- Bewerben wenig Druck aus der Spritze, um sicherzustellen, Ligand wird langsam freigesetzt von der Spitze.
- Bringen Sie die plattierten unreifen BMDCs an das Mikroskop und halten sie auf der Heizplatte (37 ° C) Bühne.
- Entfernen Sie den Deckel von Fluor Gericht.
- Fokussieren Sie die Zellen mit Hilfe von Öl-Immersion 60x Objektiv.
- Vorsichtig bringen die Liganden geladen Pipette mit 'Coarse Manuelle Manipulator MN-188NE "in die Nähe der Zellen.
- Fokussieren Sie die Pipette mit 'Hydraulic Feine Micromanipulator MN-188 NE'.
- Bewerben wenig Druck aus der Spritze, um sicherzustellen, dass Liganden in Schale freigesetzt.
- Stellen Sie die Bildaufnahme-Parameter, um in zu erwerben hellen eingereicht (10 ms Belichtungszeit) in alle 15 sec für 2 Stunden mit Metamorph-Software.
- Halten Sie die Überwachung alle 30 min für progression der Migration in Richtung Liganden.
- Wenn Zellen in Pipettenspitze sind überfüllt, ändern Sie die Position der Spitze in die Platte, um die Migration von Experiment fortzusetzen.
B. Messung der GPCR (BLT1) und cytosolische Protein (β-Arrestin) Wechselwirkungen, Translokation in lebenden Zellen
1. Präparation von Plasmid-DNA-Konstrukten
Die Details der DNA-Plasmid-Konstrukte wurden in Jala et al. (2005) 18 beschrieben.
2. Transfektion von humanen BLT1-RFP und β-Arrestin-GFP in RBL-2H3 Zellen
- Pflegen Sie die Ratte Basophile Leukomia (RBL-2H3) Cells (60 bis 70% Konfluenz) bei 37 ° C in einer befeuchteten Atmosphäre von 95% Luft, 5% CO 2 als Monolayer-Kulturen in Nährmedien (DMEM mit 15% FBS, 2 ergänzt mM L-Glutamin, 100 U / ml Penicillin und 100 ug / ml Streptomycin) in T75 Flaschen.
- Lösen Sie die Zellen aus der Schüssel / Fläschchen mit 6 ml Trypsin-EDTA (0,05% Trypsin, 0,53 mM EDTA) und Inkubation für 5 min bei 37 ° C in einer befeuchteten Atmosphäre von 95% Luft, 5% CO 2. Schütteln Sie die Flaschen auf den Umfang der Ablösung der Zellen zu überwachen.
- Add 6 mL des Wachstums Medien Kolben mit 6 ml Trypsin-EDTA und sammeln Sie die Zellen, indem man sie durch Auf-und Abpipettieren mehrfach. Übertragen Sie die Zellen in 15 mL Falcon-Röhrchen.
- Zählen Sie die Zellen mit Hilfe einer Zählkammer und nehmen Sie 4 x 10 6 Zellen in 15 mL Zentrifugenröhrchen und Zentrifuge bei 480g rpm für 3 min und Resuspendieren in 200 ul der Transfektion Medien (DMEM, 20% FBS, 50 mM HEPES). Wenn Sie bis 3 Transfektionen durchzuführen planen, bereiten Sie die Zellen und tranfection Medien entsprechend durch eine Erhöhung der Zellzahl und das Volumen der Transfektion Medium.
- Bereiten Sie die Plasmide auf die Konzentrationen von mindestens 1,5 ug / ul transfiziert werden. Wir bereiten die DNA-Plasmid mit QIAGEN Maxi-DNA-Plasmid-Kit. Fügen Sie die einzelnen oder beider Plasmid-DNA-Kodierung für die menschliche BLT1-RFP (25 ug) und β-arrestin1-GFP (15 ug) an sterile Elektrophorese Küvetten, (Bio-Rad # 16552088), die 0,4 cm Elektrodenabstand hat.
- Nehmen Sie 200 ul der oben resuspendierten Zellen und legen Sie sie in Küvetten, die entweder hBLT1-RFP oder β-arrestin1-GFP oder beide zusammen und mischen sie vorsichtig mit 1 ml sterilen Pipette.
- Verlassen Sie die oben Küvetten bei Raumtemperatur für 10 min.
- Elektroporieren die Zellen in Gene Pulser II mit 250 V und Kapazität 500 uF.
- Nach der Elektroporation lassen die Zellen bleiben bei Raumtemperatur für 10 min.
- Nehmen Sie 1 mL der regelmäßigen Wachstumsmedium und mischen Sie es mit elektroporiert Zellen in den Küvetten.
- Verteilen Sie 300 ul dieser Mischung in 35 mm Gewebe-Glasboden Kulturschalen (Fluoro Gericht, World Precision Instruments) mit 2 mL der regelmäßigen Wachstums Medien und inkubieren für 1 Stunde bei 37 ° C in einer angefeuchteten Atmosphäre von 95% Luft, 5% CO 2. Lassen Sie die Zellen zu Boden der Schale haften.
- Ersetzen Sie die Medien nach 1 h Inkubation mit regelmäßigen Nährmedien und ihnen erlauben bei 37 ° C wachsen in einer angefeuchteten Atmosphäre von 95% Luft, 5% CO 2-Inkubator für 18-24 Stunden.
3. Live Cell Imaging
Erwerb von Bildern
- Nach 18-24 Stunden, waschen Sie die Zellen 2 oder 3 mal mit 2 ml warmes Phenolrot freien RPMI mit 10 mM HEPES, pH 7,55 (2 ml des warmen Medien direkt auf den Teller und saugen Medien. Wiederholen Sie 2 oder 3 mal). Fügen Sie 1,8 ml warmes Phenolrot freien RPMI mit 10 mM HEPES.
- Platz 30 mm Deckglas-Boden Kulturschalen mit RBL-2H3-Zellen, mit hBLT1-RFP und β-arrestin1-GFP auf der beheizten Mikroskoptisch (37 ° C) transfiziert.
- Sammeln Sie die Zelle Bilder bei 600x Vergrößerung mit 60 X Ziel Nikon Plan Apo 60X/1.4 numerische Apertur Ölimmersion (erhältlich in unserem Mikroskop-System).
- Setzen Sie einen Öltropfen auf dem 60 x Objektiv Linse und konzentrieren sich die Zellen mit regelmäßigen Hellfeld Durchlicht durch Berühren der Unterseite der Platte.
- Zur Überwachung der Fluoreszenz der transfizierten Proteine, Wechsel von Hellfeld (Durchlicht) zur Fluoreszenz-Filter (RFP-Filter, wenn Sie Rezeptor oder GFP zu sehen, wenn Sie β-arrestin1 sehen wollen).
- Wählen Sie die hellen und gesunden Zelle, die hBLT1-RFP drückt auf der Zelloberfläche mit RFP-Filter und das Bild aufzunehmen.
- Dann GFP-Filter Verschiebung und stellen Sie sicher, dass β-Arrestin-GFP im Zytoplasma exprimiert und das Bild aufzunehmen. Dann pseudo Farbe sowohl die Bilder, vor der Aufnahme Zeit zu leben Zelle Bilder erloschen, um sicherzustellen, dass Durchscheinen der Fluoreszenz ist nicht an, die zwischen RFP und GFP.
- Sobald die Wahl der Ihr Handy aus, legen Sie die Parameter entsprechend Ihren Zweck mit einer Software (Metamorph Software in diesem Fall).
- In der aktuellen Demo sind sechzehn Bit-Bilder mit dem kam erworbenra Binning auf 1 X 1 mit 60 X Ziel Nikon Plan Apo 60X/1.4 numerische Apertur Ölimmersion kombiniert.
- Sammeln Sie die Fluoreszenzbilder für RFP und GFP Fluorochrome gleichzeitig bei 30 sec Zeitabstand (wenn die Translokation / Interaktionen zu schnell sind, kann man die Zeitintervalle zu reduzieren) dieser mit Filterräder von Metamorph-Software gesteuert.
- Die Kamera Belichtungszeiten auf 1000 msec für RFP und GFP. (Stellen Sie den spezifischen Belichtungszeiten entsprechend der Fluoreszenzintensität von RFP und GFP).
- Zunächst sammeln die Bilder für 1 min ohne Zugabe von Liganden, die als 0 Zeitpunkt dient.
- Fügen Sie die 200 ul von Ligand (ab Lager von 10 pM bis zu einer Endkonzentration von 1 M) nach 1 min, ohne die Platte / oder Zell-Position.
- Die Fluoreszenz-Bilder werden für 60 min nach der Zugabe des Liganden gesammelt und gespeichert als TIFF-Bilder mit aufsteigender Reihenfolge der Dateinamen.
- Alle diese Dateien können als Stapel-Dateien mit individuellen / kombiniert Fluoreszenzbilder mit Zeitstempeln mit der Software vorgenommen werden.
Prozess von Bildern und Quantifizierung der Fluoreszenz von Proteinen und Lokalisierung
- Erwerben Sie die Bilder mit Normalpapier (keine Zellen) mit RFP und GFP Fluoreszenz-Filter und speichern Sie sie als Hintergrundbilder. Verwenden Sie diese Bilder von den tatsächlichen Daten erhaltenen Bilder oben abziehen.
- Bereiten Sie den Stapel von Bildern individuell für RFP und GFP Bilder.
- Select / definieren die verschiedenen Regionen (Oberfläche vs cytosolische), um die Fluoreszenz-Intensität des RFP und GFP (BLT1 und β-Arrestin Translokation) messen
- Zeichnen Sie die Menge Fluoreszenzintensitäten als Funktion der Zeit. Dieser Graph wird den Informationen über die Kinetik der Translokation von bestimmten Moleküls.
Repräsentative Ergebnisse
A. Messung der Leukotrien B 4 Directed dendritische Zellen Migration
Die Methode in diesem Protokoll beschrieben wurde verwendet, um die dendritischen Zellen die Migration in Richtung Leukotrien B 4 (Abbildung 1 und die angeschlossenen Video-1) 21 zu bestimmen. Wir können gelten ähnliche Methodik auf die chemotaktische Fähigkeit von Zellen, um einen bestimmten Liganden in lebenden Zellen zu bestimmen.
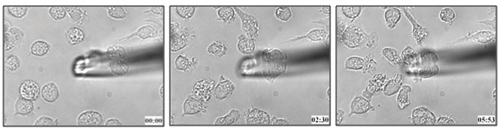
Abbildung 1. Knochenmark der Maus abgeleiteten dendritischen Zellen Migration hin zu 100 nM LTB 4.
Video 1. Live Zellmigration von BMDCs Richtung LTB 4. Klicken Sie hier, um Video zu sehen .
B. Messung der GPCR (BLT1) und cytosolische Protein (β-Arrestin) Wechselwirkungen, Translokation in lebenden Zellen
Nach Abschluss dieses Verfahrens kann man die folgenden Informationen in GPCR Signalwege.
- Die Lokalisierung von GPCR-und zytosolischen Proteinen und Kern (Abbildung 2).
- Ligand induzierten Interaktion von Oberflächen GPCR (BLT1 in diesem Fall) mit cytosolischen Protein (β-Arrestin in diesem Fall) (Abb. 3).
- Kinetik der Rezeptor-Internalisierung und β-Arrestin Translokation zur Membran durch Internalisierung zusammen mit Rezeptoren (Abbildung 4) (Jala et al. 2005) 18 gefolgt.
- Man kann bestimmen, der Ligand-Rezeptor-abhängige Aktivierung Status in lebenden Zellen (beigefügten Video 2) und bestimmen kritische Motive oder Prozesse in der Rezeptor-Aktivierung (Jala et al. 2005) 18 beteiligt.
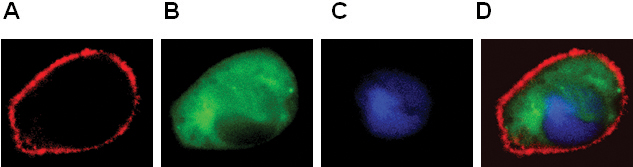
Abbildung 2. Expression von BLT1-RFP (A), β-Arrestin-GFP (B), pNuc-CFP (C) in RBL-2H3-Zellen. Farbe kombinierte Bild in Panel D gezeigt
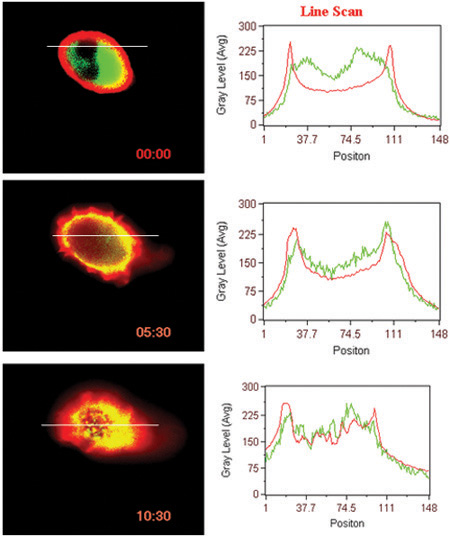
Abbildung 3. Ligand induzierte Translokation des Rezeptors und β-Arrestin. Zeilenkameras der Fluoreszenz-Intensitäten in den Zellen angezeigt werden.
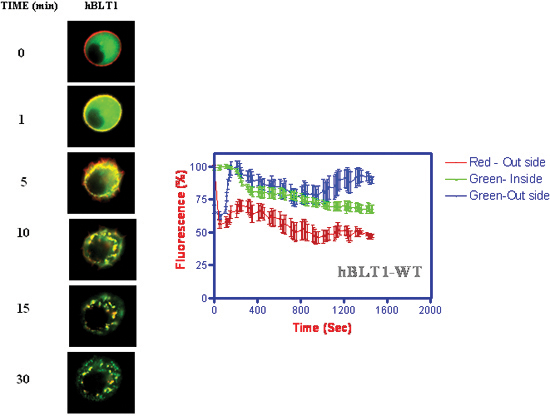
Abbildung 4. Kinetik der Rezeptor-Internalisierung und β-Arrestin-Translokation bei der Zugabe von 1 uM LTB 4. Die Fluoreszenzintensitäten wurden als eine Funktion der Zeit an der Membran und cytosolische Standorte der Zelle gemessen.
Video 2 Live Bildgebung von Zellen, die BLT1-RFP und β-Arrestin-GFP bei der Zugabe von 1 uM LTB 4. Klicken Sie hier, um Video anzuschauen
Diskussion
Live Cell Imaging ist ein leistungsfähiges Werkzeug, um die Funktion und Wechselwirkungen der Proteine, wie sie in real-time auftreten zu demonstrieren. Die Methoden in diesem Manuskript beschrieben zeigen deutlich, dass LTB 4 kann eine schnelle Migration von dendritischen Zellen zu induzieren. Diese Methoden erweitern nicht nur die Aspekte der LTB 4-Funktion, um diverse Zelltypen, erlauben sie ähnliche Methoden, um eine Vielzahl von anderen Chemokinen angewendet werden und Prüfung ihrer Wirksam...
Offenlegungen
Danksagungen
Die Forschung wird von den National Institutes of Health gewährt AI-52381, CA138623 und Kentucky Lung Cancer Research Board und institutionelle Unterstützung von James Graham Brown Cancer Center unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Rat Basophilic Leukomia Cell line (RBL-2H3) or HEK293 cells. | ATCC | CRL-2256 | |
| Delbecco’s modified Eagle’s Medium (DMEM) | Invitrogen | 11995 | |
| Phenol red free RPMI or DMEM | Invitrogen | 11835-030 | |
| Fetal Bovine Serum | Invitrogen | 16000-044 | |
| L-Glutamine (200 mM) | Invitrogen | 25030 | |
| Penicillin-streptomycin (10000 U/mL) | Invitrogen | 15140 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300 | |
| HEPES (1M) | Invitrogen | 15630 | |
| 35 mm sterile glass coverslip-bottomed Fluoro dishes (0.17 mm thick) (WillCo-dish) | World Precision Instruments, Inc. | FD35-100 | |
| Sterile Gene Pulser Cuvette (0.4 cm electrode gap) (Bio-Rad) | Bio-Rad | 16552088 | |
| Gene Pulser II electroporater | Bio-Rad | ||
| TE-FM Epi-Fluorescence system attached to Nikon Inverted Microscope Eclipse TE300 | Nikon Instruments | ||
| Metamorph Software | Universal Imaging | ||
| Vertical Micro-pipette puller | Narishige International | ||
| Micro-Forge M-900 | Narishige International | ||
| Hadraulic Micromanipulator MO-188NE | Narishige International | ||
| Coarse Manual Manipulator, MN-188NE | Narishige International | ||
| cDNA constructs: | |||
| cDNA of G-Protein coupled receptor tagged with red fluorescence protein at C-terminus (hBLT1-RFP) | Jala et al 2005 | ||
| cDNA of cytosolic protein tagged with GFP (β-arrestin1-GFP in present study). | Jala et al 2005 |
Referenzen
- Wess, J. G-protein-coupled receptors: molecular mechanisms involved in receptor activation and selectivity of G-protein recognition. FASEB J. 11, 346-354 (1997).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21, 90-113 (2000).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Lefkowitz, R. J. G. protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J Biol Chem. 273, 18677-18680 (1998).
- Shenoy, S. K., Lefkowitz, R. J. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signalling. Biochem J. 375, 503-515 (2003).
- . Beta-arrest or. Nature. 383, 447-450 (1996).
- Serhan, C. N., Haeggstrom, J. Z., Leslie, C. C. Lipid mediator networks in cell signaling: update and impact of cytokines. Faseb J. 10, 1147-1158 (1996).
- Tager, A. M., Luster, A. D. BLT1 and BLT2: the leukotriene B(4) receptors. Prostaglandins Leukot Essent Fatty Acids. 69, 123-134 (2003).
- Toda, A., Yokomizo, T., Shimizu, T. Leukotriene B4 receptors. Prostaglandins Other Lipid Mediat. 68-69, 575-585 (2002).
- Haribabu, B. Targeted disruption of the leukotriene B(4) receptor in mice reveals its role in inflammation and platelet-activating factor-induced anaphylaxis. J Exp Med. 192, 433-438 (2000).
- Subbarao, K. Role of leukotriene B4 receptors in the development of atherosclerosis: potential mechanisms. Arterioscler Thromb Vasc Biol. 24, 369-375 (2004).
- Jala, V. R., Haribabu, B. Leukotrienes and atherosclerosis: new roles for old mediators. Trends Immunol. 25, 315-322 (2004).
- Heller, E. A. Inhibition of atherogenesis in BLT1-deficient mice reveals a role for LTB4 and BLT1 in smooth muscle cell recruitment. Circulation. 112, 578-586 (2005).
- Miyahara, N. Requirement for leukotriene B4 receptor 1 in allergen-induced airway hyperresponsiveness. Am J Respir Crit Care Med. 172, 161-167 (2005).
- Terawaki, K. Absence of leukotriene B4 receptor 1 confers resistance to airway hyperresponsiveness and Th2-type immune responses. J Immunol. 175, 4217-4225 (2005).
- Shao, W. H., Del Prete, A., Bock, C. B., Haribabu, B. Targeted disruption of leukotriene B4 receptors BLT1 and BLT2: a critical role for BLT1 in collagen-induced arthritis in mice. J Immunol. 176, 6254-6261 (2006).
- Kim, N. D., Chou, R. C., Seung, E., Tager, A. M., Luster, A. D. A unique requirement for the leukotriene B4 receptor BLT1 for neutrophil recruitment in inflammatory arthritis. J Exp Med. 203, 829-835 (2006).
- Jala, V. R., Shao, W. H., Haribabu, B. Phosphorylation-independent beta-arrestin translocation and internalization of leukotriene B4 receptors. J Biol Chem. 280, 4880-4887 (2005).
- Jala, V. R., Haribabu, B. Real-time analysis of G protein-coupled receptor signaling in live cells. Methods Mol Biol. 332, 159-165 (2006).
- Del Prete, A., A, . Regulation of dendritic cell migration and adaptive immune response by leukotriene B4 receptors: a role for LTB4 in up-regulation of CCR7 expression and function. Blood. 109, 626-631 (2007).
- Salogni, L. Activin A induces dendritic cell migration through the polarized release of CXC chemokine ligands 12 and 14. Blood. 113, 5848-5856 (2009).
- Boudreau, J., Koshy, S., Cummings, D., Wan, Y. Culture of myeloid dendritic cells from bone marrow precursors. J Vis Exp. , (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten