É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Em tempo real de imagens de leucotrienos B 4 Migração mediada por células e BLT1 Interações com β-arrestina
Neste Artigo
Resumo
Este artigo descreve a metodologia para determinar a resposta quimiotática de leucócitos para ligantes específicos e identificar as interações entre os receptores da superfície celular e as proteínas citosólicas usando técnicas de imagem de células vivas.
Resumo
Receptores acoplados à proteína G (GPCRs) pertencem à família de proteínas transmembrana sete e mediar a transdução de sinais extracelulares de respostas intracelulares. GPCRs controle de diversas funções biológicas, como quimiotaxia, liberação de cálcio intracelular, regulação de genes de uma forma ligante dependente via heterotrimeric G-proteínas 1-2. Ligante de ligação induz uma série de mudanças conformacionais levando à ativação de heterotrimeric G-proteínas que modulam níveis de segundos mensageiros como a adenosina monofosfato cíclico (cAMP), o trifosfato de inositol (IP3) e glicerol diacyl (DG). Concomitante com a ativação da ligação ligante receptor também inicia uma série de eventos para atenuar o receptor de sinalização por meio de seqüestro de dessensibilização, e / ou internalização. O processo de dessensibilização dos GPCRs ocorre através de fosforilação do receptor de quinases da proteína G-receptor (GRKs) e subsequente ligação dos β-arrestinas 3. β-arrestinas são proteínas citosólicas e translocar para a membrana após a ativação GPCR, ligação aos receptores fosforilados (maioria dos casos) há, facilitando a internalização dos receptores 4-6.
Leucotrieno B 4 (LTB 4) é uma molécula de lipídio pró-inflamatórias derivadas de ácido araquidônico via e medeia suas ações através de GPCRs, LTB 4 receptor 1 (BLT1; um receptor de alta afinidade) e receptor LTB 4 2 (BLT2; um receptor de baixa afinidade ) 7-9. A LTB via 4-BLT1 foi mostrado para ser crítico em várias doenças inflamatórias, incluindo, artrite, asma e aterosclerose 10-17. O presente artigo descreve as metodologias desenvolvidas para monitorar LTB 4 induzida migração de leucócitos e as interações de BLT1 com β-arrestina e, a translocação do receptor em células vivas usando técnicas de microscopia de imagem 18-19.
Derivadas da medula óssea células dendríticas de camundongos C57BL / 6 foram isoladas e cultivadas como descrito anteriormente 20-21. Essas células foram testados em métodos de imagem ao vivo de células para demonstrar LTB 4 migração celular induzida. O BLT1 humano foi marcado com uma proteína fluorescente vermelha (BLT1-RFP) no C-terminal e β-arrestin1 marcados com proteína fluorescente verde (β-arr-GFP) e os plasmídeos transfectados em ambos os Rat basofílico Leukomia (RBL-2H3) linhas celulares 18-19. A cinética de interação entre essas proteínas e localização foram monitorados através de microscopia de vídeo ao vivo da célula. As metodologias no presente trabalho descrevem o uso de técnicas microscópicas para investigar as respostas funcionais do G receptores acoplados à proteína em células vivas. O presente artigo também descreve o uso de Metamorph software para quantificar a intensidade de fluorescência para determinar a cinética do receptor e interações proteína citosólica.
Protocolo
Metodologia
Descrição do Microscópio
Experimentos com imagens ao vivo celular realizado TE-FM sistema Epi-Fluorescência anexado ao microscópio invertido Nikon Eclipse TE300. O microscópio equipado com estágio de aquecimento. A HQ digital de pressão fresca B / W CCD (Roper Scientific) câmera e LAMDA 02/10 óptico filtro changer (Sutter empresa instrumento) é anexado ao microscópio. Comprimentos de onda de excitação e emissão são controlados com rodas de filtros e controlado por controlador de roda Lamba 02/10 filtro, Sutter Instruments Co. tempo de exposição de 500 ms deve ser o suficiente para ver RFP ou GFP em células vivas. Controle de hardware e aquisição de imagens são controladas por software Metamorph. A escolha dos filtros para o presente estudo são, filtro define S480/20x, S525/40m e S565/25x, S620/60m para GFP e RFP, respectivamente; EGFP / DsRed dupla Tecnologia, dicróicas Chroma. Esta roda de filtros podem acomodar até seis conjuntos de filtros. Microscópio está ligado com o controlador fase anterior Proscan com vara Joy. Todos esses anexos hardware pode ser controlado por software Metamorph. O microscópio também está ligado com micromanipuladores para segurar o micropipetas.
A. Medição dos leucotrienos B 4 Migração de Células Dendríticas Direção
Utilizando a definição de microscópio acima descrito, desenvolvemos métodos para seguir ligante migração de células dendríticas dirigido em tempo real. Dois micromanipuladores (Narishige) estão ligados ao microscópio. A quimiotaxia de medula óssea de camundongos derivados células dendríticas (BMDCs) em direção a LTB gradiente 4 foi gravado. Aqui, descrevemos os métodos para preparar as pipetas micro, utilizando micro-pipeta extrator, o carregamento do ligante em micro-pipeta e configurar o experimento quimiotaxia no palco aquecida do microscópio para monitorar a migração direcional das células. Este método pode ser aplicado para testar a eficácia de quimioatrativos distintas na indução de migração, bem como efeito de inibidores da quimiotaxia em células vivas. O isolamento de BMDCs 21 de rato tem sido descrita em várias publicações, incluindo JOVE 22.
1. Preparação de BMDCs
- Placa do BMDCs (após o cultivo por 10 dias) para a tampa prato Fluoro deslizamento inferior e permitir-lhes crescer por 16 hr antes do experimento.
- Lavar as células com 3 ml de 1X PBS, pelo menos, duas vezes (pela adição de 3 ml de 1X PBS a placa e aspiração para fora buffer).
- Adicionar 2 mL de 1XPBS ao prato. As células estão prontas para o experimento. Manter as células em 37 ° C incubadora antes de experimentar.
Preparação do ligante carregado micro pipeta:
- Fixar a tubos capilares de vidro (Glass padrão, 0,75 mm x 0,4 mm; 6 ", Cat # 625500, AM Systems, INC) na vertical micropipeta extrator (Narishige Internacional EUA, Inc).
- Manter a temperatura a 52 ° C e deixe o vidro para derreter e se separam para formar dicas borda afiada.
- Corrigir a pipeta no suporte micro-pipeta.
- Suavizar as arestas de micro pipeta usando Micro forjar M-900 (Narishige Internacional EUA, Inc), observando ao microscópio.
- Prepare pelo menos 10-20 pipetas para cada experimento. Nota: As micropipetas também pode ser comprado de Instrumentos de Precisão Mundial (TIP μ, T1801TW1F).
- Tome concentração desejada (500 mL de 100 nM LTB 4 na experiência atual) do ligante em um tubo de effendorf mL e manter a ponta da pipeta micro na solução e permitir que a solução para entrar no micro pipeta (back enchimento).
- Tome 1 mL de ligante e com a seringa (1 cc de tuberculina seringa) e, lentamente, preencher o ligante utilizando Micro-Fill agulha (28G MF-5, instrumentos de precisão World) em micro pipeta de cima.
- Conecte o tubo, que se encaixa bem para a pipeta para pipeta e tubo para agulha (21 G 02/11) acoplado a seringa de 1 mL, que é preenchido com ligante.
- Agora, cuidadosamente mover o ligante cheia micro-pipeta para o estágio do microscópio e corrigir para manipuladores micro.
- Aplique pouca pressão da seringa para fazer ligante certeza é liberando lentamente a partir da ponta.
- Trazer o BMDCs banhado imaturo para o microscópio e mantê-los na chapa aquecida (37 ° C) palco.
- Remova a tampa do prato fluoro.
- Foco as células usando óleo de imersão lente objetiva 60X.
- Cuidadosamente, derrubar o ligante carregado pipeta usando 'Coarse manual Manipulator MN-188NE' à proximidade das células.
- O foco da pipeta usando 'micromanipulador hidráulico Belas MN-188 NE.
- Aplique pouca pressão da seringa para se certificar de que ligante está lançando no prato.
- Definir os parâmetros de aquisição de imagem para adquirir em brilhante arquivado (10 a exposição ms) em cada 15 segundos durante 2 horas usando software Metamorph.
- Manter monitoramento a cada 30 minutos para progression de migração para ligante.
- Se as células estão lotados na ponta da pipeta, alterar a localização da ponta da placa para continuar a migração de experiência.
B. Medição GPCR (BLT1) e proteína citosólica (β-arrestina) Interações, Translocação em células vivas
1. Preparação de DNA plasmidial Constrói
Os detalhes de construções de DNA plasmidial foram descritas em Jala et al. (2005) 18.
2. Transfecção de Human BLT1-RFP e β-Arrestina-GFP em Células RBL-2H3
- Manter o Rat basofílico Leukomia (RBL-2H3) Cells (60 a 70% confluência) a 37 ° C em atmosfera húmida do ar de 95%, 5% de CO 2 como culturas em monocamada em meio de crescimento (DMEM suplementado com 15% FBS, 2 mM L-glutamina, 100 U / mL de penicilina e 100 mg / mL de estreptomicina) em frascos T75.
- Separar as células do prato / frascos usando 6 mL de tripsina-EDTA (0,05% de tripsina, 0,53 mM EDTA) e incubação por 5 min a 37 ° CO C em atmosfera húmida do ar de 95%, 5% 2. Agite suavemente o frasco para acompanhar o grau de descolamento das células.
- Adicionar 6 mL de meio de crescimento para frasco contendo 6 mL de tripsina-EDTA e coletar as células, misturando-os por pipetagem cima e para baixo várias vezes. Transferência de células em tubos de 15 mL falcão.
- Contar as células usando um hemocitômetro e tomar 4 x 10 6 células em tubos de 15 mL de centrífuga e centrifugar a 480g rpm por 3 minutos e ressuspender em 200 mL de mídia transfecção (DMEM, FBS 20%, 50 mM HEPES). Se você pretende realizar 3 transfections, prepare as células e mídia tranfection nesse sentido pelo número de células e aumentando o volume de meio de transfecção.
- Prepare os plasmídeos a serem transfectadas nas concentrações de, pelo menos, 1,5 mcg / mL. Nós preparamos o DNA plasmidial usando DNA QIAGEN Maxi kit plasmídeo. Adicionar o indivíduo ou a codificação DNAs plasmídeo para humanos BLT1-RFP (25 mg) e β-arrestin1-GFP (15 mg) para cubetas eletroforese estéril, (Bio-Rad # 16552088), que tem 0,4 distância entre os eléctrodos cm.
- Tome 200 mL das células acima ressuspenso e colocá-los em cubetas contendo um ou outro hBLT1-RFP ou β-arrestin1-GFP ou os dois juntos e misture-os suavemente com uma pipeta mL estéril.
- Deixe o cubetas acima em temperatura ambiente por 10 min.
- Electroporate as células do Gene Pulser II com tensão de 250 V e capacidade de 500 mF.
- Depois de deixar o eletroporação células permanecem em temperatura ambiente por 10 min.
- Tome 1 mL de meio de crescimento regular e misturá-lo com células electroporated na cubetas.
- Distribuir 300 mL desta mistura em 35 milímetros de tecido de vidro pratos fundo de cultura (prato Fluoro, instrumentos de precisão World) contendo 2 ml de meio de crescimento regular e incubar por 1 hora a 37 ° C em atmosfera húmida do ar de 95%, 5% de CO 2. Permitir que as células a aderir ao fundo do prato.
- Substituir a mídia após 1 h de incubação com meio de crescimento regular e permitir que eles crescem a 37 ° C em atmosfera húmida do ar de 95%, 5% incubadora de CO 2 por 18-24 horas.
3. Imagens de células vivas
Aquisição de imagens
- Após 18-24 horas, lave a 2 células ou 3 vezes com 2 ml de vermelho de fenol livre quentes RPMI contendo 10 mM HEPES, pH 7.55 (Adicionar 2 mL de mídia quente diretamente a placa e media aspirar. Repita 2 ou 3 vezes). Adicionar 1,8 mL de vermelho de fenol livre quentes RPMI contendo 10 mM HEPES.
- Coloque 30 milímetros de vidro de fundo lamela placas de cultura contendo células RBL-2H3, transfectadas com hBLT1-RFP e β-arrestin1-GFP no palco microscópio aquecida (37 ° C).
- Recolher as imagens das células em aumento de 600x usando 60 X objectiva Nikon Plano de Apo 60X/1.4 numérica abertura da lente de imersão em óleo (disponível em nosso sistema de microscópio).
- Coloque uma gota de óleo na lente objetiva 60 x e foco as células com campo claro regulares de luz transmitida ao tocar o fundo do prato.
- Para monitorar a fluorescência de proteínas transfectadas, mudar de campo claro (luz transmitida) para filtros de fluorescência (RFP filtro, se você quiser ver receptor ou GFP, se você quiser ver β-arrestin1).
- Escolha a célula brilhantes e saudáveis, que expressa hBLT1-RFP na superfície da célula usando RFP filtro e capturar a imagem.
- Em seguida, mudar para GFP filtro e certifique-se que β-arrestina-GFP expressa no citoplasma e capturar a imagem. Então cor pseudo tanto as imagens, antes que o tempo decorrido capturar imagens de células vivas para se certificar de que sangram através da fluorescência não está tomando ocorrendo entre RFP e GFP.
- Uma vez que a escolha de seu celular feito, definir os parâmetros de acordo com seu propósito usando software (Software Metamorph neste caso).
- Na demonstração atual, dezesseis imagens bit são adquiridos com o veiora definir binning a 1 X 1 combinado com 60 X Plano Nikon objetivo Apo 60X/1.4 numérica abertura da lente de imersão em óleo.
- Recolher as imagens de fluorescência para RFP e fluorocromos GFP simultaneamente em intervalos de 30 segundos de tempo (se as interações translocação / são muito rápido, pode-se reduzir os intervalos de tempo) dessas rodas usando filtro controlado por software Metamorph.
- Os tempos de exposição da câmera definido para 1000 ms para RFP e GFP. (Definir o tempo de exposição específica de acordo com a intensidade de fluorescência da GFP e RFP).
- Primeiro coletar as imagens para 1 min, sem adição de ligante, que serve como ponto 0 tempo.
- Adicione o mL 200 de ligante (do estoque de 10 mM para uma concentração final de 1 mM), após 1 min sem perturbar a placa / ou posição da célula.
- As imagens de fluorescência são colhidos por 60 min após a adição do ligante e armazenados como imagens TIFF com a ordem crescente dos nomes de arquivo.
- Todos esses arquivos podem ser feitos como arquivos de pilha com individual / combinado imagens de fluorescência com selos de tempo usando o software.
Processo de imagens e quantificação da fluorescência de proteínas e de localização
- Adquirir as imagens com os meios simples (sem células) com RFP e GFP filtros fluorescentes e salvá-los como imagens de fundo. Usar essas imagens para subtrair a partir de imagens reais de dados obtidos acima.
- Prepare a pilha de imagens individualmente para imagens RFP e GFP.
- Selecione / define as várias regiões (superfície vs citosólica) para medir a intensidade de fluorescência da GFP e RFP (BLT1 e β-arrestina translocação)
- Plot as intensidades de fluorescência quantidade como a função do tempo. Este gráfico irá fornecer as informações sobre a cinética de translocação de determinada molécula.
Resultados representante
A. Medição dos leucotrienos B 4 Migração de Células Dendríticas Direção
O método descrito neste protocolo foi utilizado para determinar a migração de células dendríticas para leucotrieno B 4 (Figura 1 e vídeo em anexo 1) 21. Podemos aplicar metodologia semelhante para determinar a capacidade quimiotática de células para um ligante específico em células vivas.
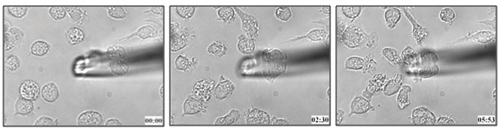
Figura 1. Medula óssea do rato derivados da migração de células dendríticas para 100 nM LTB 4.
Vídeo 1. Viva a migração celular de BMDCs para LTB 4. Clique aqui para ver o vídeo .
B. Medição GPCR (BLT1) e proteína citosólica (β-arrestina) Interações, Translocação em células vivas
Após a conclusão deste procedimento, pode-se obter as seguintes informações em eventos GPCR sinalização.
- A localização de GPCR e proteínas citosólicas e núcleo (Figura 2).
- Interação ligante induzida da superfície GPCR (BLT1 neste caso) com proteína citosólica (β arrestina, neste caso) (Fig. 3).
- Cinética da internalização de receptores e β-arrestina translocação para membrana seguida de internalização, juntamente com os receptores (Figura 4) (Jala et al. 2005) 18.
- Pode-se determinar o status de ativação ligante dependente de receptores em células vivas (em anexo video 2) e determinar motivos críticos ou processos envolvidos na ativação do receptor (Jala et al. 2005) 18.
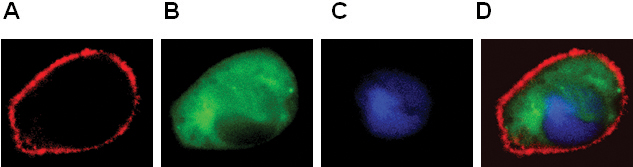
Figura 2. Expressão de BLT1-RFP (A), β-arrestina-GFP (B), pNuc-PCP (C) em células RBL-2H3. Imagem da cor combinada mostrado no painel de D.
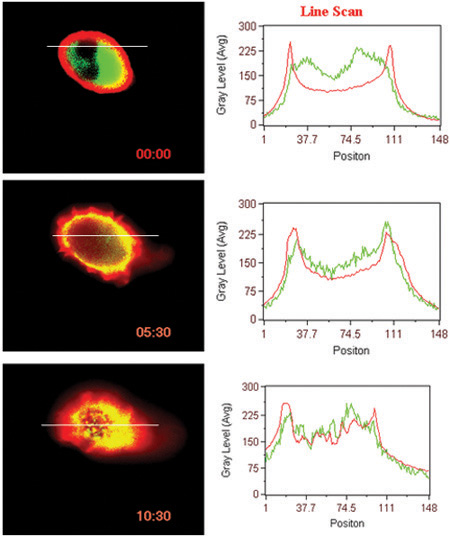
Figura 3. Translocação Ligand induzida do receptor e β arrestina. Scan linha de intensidades de fluorescência nas células são mostrados.
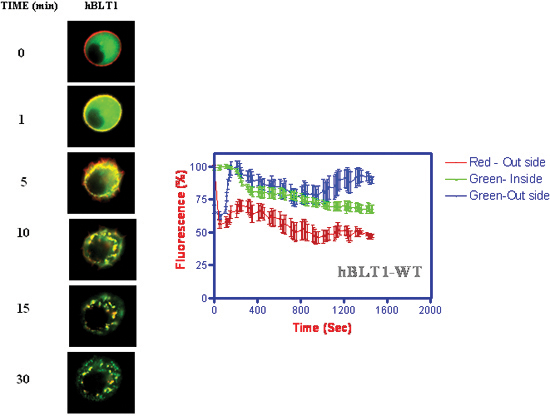
Figura 4. Cinética de internalização de receptores e β-arrestina translocação com a adição de 1 mM LTB 4. As intensidades de fluorescência foram medidos em função do tempo na membrana e locais citosólicos da célula.
Imagens de vídeo ao vivo de duas células que expressam BLT1-RFP e β-arrestina-GFP sobre a adição de 1 mM LTB 4. Clique aqui para assistir ao vídeo
Discussão
Imagens de células vivas é uma poderosa ferramenta para demonstrar a função e interações de proteínas específicas à medida que ocorrem em tempo real. Os métodos descritos neste manuscrito mostram claramente que a LTB 4 pode induzir a migração rápida de células dendríticas. Estes métodos não só ampliar os aspectos da função LTB 4 a diversos tipos de células, eles permitem que métodos semelhantes para ser aplicado a uma variedade de quimiocinas e outros testes de sua eficácia c...
Divulgações
Agradecimentos
A pesquisa é suportada pelo National Institutes of Health bolsas AI-52381, CA138623 e Lung Cancer Research Board Kentucky e apoio institucional de James Graham Brown Cancer Center.
Materiais
| Name | Company | Catalog Number | Comments |
| Rat Basophilic Leukomia Cell line (RBL-2H3) or HEK293 cells. | ATCC | CRL-2256 | |
| Delbecco’s modified Eagle’s Medium (DMEM) | Invitrogen | 11995 | |
| Phenol red free RPMI or DMEM | Invitrogen | 11835-030 | |
| Fetal Bovine Serum | Invitrogen | 16000-044 | |
| L-Glutamine (200 mM) | Invitrogen | 25030 | |
| Penicillin-streptomycin (10000 U/mL) | Invitrogen | 15140 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300 | |
| HEPES (1M) | Invitrogen | 15630 | |
| 35 mm sterile glass coverslip-bottomed Fluoro dishes (0.17 mm thick) (WillCo-dish) | World Precision Instruments, Inc. | FD35-100 | |
| Sterile Gene Pulser Cuvette (0.4 cm electrode gap) (Bio-Rad) | Bio-Rad | 16552088 | |
| Gene Pulser II electroporater | Bio-Rad | ||
| TE-FM Epi-Fluorescence system attached to Nikon Inverted Microscope Eclipse TE300 | Nikon Instruments | ||
| Metamorph Software | Universal Imaging | ||
| Vertical Micro-pipette puller | Narishige International | ||
| Micro-Forge M-900 | Narishige International | ||
| Hadraulic Micromanipulator MO-188NE | Narishige International | ||
| Coarse Manual Manipulator, MN-188NE | Narishige International | ||
| cDNA constructs: | |||
| cDNA of G-Protein coupled receptor tagged with red fluorescence protein at C-terminus (hBLT1-RFP) | Jala et al 2005 | ||
| cDNA of cytosolic protein tagged with GFP (β-arrestin1-GFP in present study). | Jala et al 2005 |
Referências
- Wess, J. G-protein-coupled receptors: molecular mechanisms involved in receptor activation and selectivity of G-protein recognition. FASEB J. 11, 346-354 (1997).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21, 90-113 (2000).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Lefkowitz, R. J. G. protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J Biol Chem. 273, 18677-18680 (1998).
- Shenoy, S. K., Lefkowitz, R. J. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signalling. Biochem J. 375, 503-515 (2003).
- . Beta-arrest or. Nature. 383, 447-450 (1996).
- Serhan, C. N., Haeggstrom, J. Z., Leslie, C. C. Lipid mediator networks in cell signaling: update and impact of cytokines. Faseb J. 10, 1147-1158 (1996).
- Tager, A. M., Luster, A. D. BLT1 and BLT2: the leukotriene B(4) receptors. Prostaglandins Leukot Essent Fatty Acids. 69, 123-134 (2003).
- Toda, A., Yokomizo, T., Shimizu, T. Leukotriene B4 receptors. Prostaglandins Other Lipid Mediat. 68-69, 575-585 (2002).
- Haribabu, B. Targeted disruption of the leukotriene B(4) receptor in mice reveals its role in inflammation and platelet-activating factor-induced anaphylaxis. J Exp Med. 192, 433-438 (2000).
- Subbarao, K. Role of leukotriene B4 receptors in the development of atherosclerosis: potential mechanisms. Arterioscler Thromb Vasc Biol. 24, 369-375 (2004).
- Jala, V. R., Haribabu, B. Leukotrienes and atherosclerosis: new roles for old mediators. Trends Immunol. 25, 315-322 (2004).
- Heller, E. A. Inhibition of atherogenesis in BLT1-deficient mice reveals a role for LTB4 and BLT1 in smooth muscle cell recruitment. Circulation. 112, 578-586 (2005).
- Miyahara, N. Requirement for leukotriene B4 receptor 1 in allergen-induced airway hyperresponsiveness. Am J Respir Crit Care Med. 172, 161-167 (2005).
- Terawaki, K. Absence of leukotriene B4 receptor 1 confers resistance to airway hyperresponsiveness and Th2-type immune responses. J Immunol. 175, 4217-4225 (2005).
- Shao, W. H., Del Prete, A., Bock, C. B., Haribabu, B. Targeted disruption of leukotriene B4 receptors BLT1 and BLT2: a critical role for BLT1 in collagen-induced arthritis in mice. J Immunol. 176, 6254-6261 (2006).
- Kim, N. D., Chou, R. C., Seung, E., Tager, A. M., Luster, A. D. A unique requirement for the leukotriene B4 receptor BLT1 for neutrophil recruitment in inflammatory arthritis. J Exp Med. 203, 829-835 (2006).
- Jala, V. R., Shao, W. H., Haribabu, B. Phosphorylation-independent beta-arrestin translocation and internalization of leukotriene B4 receptors. J Biol Chem. 280, 4880-4887 (2005).
- Jala, V. R., Haribabu, B. Real-time analysis of G protein-coupled receptor signaling in live cells. Methods Mol Biol. 332, 159-165 (2006).
- Del Prete, A., A, . Regulation of dendritic cell migration and adaptive immune response by leukotriene B4 receptors: a role for LTB4 in up-regulation of CCR7 expression and function. Blood. 109, 626-631 (2007).
- Salogni, L. Activin A induces dendritic cell migration through the polarized release of CXC chemokine ligands 12 and 14. Blood. 113, 5848-5856 (2009).
- Boudreau, J., Koshy, S., Cummings, D., Wan, Y. Culture of myeloid dendritic cells from bone marrow precursors. J Vis Exp. , (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados