Method Article
Técnicas de laboratorio asépticas: Transferencias de volumen con pipetas serológicas y Micropipetas
En este artículo
Resumen
Cuando se trabaja en un laboratorio, es imperativo para reducir al mínimo las fuentes de contaminación. La técnica aséptica se refiere a los procedimientos que permiten la transferencia de las culturas y los reactivos, evitando el contacto con superficies no estériles. Pipetas serológicas y Micropipetas se utilizan para medir volúmenes precisos sin comprometer la esterilidad de las soluciones utilizadas en los experimentos.
Resumen
Los microorganismos están en todas partes - en el aire, el suelo, y el cuerpo humano, así como en las superficies inanimadas, como bancos de laboratorio y teclados de computadoras. La ubicuidad de los microorganismos generan un suministro abundante de posibles contaminantes en un laboratorio. Para asegurar el éxito experimental, el número de contaminantes sobre las superficies del equipo y el trabajo debe ser minimizado. Común entre los muchos experimentos en microbiología son las técnicas que implican la medición y la transferencia de los cultivos que contienen células bacterianas o de partículas virales. Para hacerlo sin ponerse en contacto con superficies no estériles, o la contaminación de los medios de comunicación estériles requiere (1) la preparación de un espacio de trabajo estéril, (2), precisamente, de ajuste y la lectura precisa de los instrumentos para la transferencia de aséptico de líquidos, y (3) correctamente la manipulación de instrumentos, frascos, botellas y culturas tubos dentro de un campo estéril. El aprendizaje de estos procedimientos requiere entrenamiento y práctica. En un primer momento, las acciones deben ser lenta, deliberada y controlada, con el objetivo de ser asépticos para technique para convertirse en una segunda naturaleza, cuando trabajaba en el banco. A continuación les presentamos los pasos a seguir para la medición de volúmenes con pipetas serológicas y Micropipetas dentro de un campo estéril, creado por un mechero Bunsen. Volúmenes desde microlitros (l) a mililitros (ml), dependiendo del instrumento utilizado. Líquidos comúnmente transferidos incluyen caldo estéril o soluciones químicas, así como cultivos de bacterias y las poblaciones de fagos. Siguiendo estos procedimientos, los estudiantes deben ser capaces de:
- El trabajo en el campo estéril creado por la llama del mechero Bunsen.
- Utilizar pipetas serológicas, sin comprometer la esterilidad del instrumento.
- Aspirar líquidos con pipetas serológicas, precisamente la lectura de volúmenes calibrados alineando el menisco formado por el líquido a las marcas de graduación en la pipeta.
- Mantenga las botellas de cultivo, frascos, tubos y sus respectivas tapas estériles durante la transferencia de líquidos.
- Identificar las diferentes aplicaciones de plástico frente al vidrio de pepita serológicaettes.
- Las limitaciones del Estado de precisión para Micropipetas.
- Precisamente, y establecer con precisión los volúmenes de Micropipetas.
- Sepa cómo utilizar correctamente la primera parada y el segundo en una micropipeta para aspirar y transferir volúmenes correctos.
Protocolo
1. Prepare un área de trabajo estéril
- Antes de iniciar cualquier procedimiento de esterilización en el área de trabajo, lávese bien las manos con jabón antiséptico y agua tibia.
- Asegúrese de volver a lavarse las manos cada vez que sospecha que tiene la contaminación de las manipulaciones experimentales.
- A retirar todos los materiales que saturan su área de trabajo en el banco de laboratorio. Retirar un pre-humedecidos toallita desinfectante del recipiente y limpie toda la zona. Deje que el desinfectante que se evapore - no se seque!
- Utilizar desinfectantes, tales como alcohol (isopropanol o etanol al 70%) o compuestos fenólicos (o-fenilfenol).
- Para evitar aerosolización, o la producción de una niebla fina que contiene las células bacterianas, y la propagación de contaminantes microbianos, evitar dispensar desinfectante de un frasco.
- La desecación de los microorganismos es una de las maneras más efectivas para descontaminar superficies.
- Incluso si alguien ha utilizado recientemente el laboratorio y la mesa de trabajo fue limpiar con desinfectante, SIEMPRE comenzar su tiempo de laboratorio, al limpiar la banca.
- Después de que el desinfectante se haya secado por completo, utilice un encendedor para encender el mechero de Bunsen. Ajuste la llama de modo que un cono azul puede verse en el centro de la llama. La llama está produciendo una corriente ascendente, o las corrientes de aire de convección en la que el aire caliente sube hacia arriba y lejos de la llama (Figura 1). Como el calor sube, los microorganismos y partículas de polvo son forzados hacia arriba y lejos del área de trabajo. Trabaje lentamente, con cuidado, y deliberadamente en todo momento dentro de esta área creada por el mechero Bunsen, conocido como un campo estéril. Mantenga el mechero de Bunsen durante todo el procedimiento.
- La punta del cono azul es la parte más caliente de la llama.
- Tenga cuidado de no molestar a la corriente ascendente de los movimientos rápidos que cambian dramáticamente la IAr corrientes alrededor de la mesa de laboratorio. La creación de una corriente ascendente con el mechero de Bunsen minimiza la posibilidad de microorganismos y el polvo que caen sobre el banco o en botellas abiertas, tubos o frascos en el área de trabajo.
- Organizar todos los suministros necesarios para el procedimiento en el banco de laboratorio, cerca del campo estéril. Asegúrese de que todos los materiales estén debidamente etiquetados.
- Suministros pueden incluir pipetas serológicas y Micropipetas, tubos de cultivo estériles, frascos estériles, botellas de los medios de comunicación con caldo, tubos estériles de microcentrífuga, consejos micropipeta, estantes para los tubos, las culturas de las células bacterianas, y las existencias de fagos.
- Los medios líquidos debe ser esterilizado en un autoclave a 121 ° C durante al menos 15 minutos en el ajuste de líquido. Los mayores volúmenes de los medios de comunicación (> 1 l) requieren más tiempo de autoclave. Para laboratorio debe ser esterilizado en un autoclave a 121 ° C durante al menos 30 minutos a la gravedad (seco) de ajuste.
- En general, las soluciones estériles pueden ser almacenadas a 4° C durante un máximo de 5 meses. Nótese que el tiempo de almacenamiento se reduce significativamente para soluciones que contienen componentes inestables, tales como antibióticos - siempre comprobar las recomendaciones del fabricante.
2. Transferencia de líquidos con pipetas serológicas
- Pipetas serológicas vienen en muchos tamaños y opciones: de plástico o de vidrio, desechables o reutilizables, conectarse o desconectarse. Estos están calibrados para proporcionar volúmenes que van desde un 0,1 ml a 25 ml.
- Los tamaños comunes para las pipetas serológicas son 5 ml, 10 ml y 25 ml y se debe utilizar para asépticas transferencias líquidas de 0,1 ml o más (panel A de la Figura 2). También hay grandes pipetas serológicas que pueden ofrecer volúmenes de hasta 100 ml, sin embargo, el foco de este protocolo es de los más comunes, más pequeñas del tamaño de las pipetas.
- Pre-esterilizados con pipetas de un tapón de algodón se necesitan para la microbiología y los experimentos de cultivo de tejidos. El enchufe no debe ser retirado de la ap de la pipeta; que está diseñado para funcionar como una barrera para el llenado excesivo de la pipeta.
- Diferentes aplicaciones requieren pipetas de plástico frente al vidrio serológicas. El vidrio se necesitan para los disolventes orgánicos. Cualquiera puede ser utilizado cuando se realiza BSL-1 experimentos sobre la parte superior del banco de laboratorio. Plásticos sólo pueden usarse cuando se trabaja en un gabinete de bioseguridad BSL-2 con los organismos en un mechero Bunsen no se pueden utilizar. También se recomienda que el plástico se utiliza para aplicaciones que implican transferencia de agar fundido.
- Pipetas serológicas son de dos tipos: TC ("contener") o TD ("entregar"). Pipetas TC entregar todo el volumen, incluyendo la punta, y debe ser "apagado" o se lava para obtener el volumen especificado. TD pipetas están calibradas para dejar un poquito en la punta que no fuera entregado. Asegúrese de revisar la etiqueta en el cuerpo de la pipeta en la parte superior para determinar de qué tipo es (Figura 3). Los más utilizados son las pipetas TD, que son mercadosked con dos timbres en la parte superior.
- Tome una pipeta serológica de plástico estéril (también llamado una pipeta volumétrica) y retirar con cuidado la cubierta de papel en el extremo con el tapón de algodón al pelar lejos como la piel de un plátano - no retire el manga entero, la protección de la punta de la pipeta que entrarán en contacto con el líquido a ser transferido. Toque solamente la parte superior de la pipeta (por encima de las marcas de graduación) con las manos.
- Nunca se meta en una solución estéril con una pipeta usada, incluso si el cuidado se ha tenido mucho para mantenerla estéril.
- Pipetas de vidrio serológicos suelen almacenarse en recipientes de metal (panel B de la Figura 2). Afloje la tapa de la lata con cuidado quitar el tapón, y la llama de los extremos abiertos de la tapa y el frasco. Colocar la tapa hacia abajo, sobre su lado, en el banco desinfectada. Extraer una pipeta del envase cargándola de forma horizontal y suavemente temblaban tanto las tapas de uno o dos pipetastes sobresalir aproximadamente una pulgada y puede ser comprendido con facilidad. Establecer el bote en su lado y quitar una pipeta, pero tenga cuidado de no tocar las pipetas de otros en el contenedor. No toque la punta de la parte inferior de la pipeta con las manos, y evitar el contacto de la punta con otras superficies no estériles.
- Fijar una ayuda pipeta tal como una bombilla, bomba o pistola al extremo superior de la pipeta serológica. Quitar la funda de papel a partir de la pipeta de plástico. Mantenga la ayuda de la pipeta en la mano derecha.
- Si se utiliza una pipeta de vidrio, pasar el tercio inferior de la pipeta a través del cono azul de la llama del mechero Bunsen durante 1-3 segundos. Girar la pipeta 180 ° a medida que pasa a través de la llama. Pipetas y tubos de plástico no puede ser flameado.
- Si la mano izquierda, sostenga la ayuda de la pipeta en la mano izquierda y llevar a cabo las manipulaciones posteriores de botellas y tubos de cultivo con la mano derecha.
- La contaminación tiende a ocurrir con pipetas de plástico, cuando la retirada de la última incHES de la pipeta de la manga porque la punta estéril entra en contacto con la parte del manguito tocado por sus manos.
- Retire la tapa de la botella que contiene los medios de comunicación estériles. No coloque la tapa en la mesa de laboratorio, sino sostenerlo entre el dedo anular y la palma de la mano derecha, mientras que la manipulación de la ayuda de la pipeta con el dedo pulgar, índice y el dedo medio de la misma mano (Figura 4). Sosteniendo la botella en un ángulo de 45 °, pasar el borde de la botella a través de la llama del quemador Bunsen, creando un campo estéril alrededor de la botella abierta.
- Aunque es mejor evitar, si hay que poner la tapa hacia abajo, colóquelo boca abajo sobre una superficie desinfectada. Con una tapa que está hacia arriba, existe una mayor posibilidad de contaminación de los movimientos de los objetos o las manos, creando corrientes de aire que causan los microorganismos y partículas de polvo a descender a la superficie interior de la tapa.
- El propósito de la llama no es para esterilizar pero para calentar la abertura Of de la botella y crear corrientes de aire de convección hacia arriba y lejos de la abertura (es decir, corriente ascendente). El aire caliente, el aumento de ayuda a evitar que las partículas de polvo y otros contaminantes entren en el frasco.
- Mantener el envase estéril abierto para el menor tiempo posible. Es importante mantener los puntos de entrada de microorganismos en el aire a un mínimo durante todo el procedimiento.
- Evite toser, estornudar, hablar, y el movimiento involuntario, mientras que otros recipientes estériles están abiertas.
- Nunca pase las manos y los dedos sobre la parte superior de un campo estéril (es decir, abrir botellas o frascos, el interior de los tubos y tapas de botellas), una vez que han pasado por la llama del mechero Bunsen.
- Siempre se debe trabajar con una llama abierta al abrir botellas o tubos estériles. Nunca tienen más de un tubo, botella o frasco abierto en el banco a la vez. Flaming debe hacerse inmediatamente después de la apertura y el cierre justo antes de tubos, botellas y frascos.
- Coloque la punta de la serologíaLÓGICO pipeta en el frasco que contiene el material estéril y aspirar o extraer la muestra de forma aséptica, de la botella. Utilice la ayuda pipeta para controlar el flujo de la muestra en la pipeta. Precisamente leer el volumen en la pipeta, alineando el menisco formado en la parte superior de la columna de líquido a las marcas de graduación en la pipeta calibrada (Figura 5).
- NO BOCA PIPETA! Utilice siempre una ayuda pipeta (bomba, bombilla, o una pistola).
- Prestar atención a la secuencia de números cuando la determinación del volumen aspirado. Los números se pueden imprimir de punta a la inversa superior, o viceversa, o muchas veces en ambas direcciones.
- Al leer el volumen, siempre mantenga el pipeta en posición vertical, perpendicular al suelo, y ver el menisco líquido de muertos en la altura de los ojos.
- Pipetas serológicas son tan precisos como el incremento más pequeño marcado, que suele ser de 0,1 ml 5 ml y 10 ml y pipetas de 0,2 ml por 25 ml pipetas. Yof mayor precisión que se necesita, una pipeta serológica puede ser utilizado en combinación con una micropipeta.
- Pase el borde de la botella a través de la llama del quemador Bunsen, una vez más, a continuación, colocar la tapa en la botella. Establecer la botella a un lado los medios de comunicación.
- No se quema con el mechero Bunsen en una carrera para cerrar la botella.
- Mantenga un tubo de ensayo o frasco en la mano izquierda. Retire y mantenga la tapa como se describe en el paso # 4. Crear un campo estéril por flameado el borde del tubo o frasco en el mechero de Bunsen.
- Distribuir los medios de comunicación en la pipeta en el tubo o frasco. Controlar el flujo de la muestra para que no salpique fuera del tubo o frasco.
- Volúmenes puede medirse de manera que todo el volumen se entrega y la pipeta drena por completo, o un volumen específico se consigue haciendo una entrega de punto a punto (un volumen marcado a otra).
- Pase el borde del tubo o frasco a través de la quemadura Bunsener la llama una vez más, a continuación, coloque la tapa. Coloque el tubo o frasco a un lado. Quitar la ayuda de pipeta y descartar la pipeta en el recipiente de residuos adecuado.
- Plástico pipetas serológicas son desechables, mientras vidrio pipetas serológicas pueden ser esterilizados y utilizarse de nuevo. La eliminación adecuada de pipetas de plástico requiere ser colocado en un contenedor de objetos punzantes designado (caja rígida alineó con el bolso plástico de desecho), mientras que inicialmente pipetas de vidrio debe ser sumergido en un recipiente con una solución de lejía al 10% para la desinfección de las superficies interiores y exteriores. Entonces las pipetas de vidrio debe ser lavado a fondo con detergente de laboratorio, se enjuagó con agua destilada, y se esterilizó en un autoclave.
- Estos mismos pasos se deben seguir cuando la inoculación de los medios de comunicación con un cultivo bacteriano o stock de fago o cuando se realizan diluciones seriadas.
3. Transferencia de líquidos Micropipetas
- Precisamente, medición y distribución de los volúmenes minuto puede ser consumadocobertizo usando Micropipetas (también referido como Pipetman; Grupo A de la Figura 6). Estos instrumentos vienen en diferentes tamaños, cada uno con un rango de volumen específico: P2 de 0,2-2 l de l, P10, P20 10.1 de 20.2 l, P200 de 20 a 200 l, y P1000 de 200 a 1.000 l.
- Tratar Micropipetas con cuidado, ya que son instrumentos de precisión. No los deje tirado en el banco de laboratorio sin supervisión en el que se puede caer y dañarse. No permita pipetas a entrar en contacto con productos químicos corrosivos.
- Para volúmenes superiores a 1000 l, con una pipeta serológica.
- A pesar de trabajar en el campo estéril creado por el mechero Bunsen, no Micropipetas de llama, tubos y puntas de plástico. Los tubos y sugerencias debe ser pre-esterilizado. Las Micropipetas puede ser limpiado con un pre-humedecidos toallita desinfectante antes de su uso.
- Un volúmetro numérica que muestra el volumen dispensado puede fijarse girando la perilla de ajuste. Result el volumen antes de continuar con el paso # 3.
- Nunca gire la perilla de ajuste por encima de su alcance!
- Para obtener la máxima precisión al disminuir el ajuste del volumen en la micropipeta, poco a poco marcar hacia abajo la rueda de ajuste, teniendo cuidado de no sobrepasar la marca de graduación.
- Para obtener la máxima precisión al aumentar el ajuste del volumen en la micropipeta, marque la ruedecilla hacia arriba, pasando la marca de graduación deseada por 1/3 de vuelta. Luego, lentamente, marque abajo de la rueda de ajuste para alcanzar el volumen deseado, asegurándose de no sobrepasar la marca de graduación.
El volúmetro muestra tres números. Dependiendo de la micropipeta, los números se interpretan de forma diferente. Tenga en cuenta que cada una micropipeta es tan precisa como la marca más pequeña de la graduación.
P2: Para volúmenes entre 0.2 a 2.0 l. El número de arriba indica el volumen en microlitros. El segundo número indicandodécimas ES de un microlitro (0,1 l), y el tercer número representa centésimas de un microlitro (0,01 l). Cada marca de graduación equivale a un incremento de dos milésimas (0,002 l) de un microlitro.
P10: Para volúmenes entre 1,0 hasta 10,0 l. El número de arriba es para decenas de microlitros, lo que normalmente se fija en "0" y sólo debe fijarse en "1" con los otros dos números que figuran en "0" cuando se vierte el 10,0 l. El número medio denota volumen en microlitros. El tercer número indica décimas de un microlitro (0,1 l). Cada marca de graduación equivale a un incremento de dos centésimos (0,02 l) de un microlitro.
P20: Para volúmenes entre 2.0 a 20.0 l. El número de arriba en negro es de decenas de microlitros, lo que sólo debe fijarse en "2" con los otros dos números que figuran en "0" cuando se vierte el 20,0 l. El segundo número de negro denota el volumen en microlitros. El tercer número en rojo indica que diezths de un microlitro (0,1 l). Cada marca de graduación equivale a un incremento de dos centésimos (0,02 l) de un microlitro.
P200: Para volúmenes entre 20.0 a 200 l. El número de arriba es para los cientos de microlitros, lo que sólo debe fijarse en "2" con los otros dos números que figuran en "0" cuando se vierte 200 l. El número medio indica el volumen dispensado en decenas de microlitros, y el tercer número indica el volumen en microlitros. Cada marca de graduación equivale a un incremento de dos décimas de uno (0,2 l) de un microlitro.
P1000: Para los volúmenes de entre 200 a 1.000 l. El número de arriba es para los miles de microlitros, lo que normalmente se fija en "0" y sólo debe fijarse en "1" con los otros dos números que figuran en "0" cuando se vierte el 1000 l. El número medio es para cientos de microlitros. El número inferior es de decenas de microlitros. Cada marca de graduación equivale a un incremento de dos (2 l) microlitros.
- Control de funcionamiento: Estos instrumentos deben ser calibrados cada año, lo que garantiza la exactitud y precisión se mantienen para permanecer dentro de ± 5% de las especificaciones. Utilice una balanza analítica para medir el agua, asegurándose de que los valores mínimos y máximos corresponden al volumen deseado. Por ejemplo, use un P1000 a las transferencias de 200 l de agua a un plato de pesaje en la báscula. Dado que el agua tiene una densidad de 1, a continuación, 1 ml de agua es equivalente a 1 gramo (g). Así, 200 l (0,2 ml) de agua debe ser igual a 0,2 g. Además, asegúrese de que la punta no se escape y mantener el volumen deseado puede hasta prescindir de usar sistema de bombeo.
- Micropipetas se debe utilizar con puntas desechables de plástico en todo momento. Colocar una punta firmemente en el extremo del cañón de la micropipeta. Presione hacia abajo y girar ligeramente para asegurar un sello hermético.
- Consejos se empacan en cajas de plástico que pueden ser esterilizados en autoclave. Abra el cuadro de la punta para recuperar la punta, A continuación, cerrar el cuadro de punta para minimizar el contacto con los contaminantes en el aire.
- Algunos consejos para tener filtros similares a los tapones de algodón en las pipetas serológicas. Estos consejos son a menudo más caros que los consejos regulares y por lo tanto se utilizan para aplicaciones especializadas. Por ejemplo, cuando la medición de los productos químicos volátiles tales como cloroformo o líquidos radioactivos tales como P-32 marcado ADN, utilizando puntas de filtro ayuda a evitar que el cañón de la micropipeta se contamine.
- Mantener la micropipeta en una posición vertical.
- Mantener la micropipeta en posición vertical a evitar que los líquidos que se ejecuta dentro y contaminan el cañón de la micropipeta.
- La micropipeta tiene tres posiciones: (1) posición de reposo, (2) La primera parada, y (3) Segunda parada (Figura 6, panel B). El instrumento cuenta con un sistema de bombeo de dos paradas. La primera parada tiene dos funciones. La primera consiste en dibujar en el volumen deseado de líquido en la punta de when soltar el émbolo de la primera parada a la posición de reposo. La segunda función es para dispensar la mayoría de líquido de la punta cuando apretar el émbolo de la posición de reposo hasta la primera posición. Además presionar el émbolo para los dispensa la segunda parada de cualquier líquido se mantiene en la punta.
Presione el botón en el émbolo de la posición de reposo hasta la primera parada. Aire igual al volumen de la configuración serán desplazados. - Sumerja la punta en el líquido mientras se mantiene pulsado el botón hasta el primer tope.
- No toque la misma micropipeta a los lados de las botellas, tubos y frascos, de lo contrario las superficies interiores de estos vasos se contaminará. Sólo los consejos son estériles.
- Soltar el pulsador lentamente para aspirar el líquido en la punta. Detener una vez que el pulsador está de nuevo a la posición de reposo. Espere un momento para que el líquido se puede extraer en la punta.
- El volumen de líquido en la punta será igual al volumen de Of el valor de la micropipeta.
- Viscosos como la glicerina que contiene los requieren más tiempo para entrar en la punta.
- Retire la punta del líquido, y una inspección visual de la punta para confirmar que el líquido elaborado ha alcanzado el nivel esperado en la punta y no hay burbujas de aire en la punta.
- Si es necesario, expulsar el líquido y apretar manualmente los consejos sobre las micropipeta. Elaborar el líquido y comprobar de nuevo.
- Colocar la punta en un ángulo (10 ° a 45 °) contra la pared del tubo de recibir el líquido. Para expulsar el líquido, presione lentamente el botón del émbolo hasta el primer tope. Espere un momento y luego presionar el pulsador para la segunda parada de expulsar a cualquier líquido residual en la punta.
- Al presionar el émbolo demasiado rápido puede causar que el líquido que se expulsa a salpicar o producir burbujas se indeseables en el tubo.
- Antes de liberar el émbolo a la posición de reposo, vuelvamover la punta del líquido.
- Desechar las puntas en un contenedor designado agujas y jeringas usadas pulsando el botón de expulsión en la micropipeta.
4. Limpieza El espacio de trabajo
- Cuando haya terminado con un experimento que requiere el uso de la técnica aséptica, apagar el mechero de Bunsen, a continuación, guarde todos los materiales y reactivos. Limpie las superficies exteriores de material de laboratorio (botellas, cajas, pipetee Micropipetas de punta) con un pre-humedecidos toallita desinfectante para garantizar los contaminantes no se transfieren a la ubicación de almacenamiento.
- Lugar de vidrio y los materiales contaminados de residuos peligrosos en el receptáculo de su eliminación adecuada. Residuos de laboratorio incluye el material de laboratorio, tales como guantes, pipetas, puntas y tubos. Los desechos no infecciosos peligrosos se genera al realizar experimentos con organismos no patógenos (BSL-1), mientras que los residuos peligrosos infecciosos se genera cuando el uso de organismos patógenos (BSL-2 o superior). Los residuos infecciosos debe ser esterilizado o desinfectado before se descarta. Siga las instrucciones del laboratorio de seguridad descritos en BMBL (5 ª ed.), Así como los proporcionados por Salud Ambiental OSHA e institucionales y los departamentos de seguridad.
- Limpie el área de trabajo en el banco de laboratorio con un pre-humedecidos toallita desinfectante en el recipiente, una vez más, permitiendo que el desinfectante se evapore.
- Lávese bien las manos con jabón antiséptico y agua tibia antes de salir del laboratorio.
5. Los resultados representativos
Una aplicación de ejemplo para el uso de pipetas serológicas para transferir líquidos se muestra en la Figura 7. Estas pipetas a menudo se utilizan en el laboratorio de microbiología para preparar los medios para la inoculación con cultivos bacterianos. Por ejemplo, frascos estériles primero se llena con un volumen especificado de caldo de cultivo, en este caso caldo Luria (LB), a continuación, un pequeño número de células (tales como E. coli) se añaden a los medios de comunicación. Utilizando un p serológicaipette, primero el caldo se colocarán asépticamente de la botella medios al matraz. En este caso, 25 ml de LB se añadió a un matraz de 125 ml estéril usando una pipeta serológica de 25 ml. A continuación, el caldo debe ser inoculados con E. células de E.. Aquí, 10 l de células se transfirieron asépticamente usando una micropipeta P20 de un frasco de cultivo previamente a la creciente de 25 ml de LB fresco. El matraz se incuba en una cámara de crecimiento para una determinada cantidad de tiempo, permitiendo que las células se replican (para este ejemplo, las células de E. coli se incubaron durante la noche a 37 ° C en una plataforma de agitación). El resultado es un cultivo de células bacterianas turbia que se puede utilizar para experimentos posteriores.
Pipetas serológicas también se puede utilizar para transferir medios originalmente suministrados en una botella para tubos de ensayo, o entre los tubos de ensayo, como se hace al hacer diluciones de un cultivo bacteriano. Si la técnica aséptica no se mantiene a lo largo de estos tipos de manipulaciones de los medios , A continuación, las culturas se contaminen, y experimentos posteriores con esas culturas se retrasó debido a las culturas limpio y no contaminado tendrá que estar preparado. Se producen errores porque un campo estéril no se mantiene durante todo el procedimiento. Por ejemplo, usted puede olvidarse de la desinfección de la mesa de laboratorio o llama al borde de una botella o tubo de la cultura. Es posible que toque la punta de la pipeta o coloque la tapa de una botella o tubo de ensayo en el banco en lugar de mantener en la mano. El procedimiento adecuado es crítico para mantener la contaminación de los medios y culturas a un mínimo. Figura 8A proporciona un ejemplo de un cultivo puro frente contaminadas de E. coli en un tubo que contiene 5 ml de LB. El panel izquierdo muestra una cultura que muestra la turbiedad fina y uniforme típico de una pura E. E. cultura. En contraste, el panel de la derecha muestra un cultivo contaminado en el que las características de crecimiento se desvían de los esperados para esta cepa bacteriana.
"> Los errores técnicos pueden ocurrir cuando la manipulación de las pipetas serológicas que resulten en la transferencia de volúmenes incorrectos de los medios de comunicación entre tubos de ensayo. Por ejemplo, usted puede leer el volumen de la pipeta de forma incorrecta (es decir, la parte superior en comparación con la parte inferior del menisco) o puede expulsar a los medios de comunicación completamente de una pipeta TD, el cual fue diseñado para dejar un poquito en la punta para no ser entregado. Cuando se realiza una entrega punto a punto de los medios de comunicación, usted puede utilizar las marcas de calibración equivocadas y dispensar el volumen incorrecto. Figura 8B muestra un ejemplo de los tubos de ensayo con los volúmenes correctos frente incorrecta de los medios de comunicación. El tubo de la izquierda contiene 3,5 ml de LB mide con una pipeta serológica de 5 ml. El estudiante llevó a cabo una entrega de punto a punto de los medios de comunicación en la que LB se ha elaborado hasta la marca de graduación 5,0 ml y se dispensa a la marca de 1,5 ml. El tubo de la derecha contiene 2,5 ml de LB mide con una pipeta del mismo tamaño, porque el estudiante que realiza la entrega de punto a punto de los medios incorrectly se dispensa desde la marca de 5,0 ml a 2,5 ml de la marca. Este error se traducirá en un cultivo bacteriano que estará en una concentración más alta de lo previsto, provocando diluciones posteriores a ser incorrectos. Esta propagación de errores puede resultar en un experimento fallido que tendría que ser repetido con las concentraciones de células correctas.Una aplicación de ejemplo para el uso de Micropipetas para transferir líquidos se muestra en la Figura 9. Estas pipetas se utilizan para una variedad de experimentos en biología molecular y microbiología incluyendo la preparación de muestras para PCR y electroforesis en gel o inocular medios estériles o tampón con volúmenes pequeños (menos de 1,0 ml) de células bacterianas o partículas de fago. En el ejemplo dado, el estudiante transferido 12,5 l de tampón TE en un tubo de microcentrífuga de 1,8 ml (tubo izquierdo en el panel A; nota que el colorante se ha añadido a la memoria intermedia para facilitar la visualización del líquido dentro de los tubos de microcentrífuga claros).Este procedimiento requiere el estudiante para seleccionar la primera micropipeta correcta, en este caso un P20, y el siguiente para establecer el volúmetro al volumen correcto (panel B). Una punta se utilizó que contiene un tapón de lana de algodón en el extremo para evitar la posible contaminación que podría ser expulsado del cilindro de la micropipeta de alcanzar el tampón de muestra en la punta. Esta precaución no es necesaria si se tiene cuidado en la aspiración de líquidos en las extremidades, presionar el émbolo lentamente para que el líquido no salpique en el barril de pipeta. Los errores técnicos que pueden ocurrir como resultado la transferencia de volúmenes incorrectos. Por ejemplo, usted puede seleccionar la micropipeta equivocada para el trabajo o establecer el volúmetro en la micropipeta correcta a un volumen incorrecto. Antes de sumergir la punta en el búfer, puede empujar el émbolo más allá de la primera parada, causando un exceso de buffer que se elaborará en la punta al soltar el émbolo. Por otra parte, no podrás sumergir la punta lo suficiente en el buffer, por lo que se aspira aireen la punta en lugar de tampón. Es posible que se olvide de presionar el émbolo hasta la segunda parada cuando se vierte el tampón en el tubo de microcentrífuga causando menos que el volumen deseado para ser liberado de la punta. El tubo de la derecha en el panel A de la Figura 9 muestra un tubo de microcentrífuga que contiene el volumen incorrecto de tampón con relación al tubo de la izquierda. En lugar de dispensación 12,5 l de tampón, el estudiante dispensado 125 l. En este caso, aunque los números están configurados de la misma en el volúmetro, la micropipeta equivocada fue seleccionado para el trabajo (el estudiante utilizó un P200 en lugar de un P20, el panel B), resultando en la entrega de un volumen considerablemente mayor de búfer. Si esta solución se utiliza para preparar una mezcla de reactivos para una aplicación como la PCR, a continuación, este error va a cambiar la concentración final de todos los reactivos añadidos posteriormente al mismo tubo. En consecuencia, es poco probable que el experimento tendrá éxito, ya que los procedimientos de biología molecular, talescomo la PCR requieren todos los componentes a ser en concentraciones específicas para la reacción para que funcione correctamente.
Debido a que no siempre es posible garantizar Micropipetas (sobre todo el interior del cañón) son estériles, soluciones madre pueden contaminarse causando incluso los esfuerzos de solución de problemas a fallar cuando la realización de experimentos. Si se utiliza para transferir Micropipetas de soluciones estériles, se recomienda encarecidamente que las alícuotas de las soluciones madre (los medios de comunicación, el tampón, el agua) se hizo utilizando una técnica aséptica con pipetas serológicas. Es común para mantener las soluciones de trabajo de stock en 15 ml o 50 ml tubos estériles. Estos son a menudo más fácil de manipular mientras opera una micropipeta y se puede sustituir con una parte alícuota de la solución madre si se contamina durante la transferencia de volumen.
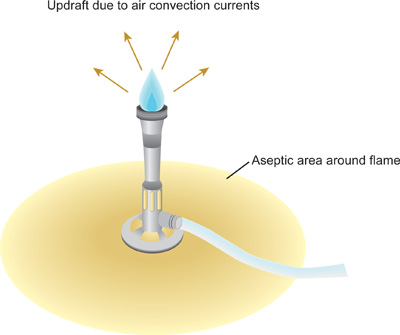
Figura 1. Campo estéril creado por la corriente ascendente de la llama del mechero Bunsen. Para minmizar la contaminación de las soluciones estériles y culturas, es fundamental que todas las manipulaciones se realizaron en el campo estéril. Los bordes de los tubos de cultivo de vidrio y frascos deben pasar a través de la punta del cono azul, la parte más caliente de la llama. Los tubos de plástico y sugerencias no puede ser flameado - éstos deben ser pre-esterilizados por métodos alternativos antes de su uso.

Figura 2. Pipetas serológicas utilizadas para la transferencia de aséptico de líquidos. (A) se muestra de izquierda a derecha son los dibujos de 25 ml, 10 ml y 5 ml pipetas. (B) pipetas serológicas pueden ser de plástico o de vidrio. Pipetas de plástico son desechables (de un solo uso) y por lo general están envueltos individualmente en fundas de papel y plástico en el que todas las superficies interiores son estériles (lado izquierdo). Pipetas de vidrio se pueden utilizar varias veces, siempre y cuando se limpian y esterilizan entre los usos, los cuales normalmente se almacenan en recipientes de metal (a la derechalado).

. Figura 3 pipetas serológicas son de dos tipos: TC ("contener") o TD ("entregar"). Se muestra la etiqueta explicativa de un TD Pipeta de 5 ml.

Figura 4. Una técnica aséptica. Al aspirar líquidos de una botella, frasco o tubo con tapas, nunca coloque la tapa en el banquillo. En su lugar, mantenga la tapa en la misma mano que la ayuda de pipeta, mientras que la manipulación del recipiente que contiene el líquido con la mano opuesta, como se muestra.
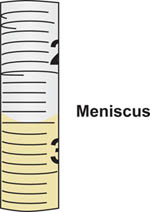
Figura 5. Menisco formado en la elaboración líquido en pipeta serológica. El volumen corresponde a la marca de graduación de la pipeta cuando la parte inferior del menisco alinea. En este ejemplo, el menisco se alinea con la graduación 2,5 ml signo de interrogación.
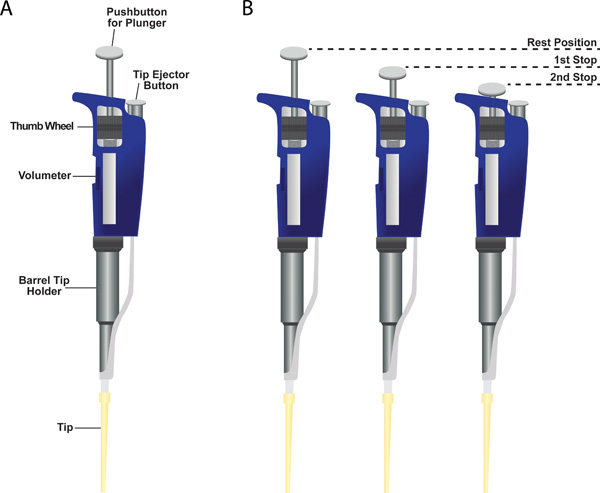
Figura 6. Micropipeta de un solo canal. (A) mostrada es una micropipeta muestra con una punta de plástico unido a la parte inferior del portador de punta barril. Se indican las ubicaciones de los volúmetro, la rueda de ajuste para cambiar la configuración volúmetro, el titular de la punta del cañón, el botón de expulsión de puntas, y el pulsador para el émbolo. (B) de dos paradas sistema de émbolo de una micropipeta.

Figura 7. Uso de pipetas serológicas para transferir los medios de comunicación en frascos de 125 ml estériles. El matraz izquierda tiene 25 ml de medio solamente (LB), mientras que el matraz de la derecha es un cultivo de E. E. resultantes de la inoculación de LB con células incubando a continuación durante la noche a 37 ° C. Observe cómo los medios de comunicación en el matraz de la derecha está turbia debido a un crecimiento celular.
e 8 "src =" / files/ftp_upload/2754/2754fig8.jpg "/>
Figura 8. Uso de pipetas serológicas para transferir los medios de comunicación en tubos de ensayo estériles. (A) El tubo de la izquierda contiene 5 ml de una pura E. cultura coli, mientras que el tubo de la derecha contiene 5 ml de un cultivo celular bacteriana contaminada. Tenga en cuenta las diferencias en las características de crecimiento entre las dos culturas. Aunque ambos son turbias, la cultura de la derecha ha sido contaminado con un hongo u otros microorganismos en el aire dando a la cultura de un color diferente y la consistencia de la que se espera para el E. células de E.. (B) El tubo de cultura de la izquierda contiene 3,5 ml de LB, mientras que el tubo de la derecha sólo contiene 2,5 ml de LB. Esta diferencia de volumen como resultado de un error cometido al realizar una entrega de punto a punto de los medios a los tubos.

Figura 9. UsínMicropipetas g para transferir tampón en tubos de microcentrífuga estériles. (A) El tubo de microcentrífuga izquierda contiene sólo 12,5 l de tampón TE, mientras que el tubo de la derecha contiene 125 l. Nótese que un colorante se ha añadido a la memoria intermedia para facilitar la visualización del líquido dentro de los tubos de microcentrífuga claras. (B) El volúmetro izquierda es de una micropipeta P20, mientras que el volúmetro derecha es de una micropipeta P200. Un error común es la selección de la micropipeta mal. Aunque los números están configurados de la misma en el volúmetro P20 y P200, la selección de los resultados de la micropipeta equivocadas en materia de transferencia de volúmenes incorrectos.

Figura 10. Campana de flujo laminar para evitar la contaminación de las soluciones y culturas. Se muestra un gabinete de bioseguridad aprobada para el trabajo con organismos BSL-2.
Discusión
La técnica aséptica se refiere a un conjunto de procedimientos de rutina que se practican para evitar soluciones estériles y las culturas se contamine por microorganismos no deseados en el laboratorio. Tales técnicas son esenciales para los experimentos que requieren células en crecimiento. Aunque un entorno de trabajo que es completamente estéril no puede lograrse, procedimientos tales como la desinfección de superficies de laboratorio, la creación de un campo estéril utilizando un mechero Bunsen, limitar la exposición de los cultivos no niveladas y medios para el aire, esterilización de materiales tales como botellas, tubos y pipetas de vidrio, y evitar el contacto de los instrumentos esterilizados con superficies no estériles reduce la posibilidad de contaminar las soluciones y culturas en un experimento. El objetivo es que estos procedimientos de precaución para convertirse en una segunda naturaleza, lo que viene con la formación y la práctica mientras se trabaja en un laboratorio.
Las transferencias de volumen con soluciones estériles y culturas que utilizan instrumentos como pipetas serológicas y de microropipettors son uno de los muchos tipos de técnicas de rutina que se practican en un laboratorio. Diferentes aplicaciones experimentales exigen instrumentos capaces de transferir volúmenes distintos, sin embargo, precisos y exactos,. Pipetas serológicas se utilizan en los laboratorios de microbiología para preparar cultivos celulares que requieren la preparación de medios con volúmenes mililitro, mientras que Micropipetas son esenciales para experimentos de biología molecular que necesitan solamente cantidades microlitros de soluciones. Cuando una técnica aséptica se practica con estos instrumentos, se minimiza la contaminación durante la transferencia de volumen sin importar la cantidad de líquido o el tipo de experimento.
Aunque no se discute en el presente Protocolo, uno de los medios de otros de uso común para evitar la contaminación es trabajar dentro de una campana de flujo laminar (Figura 10). Este equipo es crítico para el cultivo de tejidos y para experimentos realizados con microorganismos clasificados como BLS-2 o superior. Una campana de flujo laminar contiene un filtro HEPA (alta eficienciapartículas de aire) de filtro que elimina los contaminantes transportados por el aire desde el aire que fluye dentro de la campana al mismo tiempo impidiendo que el aire no filtrado de la sala de la que impregna el espacio de trabajo. Es de destacar que un mechero Bunsen no se puede utilizar dentro de una campana de flujo laminar ya que el calor de la llama interrumpe el flujo de aire esencial para la funcionalidad de la campana.
A menudo es útil para comprobar la calidad de su técnica aséptica al realizar experimentos. Para confirmar soluciones y medios de cultivo no se contaminan durante las manipulaciones experimentales, siempre preparar un control negativo. Por ejemplo, si la preparación de los tubos de caldo para el crecimiento de cultivos de bacterias, no inocular un tubo dejando sólo medios estériles. Incubar el medio junto con los tubos inoculados luego inspeccionar tubo sin inocular el control de signos de contaminación, tales como la turbidez del crecimiento de las células no deseadas involuntariamente introducidas en el tubo. Si el tubo de control está contaminado, el tubo experimentals probable están contaminados, así, y el experimento tendrá que ser repetido. Estas medidas cautelares se debe hacer con cada experimento.
Divulgaciones
No tengo nada que revelar.
Agradecimientos
Un agradecimiento especial a Cori Sanders en los diseños de Iroc para la preparación de las ilustraciones y Kris Reddi en la UCLA para el establecimiento de cultivo de las muestras para las figuras. Los fondos para este proyecto fue proporcionado por el HHMI (HHMI Grant N º 52.006.944).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| LB caldo | Difco | 244620 | Receta disponible también en la referencia 6 |
| Tampón TE: | |||
| EDTA disódico dihidrato de la sal | Sigma | E5134 | |
| Trizma-HCl | Sigma | T-3253 | |
| CiDecon | Decon Laboratories, Inc. | 8504 | Desinfectante |
| Etanol | Fisher Scientific | A406 | Para su uso como desinfectante, preparar 70% (v / v) con agua destilada |
Referencias
- Barker, K. . At the Bench: A Laboratory Navigator. , (1998).
- . . Biosafety in Microbiological And Biomedical Laboratories (BMBL). , (2009).
- Bykowski, T., Stevenson, B. Aseptic Technique. Current Protocols in Microbiology. Appendix 4, Appendix 4D (2008).
- Coté, R. J. Aseptic Technique for Cell Culture. Current Protocols in Cell Biology. Chapter 1, Unit 1.3 (2001).
- Grimes, S. E. A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. RAP Publication. AC802/E, 12-13 (2002).
- Guzman, K. Pipetting: A Practical Guide. The American Biology Teacher. 63 (2), 128-131 (2001).
- Jordan, T., et al. . RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , (2008).
- Sambrook, J., Russell, D. W. . Molecular Cloning - A Laboratory Manual. , 978-087969576 (2001).
- Seidman, L. A., Moore, C. J. . Basic Laboratory Methods for Biotechnology: Textbook and Laboratory Reference. , (2000).
- . . PIPETMAN P User's Guide. , (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados