Method Article
無菌室のテクニック:血清ピペットMicropipettorsのボリュームを転送
要約
実験室で作業している場合は、汚染の発生源を最小限に抑えることが不可欠です。無菌非無菌の表面との接触を避けながら、文化や試薬の転送を許可する手順を指します。血清ピペットとmicropipettorsは、実験に使用される溶液の無菌性を損なうことなく、正確なボリュームを測定するために使用されます。
要約
微生物があふれている - 空気、土壌、人間の体内で同様に実験室でのベンチやコンピュータのキーボードのような無生物表面上に。微生物の普遍性は、実験室における潜在的な汚染物質の大量の供給を作成します。実験的な成功を確保するために、機器や作業表面上の汚染物質の数は最小限に抑える必要があります。微生物学の多くの実験の間で一般的な細菌細胞またはウイルス粒子を含む培養物の測定と移転技術である。 (1)非滅菌表面に接触または無菌のメディアが必要を汚染することなくこれを行うには無菌スペース、(2)正確に設定し、正確に液体の無菌転送のためのインストゥルメントを読み込み、(3)適切に操作する楽器、文化フラスコ、ボトルと準備滅菌フィールド内チューブ。これらの手順を学ぶことは訓練と実践を求めている。最初に、アクションは、低速意図的、および無菌tに対してれることを目標に制御する必要がありますベンチで作業するとき第二の天性になってechnique。ここでは、ブンゼンバーナーで作成された無菌のフィールド内の血清ピペットとmicropipettorsを使用してボリュームを測定するための手順を紹介します。ボリュームは、マイクロリットル(μL)から使用する機器に応じて、ミリリットル(ml)の範囲です。一般的に転送され、液体は、無菌培養液または薬液など細菌培養とファージ株が含まれています。これらの手順を実行することで、学生のことができるようになります。
- ブンゼンバーナーの炎によって作成された無菌のフィールド内で動作します。
- 機器の無菌性を損なうことなく、血清学的ピペットを使用しています。
- 正確にピペットで卒業マークに液体によって形成されるメニスカスを合わせて校正されたボリュームを読んで、血清ピペットで液体を吸引除去する。
- 液体の転送中に培養瓶、フラスコ、試験管、それぞれのキャップは無菌に保つ。
- プラスチック製の対ガラス血清PIPの異なるアプリケーションを識別ettes。
- micropipettorsの状態の精度には限界が。
- 正確にかつ正確にmicropipettors上のボリュームを設定します。
- 適切に正しいボリュームを吸引し、転送するピペットに1番目と2番目のストップを使用する方法を知っています。
プロトコル
1。滅菌ワークスペースを準備します。
- あなたの作業領域内の任意の滅菌手順を開始する前に、防腐剤石鹸と暖かい水でよく手を洗う。
- あなたの手あなたがあなたの実験的な操作からの汚染を持っている疑いがある任意の時間を再洗浄してください。
- 実験台上で作業領域を乱雑にすべての材料を取り除く。削除する前の湿らせた消毒剤は、キャニスターから拭くと領域全体を拭いてください。消毒剤が蒸発することができます - よく拭いて乾かしていません!
- 例えば、アルコール(イソプロパノール又は70%エタノール)またはフェノール性化合物(o-フェニルフェノール)などの消毒剤を使用しています。
- エアロゾル化 、または細菌細胞、微生物汚染の拡散を含む微細ミストの生成を防止するため、スクイーズボトルから消毒剤を分配することは避けてください。
- 微生物の乾燥は、表面を除染するための最も効果的な方法の一つです。
- 誰かが最近実験室のベンチを使用しており、ベンチトップは消毒剤で拭いダウンされた場合でも、常にベンチを拭いて、ラボの時間を開始します。
- 消毒剤が完全に乾燥した後、ブンゼンバーナーを点灯させる点火装置を使用しています。青錐体が炎の真ん中で見ることができるように炎を調節します。炎は今上昇気流を作り出す 、または暖かい空気が炎( 図1)から上昇し離れている空気の対流されています。熱が上昇するにつれて、微生物やほこりの粒子は、即時作業領域から上方に離れて強制されます。慎重に、ゆっくり動作し、意図的にブンゼンバーナーで作成されたこの領域内のすべての回で、 滅菌フィールドと呼ばれています。全体の手順の実行中にブンゼンバーナーを保持します。
- 青錐体の先端が炎のホットな部分です。
- 劇的にAIを変更する急速な運動によって上昇気流を妨げないように注意してください実験室のベンチの周りrは電流です。ブンゼンバーナーの上昇気流を作成すると、ベンチの上または作業領域で開いてボトル、チューブまたはフラスコに落下微生物やほこりの可能性を最小限に抑えることができます。
- 滅菌したフィールドの近くの実験ベンチ上の手続きに必要なすべての電源を配置します。すべての材料が適切にラベル付けされていることを確認します。
- 電源は、血清ピペットとmicropipettors、無菌培養チューブ、滅菌フラスコ、培養液を含有する培地瓶、滅菌マイクロチューブ、ピペットチップ、チューブ、細菌の細胞培養、およびファージ株のラックを含めることができます。
- 液体培地は、液体の設定については、少なくとも15分間121℃でオートクレーブで滅菌する必要があります。メディアの大きなボリューム(> 1L)が長くオートクレーブ時間を必要とします。実験器具は重力(ドライ)の設定については、少なくとも30分間121℃でオートクレーブで滅菌する必要があります。
- 一般的には、滅菌溶液は4℃保存することができる5ヶ月までの°C。蓄積時間が大幅に抗生物質など不安定な成分を含有する溶液に削減されることに注意してください - 常にメーカーの推奨を確認してください。
2。血清学的ピペットを使用した液体を転送する
- 血清ピペットは、多くのサイズとオプションがあります:プラスチックやガラス、使い捨てまたは再利用可能な、プラグインまたはアンプラグド。これらは、0.1ミリリットルから25ミリリットルに至るまでのボリュームを提供するために校正されています。
- 血清学的ピペットのための共通のサイズは5ミリリットル、10ミリリットルと25ミリリットルであり、0.1ミリリットル以上( 図2のパネル)の無菌液体転送に使用する必要があります。また、100ミリリットルまでのボリュームを提供することができます大規模な血清ピペットはありますが、このプロトコルの焦点は、より一般的な、小さいサイズのピペットにあります。
- 綿ウールのプラグを事前滅菌ピペットを微生物学、組織培養実験のために必要とされている。プラグにから削除すべきではありませんピペットのp、それをピペットを過剰充填への障壁として機能するように設計されています。
- 別のアプリケーションでは、プラスチック製の対ガラス血清ピペットを求める。ガラスは有機溶剤が必要です。実験台の上にBSL-1実験を実行するときにどちらを使用することができます。ブンゼンバーナーを使用することはできませんBSL-2生物と生物学的安全キャビネット内で作業するときだけプラスチックを使用することができます。また、プラスチックを溶融寒天の転送を伴うアプリケーションに使用されることをお勧めします。
- 血清ピペットは、次の2種類があります。TC( "が含まれているために")やTD( "配信する")。 TCのピペットは、先端を含む、すべてのボリュームを提供し、 "吹き"または指定されたボリュームを取得するためにリンスする必要があります。 TDピペットが配信されるべきではない先端に小さなビットを残すために校正されています。それがどのタイプを確認するための上部( 図3)の近くにピペットの本体のラベルを確認してください。最も一般的に使用される月であり、TDピペットであり、上部の二重リングでヒツジシラミバエ。
- 滅菌したプラスチック製の血清ピペット(また容積移転ピペットと呼ばれる)を取り、慎重にバナナの皮のようにそれを離れて剥離によって綿ウールのプラグを最後に紙スリーブを削除する - の先端を保護し、全体のスリーブを取り外さないでください転送される液体と接触するピペット。あなたの手でピペットの上部のみを(卒業マークの上)をタッチします。
- 細心の注意がそれは無菌に保つように注意されている場合でも、使用されるピペットで無菌性溶液に入ることはありません。
- ガラス血清ピペットは、通常、金属製のキャニスター( 図2のパネルB)に格納されています。キャップと缶の開放端部をキャニスターの上部を緩め、その後慎重にキャップを外し、難。消毒ベンチには、その側では、キャップを下に置きます。水平に保持し、ゆっくりと1つまたは2つのピペットの上端ので、それを揺することによって、キャニスターから1ピペットを削除します。TESは、インチほど突き出ると容易に把握することができます。その側にキャニスターを下に置くと1ピペットを削除しますが、コンテナ内の他のピペットに触れないように注意が必要です。あなたの手でピペットの下部先端に触れ、他の非滅菌表面とチップの接触を避けていません。
- 接辞などの血清学的ピペットの先端に電球、ポンプ、または銃としてピペットエイド。プラスチックピペットから紙スリーブを取り外します。右手にピペットエイドを保持します。
- ガラスピペットを使用している場合、1〜3秒ブンゼンバーナーの炎の青いコーンを介してピペットの下部三分の一を渡します。それは炎を通過する際にピペットを180°回転させます。プラスチックピペットとチューブが叩かことはできません。
- 左利きの場合、左手でピペットエイドを保持し、右手で培養ボトルやチューブの後続の操作を行っています。
- 最終的な株式会社を引き出す際に汚染がプラスチックピペットで発生する傾向があるスリーブからピペットのHESは、無菌の先端はあなたの手で触れスリーブの一部に接触するからである。
- 滅菌媒体の入ったボトルのキャップを外します。実験台の上にキャップを置きますが、同じ手( 図4)の親指、人差し指と中指でピペットエイドを操作しながら薬指と右手の手のひらの間にそれを保持しないでください。 45°の角度でボトルを保持して、開いているボトルの周りに滅菌フィールドを作成し、ブンゼンバーナーの炎を介して瓶の縁を渡します。
- 避けた方が良いがいくつかありますが、キャップを下に置く必要がある場合は、それは消毒表面上に伏せて置きます。上向きにキャップで、微生物やほこりの粒子がキャップの内側表面に降下する原因となる空気の流れを作成するオブジェクトや手の動きからの汚染の大きなチャンスがあります。
- 炎の目的は、殺菌することではなく、開口部Oを温めることではありません開口部(すなわち、上昇気流)からfボトルと空気の対流を作成し、離れて。暖かい上昇気流がボトルに入るからダスト粒子や他の汚染を防ぐことができます。
- できるだけ時間などのために滅菌容器は開いたままにします。それは、プロシージャ全体で最小限に浮遊微生物のエントリポイントを維持することが重要です。
- 滅菌コンテナが開いている間は、くしゃみの話、および他の不用意な動き、咳を避けることができます。
- 彼らはブンゼンバーナーの炎を通過された後、滅菌フィールド(つまり、開いているボトルやフラスコ、チューブ、ボトルキャップの内側)の上に手や指を渡すことはありません。
- 滅菌試験管またはボトルを開くときに常に開いて炎で動作します。 1チューブ、ボトル、または同時にベンチ上で開いているフラスコを超える必要はありません。燃えるような、チューブ、ボトル、フラスコを閉じる直前に開いて、直ちに実行する必要があります。
- serolの先端を置く滅菌媒体の入ったボトルにogicalピペットは、 吸引 、またはボトルから、無菌的にサンプルを描画します。ピペットへのサンプルの流れを制御するピペットエイドを使用しています。正確にキャリブレーションピペット( 図5)卒業マークに液柱の上に形成されたメニスカスを合わせて、ピペットに引き込まれたボリュームをお読みください。
- 口はピペット!常に(ポンプ、バルブ、またはガン)ピペットエイドを使用しないでください 。
- 吸引体積を決定する際に番号の順序に注意してください。番号は、先頭に先端を印刷、またはその逆、または両方の方向にしばしばされることがあります。
- ボリュームを読み込むときに、常に地面に垂直に、ピペットを垂直に保持し、目の高さで死んでオン液体のメニスカスを表示します。
- 血清ピペットは、典型的には5 mlおよび10 mlのピペット、25 mlのピペットで0.2 mlの0.1ミリリットルである最小の著しい増加、としてのみ正確です。私はFより高い精度が必要な場合、血清ピペットは、ピペットと組み合わせて使用することができます。
- もう一度ブンゼンバーナーの炎を介して瓶の縁を通過し、ボトルにキャップを戻し入れます。脇のメディアボトルを設定します。
- ボトルを閉じるには、ラッシュのブンゼンバーナーでやけどしないでください。
- 左手で試験管やフラスコを保持します。上記の手順4で説明したようにキャップを外したままにします。ブンゼンバーナーでチューブやフラスコの縁を炎によって滅菌フィールドを作成します。
- チューブやフラスコにピペットでメディアを分注します。それはチューブやフラスコの外にかからないように、サンプルの流れを制御する。
- ボリュームは、ボリューム全体が配信とピペットが完全に排水したり、特定のボリュームがポイントツーポイント配信(別のマーキングつのボリューム)を行うことによって達成されるされるように測定することができる。
- ブンゼン燃焼を介してチューブやフラスコの縁を通過するER炎は再び、そのキャップを交換してください。脇チューブあるいはフラスコを設定します。ピペットエイドを削除し、適切な廃棄物のレセプタクルにピペットを破棄します。
- ガラス血清ピペットを再度滅菌して使用することができながら、プラスチック製の血清ピペットは、使い捨てです。適切な処分は、ガラスピペットは、最初に内側と外側の表面を消毒するために10%漂白剤溶液を容器に浸漬する必要がありながら、プラスチックピペットが指定された鋭利な容器(プラスチック製のごみ袋が並んでリジッドボックス)に配置される必要があります。その後、ガラスピペットを徹底的に、研究室用洗剤で洗浄し、蒸留水で洗浄し、オートクレーブで滅菌する必要があります。
- 細菌培養またはファージストックを持つメディアを接種する場合や、段階希釈を行う際にこれらの同じ手順に従う必要があります。
3。 Micropipettorsを使用して転送する液体
- 正確に測定し、分のボリュームを調剤する既成することができますmicropipettors(; 図6のパネルもピペットマンと呼ばれる)を使用して流した。 0.2から2μlのP2、1-10μlのためのP10、2-20μlのためのP20、P200 200から1000μLのために20から200μLと、P1000のためにこれらの機器は、それぞれの特定のボリュームの範囲で異なったサイズ入って来。
- 彼らは精密機器ですので、注意してmicropipettorsを扱う。彼らは、彼らがオフにノックし、破損することができ、無人実験台の上に横たわったままにしないでください。ピペットは、腐食性の化学物質と接触することはできません。
- 1000μL以上のボリュームでは、血清学的ピペットを使用しています。
- ブンゼンバーナーで作成された無菌のフィールド内で作業しているが、難micropipettors、チューブやプラスチックのヒントをしないでください。チューブとチップは事前に滅菌する必要があります。 micropipettorsは、事前に湿らせた消毒剤は使用前に拭きで拭いてダウンされることがあります。
- 調剤量を示す数値の体積計は、調整ノブを回して設定することができます。 AdjusT#ステップ3に進む前に、ボリューム。
- 目的の範囲上記の調整ノブを回してないでください!
- ピペットの音量設定を減少させるときに最大の精度を得るために、ゆっくりとしないオーバーシュート卒業マークに確認しながら、サムホイールを下にダイヤルします。
- ピペットのボリューム設定を大きくしたときに最大の精度を得るために、ターンの1/3が希望する卒業を突破し、最大サムホイールをダイヤルしてください。その後徐々にオーバーシュート卒業マークにわからないながら、意図されたボリュームに到達するためにサムホイールを下にダイヤルします。
体積計3つの数値を示しています。ピペットに応じて、番号が異なって解釈されます。各ピペットのみを最小目盛のように正確であることに注意してください。
P2:0.2から2.0μlの間にボリュームの場合。トップ数マイクロリットルの体積を表します。二番目の数字のindicatサラームリットルの十分の(0.1μL)、および3番目の番号は、マイクロリットル(0.01μl)の百分のを表しています。それぞれの卒業マークは、マイクロリットルの2つの1千(0.002μl)の増分に等しい。
P10:1.0から10.0μLの間にボリュームの場合。トップ数マイクロリットル数十のためのものです。これは通常、 "0"に設定されており、10.0μLを調剤する場合にのみ "0"に設定し他の二つの数字で "1"に設定する必要があります。中央の数字は、マイクロリットルの体積を表します。 3番目の番号は、マイクロリットル(0.1μl)を10分の1を示しています。それぞれの卒業マークは、マイクロリットルの2つの1百(0.02μl)の増分に等しい。
P20:2.0から20.0μLの間にボリュームの場合。ブラックの上位数マイクロリットル数十であり、これは唯一の20.0μlを分注するときは "0"に設定し他の二つの数字を "2"に設定する必要があります。黒の中の二番目の数字は、マイクロリットルの体積を表します。赤の3番目の数字は10を示します。マイクロリットルのTHS(0.1μL)。それぞれの卒業マークは、マイクロリットルの2つの1百(0.02μl)の増分に等しい。
P200:20.0から200μlの間にボリュームの場合。トップ数マイクロリットルの何百ものであり、これは唯一の200μlを分注するときは "0"に設定し他の二つの数字を "2"に設定する必要があります。中央の数字は、マイクロリットル数十分注体積を示し、3番目の番号は、マイクロリットルの体積を表します。それぞれの卒業マークは、マイクロリットルの2つの1の10分(0.2μl)の増分に等しい。
P1000:200から1000μLの間にボリュームの場合。トップ数マイクロリットルの何千ものですが、これは通常、 "0"に設定され、1000μLを調剤する場合にのみ "0"に設定し他の二つの数字で "1"に設定する必要があります。中央の数字は、マイクロリットル数百人のためのものです。底数が数十マイクロリットルです。それぞれの卒業マークは、2(2μl)をマイクロリットルの増分に等しい。
- 性能チェック:これらの楽器が正確さと精度が仕様値の±5%以内にとどまるように維持されている確実に、毎年校正されるべきである。最小値と最大値の設定が意図したボリュームに対応することを確認しながら、水を測定するための分析スケールを使用しています。例えば、水200μlのスケールで計量皿に転送にP1000を使用しています。水は1の密度を持っているので、その後の水1ミリリットルが1グラム(g)と同等です。したがって、水200μlの(0.2 ml)を0.2グラムと等しくなければなりません。また、先端が漏れていないとプランジャーシステムを使用して分配されるまで目的のボリュームを維持できることを確認してください。
- Micropipettorsは常にプラスチックの使い捨てチップを使用する必要があります。ピペットのバレルの最後にしっかりと先端を合わせます。押しと気密シールを確保するためにわずかにねじります。
- ヒントは、通常、オートクレーブで滅菌することができるプラスチック製の箱に詰め込まれています。ヒントを取得するためにヒントボックスを開きます。し、空気中の汚染物質との接触を最小限に抑えるためにヒントボックスを閉じます。
- いくつかのヒントは血清ピペットに綿栓に似てフィルタを備えています。これらのヒントは、多くの場合、定期的なヒントよりも高価ですので、特殊なアプリケーションに使用されています。例えば、フィルターチップを使用して、クロロホルム又は32 Pで標識したDNAのような放射性液体などの揮発性化学物質を測定するときは、汚染された入門からピペットのバレルを防ぐことができます。
- 垂直位置でピペットを保持します。
- ピペットを保つことは直立内で実行されているとピペットのバレルを汚染から液体を防ぐことができます。
- (1)レスト位置、(2)最初のピットストップ、(3)第停止( 図6、パネルB):ピペットは、3つのポジションを持っています。測定器は、2ストッププランジャーシステムを持っています。最初のピットストップは、2つの機能を備えています。最初は先端WHEへの液体の必要なボリュームで描画することですnは、残りの位置に最初のピットストップからプランジャーを解放します。 2番目の機能は、静止位置から最初のピットストップにプランジャーを押し下げたときに先端から液体の大部分を分配することです。さらにどのような液体が先端に残っている第2の停止省くにプランジャーを押す。
静止位置から最初のピットストップまでプランジャにプッシュボタンを押す。設定の体積に等しい空気が置換されます。 - 最初のピットストップまでプッシュボタンを押しながら液体に先端を浸します。
- ボトル、チューブ、フラスコの側面にピペット自体には手を触れないでください、そうでない場合はこれらの血管の内側の表面が汚染されたようになります。唯一のヒントは、無菌である。
- 先端に液体を吸引するためにゆっくりプッシュボタンを放します。プッシュボタンは、残りの位置に戻ってきたら停止します。液体がチップに描画することができますので、しばらくお待ちください。
- 先端の液体の体積は、体積Oに等しくなりますピペットのf設定。
- そのようなものを含むグリセロールなどの粘性のある液体が先端を入力するためのより多くの時間を必要とします。
- 液体からヒントを削除して、視覚的に策定され、液体が先端で期待されるレベルに達している、チップ内に気泡がないことを確認するために先端を点検します。
- 必要に応じて、液体を排出し、手動ピペットにヒントを締めます。液体を描画し、再度確認します。
- 液体を受信し、チューブの壁に対して角度(10°〜45°)でチップを置きます。液体を排出するために、徐々に最初のピットストップにプランジャにプッシュボタンを押す。次に先端の任意の残液を排出する2番目の停留所にプッシュボタンを押してちょっと待って。
- 早すぎるとプランジャーを押すと、液体がチューブ内に望ましくない気泡をスプラッタしたり、生成され追放されている可能性があります。
- 残りの位置にプランジャーを解放する前に、再液体から先端に移動します。
- ピペットで取り出しボタンを押すことによって、指定された鋭利物廃棄容器にヒントを破棄します。
4。ワークスペースのクリーンアップ
- 無菌操作の使用を必要とする実験が終了したら、すべての電源および試薬を片付けた後、ブンゼンバーナーをオフにします。汚染物質が保管場所に転送されないようにウェットティッシュで消毒実験器具(ボトル、micropipettors、ピペットチップボックス)の外表面を拭いてください。
- 場所は、適切な処分レセプタクルにガラスや有害廃棄物を汚染された。実験室廃棄物は手袋、ピペット、チップ、チューブなどの実験器具などが含まれています。非病原性生物(BSL-1)を用いた実験を行う際に病原性生物(BSL-2以上)を使用している場合に感染有害廃棄物が発生している間に非感染性有害廃棄物が生成されます。感染性廃棄物は、オートクレーブ滅菌または消毒beforのでなければなりませんメールは破棄されます。 OSHAおよび制度環境·健康·安全部門によって提供されるものと同様にBMBL( 第 5 回エド。)に記載されて実験室の安全性のガイドラインに従ってください。
- 実験台の上に全体の作業領域を拭い、再び消毒剤を蒸発させること、消毒剤は、キャニスターからワイプ前の湿らせた。
- 研究室を離れる前に防腐剤石鹸と暖かい水でよく手を洗ってください。
5。代表的な結果
液体を転送するために血清学的ピペットを使用するためのサンプルアプリケーションは、 図7に示されています。これらのピペットは、多くの場合、細菌培養の接種のためのメディアを準備する微生物学実験室で使用されています。例えば、無菌のフラスコは、最初ルリア培地(LB)は、このケースでは、培養液の指定されたボリュームで満たされ、その後細胞( 大腸菌など)少数のメディアに追加されます。血清Pを使用してipetteは、最初の培養液を無菌的にメディアのボトルからフラスコに転送する必要があります。このケースでは、LBの25ミリリットルを25ミリリットル血清ピペットを用いて125ミリリットル滅菌フラスコに加えた。次に、培養液は大腸菌を接種しなければなりません大腸菌細胞。ここでは、細胞10μlの新鮮なLB 25mlの以前に成長している培養フラスコからP20ピペットを用いて無菌的に移した。フラスコは、細胞が複製することができます(この例では、 大腸菌の細胞を37℃で一晩インキュベートした揺れプラットフォーム上のC)、時間の特定の量の成長チャンバー内でインキュベートされる。結果はその後の実験に使用することができ濁った細菌の細胞培養である。
細菌培養の希釈を行う際に血清学的ピペットも行われているように、もともとの試験管に、または試験管の間にボトルで提供されたメディアを転送するために使用されることがあります。無菌操作は、メディアの操作、これらのタイプを通して維持されていない場合し、文化が汚染されたとなり、新鮮な、汚染されていない文化が準備する必要がありますので、それらの培養物を使用して、その後の実験は延期されます。滅菌フィールドは手順全体を通して維持されていないため、エラーが発生します。たとえば、実験室のベンチまたは難培養ボトルやチューブのリムを消毒するために忘れることがあります。あなたは、ピペットの先端に触れたり、あなたの手でそれを保持しているのではなく、ベンチの上にボトルや試験管のキャップを設定することができます。正しい手順は最小限にメディアや文化の汚染を保つために重要です。 図8Aは、Eの純粋な対汚染された文化の例を示していますLB 5 mlの入ったチューブの大腸菌 。左側のパネルには純粋なEの典型的な均一な微細な濁度を表示して文化を示しています。 大腸菌培養。対照的に、右側のパネルには、生育特性は、この細菌株で想定されるから逸脱している汚染された文化を示しています。
試験管の間のメディアの誤ったボリュームの転送の結果血清ピペットを操作するとき ">技術的なエラーが発生する可能性があります。例えば、あなたは間違ってピペットのボリュームを読み取ることができます(つまり、メニスカスの上対下)か、メディアを排出することがあります完全に配信されないように先端に小さなビットを残すように設計されたTDピペットから。メディアのポイントツーポイント配信を実行するときは、間違ったキャリブレーションマークを使用して、誤ったボリュームを分配することができます。 図8Bに示すメディアの正しい対間違ったボリュームと試験管の例を示します。左側のチューブ5ミリリットル血清ピペットを用いて測定したLBの3.5 mlを含んでいます。学生はLBが策定されたメディアのポイントツーポイント配信を実施5.0ミリリットルの卒業マークに、1.5 mlのマークに分配した。右側の真空管は、同じサイズのピペットを用いて測定したLBの2.5ミリリットルを含むので、メディアのポイントツーポイント配信を行った学生の私ncorrectly 2.5 mlのマークに5.0ミリリットルのマークから、それを分配した。このミスは、その後の希釈が正しくないことを引き起こして、予定よりも高い濃度になります細菌培養になります。このエラーの伝播は、適切な細胞濃度で繰り返される必要があるでしょう失敗した実験で発生する可能性があります。液体を転送するためにmicropipettorsを使用するためのサンプルアプリケーションは、 図9に示します。これらのピペットは、PCRとゲル電気泳動用サンプルを調製するまたは細菌細胞またはファージ粒子の少量(未満1.0ミリリットル)で滅菌したメディアまたはバッファを接種することを含む、分子生物学および微生物学などの様々な実験に使用されています。提供される例では、学生は、1.8 mlのマイクロ遠心チューブにTE緩衝液の12.5μlを転送(パネルの左側のチューブ、染料は透明なマイクロ遠心チューブ内の液体の可視化を容易にするためにバッファに追加されていることに注意してください)。この手順は、正しいボリューム(パネルB)に容積計を設定するには、P20この場合、適切なピペットを選択するには、まず、次の学生を必要とした。チップは、チップにバッファのサンプルに到達するピペットのバレルから追放されることもあり得る汚染を防止するために、最後に綿栓を含む使用されていました。ヒントに液体を吸引する際には注意された場合、この予防措置は、液体がピペットのバレルにかからないようにゆっくりプランジャーを押し下げて、必要はありません。技術的なエラーが誤ってボリュームの転送で、その結果を発生する可能性があります。たとえば、ジョブの間違ったピペットを選択するか、または間違ったボリュームへの適切なピペットで体積計を設定することができます。バッファにチップを浸漬する前に、プランジャーを解放したときに先端に描画するバッファの過剰を引き起こし、最初のピットストップを越えてプランジャーを押すことができます。また、バッファに十分先端を浸すことはできませんので、空気が描かれている代わりにバッファの先端に。あなたは、先端から放出される所望の体積未満を引き起こしてマイクロ遠心チューブにバッファーを分注するとき、2番目の停留所にプランジャーを押し忘れることがあります。パネルの右側のチューブは、 図9の左側にあるチューブに相対的なバッファの不正なボリュームを含むマイクロチューブを示しています。代わりにバッファの12.5μlを分注により、学生は125μlを分注し。バッファの実質的に大きなボリュームの配信の結果、数字は体積計で同じように設定されていますが、このケースでは、間違ったピペットは、ジョブ(パネルB学生が代わりにP20からP200を使用)に選ばれました。このソリューションは、PCRなどのアプリケーション用の試薬の混合物を調製するために使用されていた場合、このミスは、その後同じチューブに加え、すべての試薬の最終濃度を変更します。したがって、それは分子生物学の手続きなど以来、実験が成功することはほとんどありませんPCRは、すべてのコンポーネントが正しく動作するために反応のための特定の濃度であることが必要になるため。
それはmicropipettors(特にバレルの内側)を確保することが常に可能ではないため、滅菌、株式ソリューションです実験を行うときに失敗してもトラブルシューティング作業を引き起こす汚染になることができます。滅菌溶液を転送するためにmicropipettorsを使用している場合、それは強くストック溶液のアリコート(メディア、バッファー、水)は血清学的ピペットで無菌操作を用いて作製することをお勧めします。それは15 mlまたは50 mlの滅菌コニカルチューブで働いてストック溶液を維持するのが一般的です。これらは、多くの場合、ピペットを運転しながら操作することが容易であり、ボリュームの転送時に汚染された場合は、原液の新鮮なアリコートと置き換えることができます。
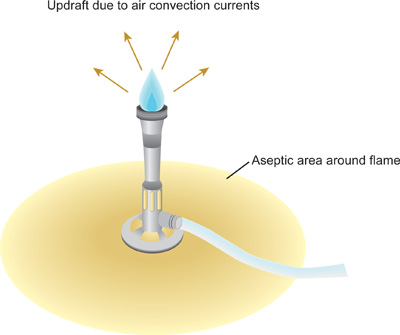
図1:ブンゼンバーナー火炎の上昇によって作成された滅菌フィールド。 minの滅菌溶液と文化の汚染をimize、それはすべての操作は無菌のフィールド内に実施されることが重要です。ガラス培養チューブやフラスコのリムは青錐体、炎の最も熱い部分の先端を通過する必要があります。プラスチック製のチューブとチップは叩かことはできません - これらは使用する前に別の方法で事前に滅菌する必要があります。

図2血清ピペットは、液体の無菌の転送に使用されます。 ()左から右に示されている25ミリリットルの図面、10ミリリットル、および5 mlピペットです。 (B)血清ピペットはプラスチックまたはガラスである可能性があります。プラスチック製のピペットは使い捨てである(1回の使用)と一般的に個別にすべての内部表面は滅菌(左側)されている紙やプラスチック製のスリーブに包まれています。ガラスピペットを複数回は、彼らが使用している合間に洗浄、滅菌されている提供使用することができます。これらは通常、金属製のキャニスターに格納されています(右側)。

図3血清ピペットは、次の2種類があります。TC( "が含まれているために")やTD( "配信する")。 TD 5 mlのピペットの説明ラベルが示されています。

図4。無菌操作。キャップと瓶、フラスコ、またはチューブから液体を吸引する場合は、ベンチで帽子を置くことはありません。に示すように反対側の手で液体を含む容器を操作しながら、その代わりに、ピペットエイドと同じ手でキャップを保持します。
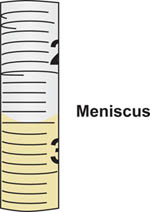
血清ピペットに液体を描画するときに図5。メニスカスが形成された。ボリュームは、メニスカスの最下部が整列ピペットで卒業マークに対応しています。この例では、メニスカスは、2.5ミリリットルgraduaと整列るマークです。
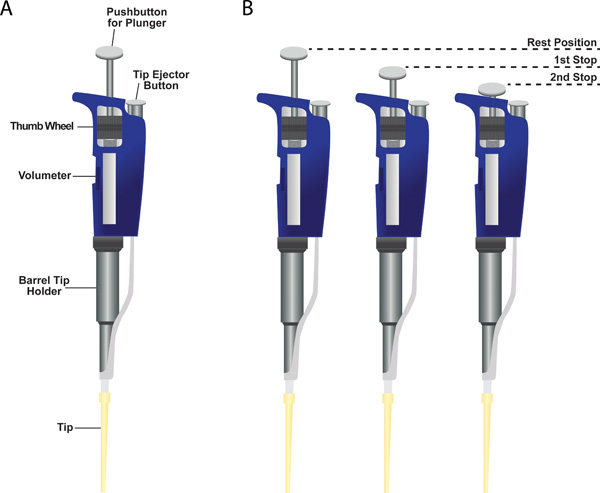
図6シングルチャンネルピ ペット。 ()に示すバレルチップホルダーの下部に取り付けられたプラスチック製の先端でサンプルピペットです。示された体積計の場所は、体積計の設定を変更するためのサムホイール、バレルチップホルダー、チップイジェクトボタンを押すと、プランジャー用のプッシュボタン。ピペットで(B)2ストッププランジャーシステム。

図7。無菌の125ミリリットルのフラスコにメディアを転送するために血清学的ピペットを使用します。右のフラスコEの文化ですが左のフラスコは、専用のメディア(LB)の25ミリリットルを持っているその後37℃で一晩インキュベートした細胞をLBに接種した結果、大腸菌 ℃、右側のフラスコ内のメディアが細胞増殖のために濁っていることに注意してください。
E 8 "SRC =" / files/ftp_upload/2754/2754fig8.jpg "/>
図8。滅菌試験管にメディアを転送するために血清学的ピペットを使用します。 (A)左のチューブは、純粋なEの5ミリリットルが含まれています大腸菌培養、右のチューブが汚染された細菌の細胞培養の5ミリリットルが含まれている。二つの文化の間で成長特性の違いに注意してください。両方が濁っていますが、右側の文化は文化のE.の期待とは異なる色と一貫性を与える菌やその他の浮遊微生物で汚染されています大腸菌細胞。右のチューブがわずか2.5 mlのLBが含まれていながら、(B)左の培養管は、3.5 mlのLBが含まれています。この音量差は、チューブへのメディアのポイントツーポイント配信を行っている間に行われたミスに起因する。

図9。ボイジャーgはmicropipettors滅菌マイクロ遠心チューブにバッファを転送する。右のチューブは、125μlを含んでいる間(A)左側のマイクロ遠心チューブには、TE緩衝液のわずか12.5μlを含んでいます。染料は透明なマイクロ遠心チューブ内の液体の可視化を容易にするためにバッファに追加されていることに注意してください。右の体積計は、P200のピペットからですが(B)左体積計は、P20ピペットからです。よくある間違いは、間違ったピペットを選択しています。番号は、P20とP200体積計で同じように間違ったボリュームの転送で間違ったピペット結果の選択を設定されていますが。

図10。ソリューションや文化の汚染を防止するために使用される層流フード。 BSL-2生物との仕事のために承認されたバイオセーフティキャビネットが示されています。
ディスカッション
無菌実験室での不要な微生物によって汚染されたなってから滅菌溶液と文化を防止するために行わルーチンプロシージャのセットを指します。このような技術は成長した細胞を必要とする実験のために不可欠です。完全に無菌である職場環境を実現することはできませんが、このように、研究室の表面を消毒ブンゼンバーナーを使用して滅菌フィールドを作成して、空気に上限なしの文化やメディアの露出を制限するなど、ボトル、チューブ、ガラスピペットなどの材料を殺菌するなどの手続き、と非滅菌表面と滅菌の楽器との接触を避けることが実験でソリューションや文化を汚染の可能性を減らすことができます。目標は、第二の天性になるため、これらの予防措置のためのものです。実験室での作業中に、これはトレーニングや練習が付属しています。
このような血清ピペットやマイクなどの楽器を使用して滅菌溶液と文化を持つボリュームの転送ropipettorsは、実験室で行わルーチンのテクニックの多くの種類の一つです。異なる実験アプリケーションは別個の、まだ正確で精度の高いボリュームを転送できる機器用に呼び出します。 micropipettorsは、ソリューションの唯一のマイクロリットル量を必要とする分子生物学的な実験に不可欠である一方血清ピペットは、ミリリットルボリュームを含むメディアの準備を必要とする細胞培養を準備する微生物学研究室で使用されています。無菌技術はこれらの機器を用いて実施される場合は、汚染が液体または実験の種類の量にかかわらず、ボリューム転送中に最小化されます。
このプロトコルで説明されていませんが、一般的に汚染を防止するために使用されるもう一つの手段は、層流フード( 図10)内で動作するようです。この装置は、組織培養用とBLS-2以上に分類される微生物で行った実験のために重要です。層流フードでは、HEPA(高効率が含まれていますワークスペースに浸透してから部屋からフィルタリングされていない空気を防止しながら、フードに流れる空気から空気中の汚染物質を除去する微粒子空気)フィルター。火炎からの熱は、フードの機能に不可欠な空気の流れを中断させるため注目すべきは、ブンゼンバーナーは、層流フード内では使用できません。
それは、実験を実行するときは、無菌の品質をチェックすると便利です。ソリューションと培地は実験操作中に汚染されないことを確認するには、常にネガティブコントロールを用意します 。たとえば、細菌培養の成長のための培養液のチューブを準備する場合は、1つのチューブだけで滅菌メディアを残して接種していません。そのような意図せずにチューブに導入し、不要な細胞の増殖から濁りなどの汚染の兆候が未接種の対照チューブを点検して接種したチューブと一緒に培地をインキュベートします。制御管が汚染されている場合、実験的な管の可能性が高いだけでなく、汚染され、実験が繰り返されなければなりません。これらの予防措置は、すべての実験を行う必要があります。
開示事項
私は、開示することは何もありません。
謝辞
数字のサンプルの培養を設定するためのイラストを準備し、カリフォルニア大学ロサンゼルス校(UCLA)クリスReddiするためにはIROCデザインでコリ·サンダース氏に感謝します。このプロジェクトの資金は、HHMI(ハワードグラント番号52006944)によって提供されていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| LBブロス | ディフコ | 244620 | 基準6でまた利用できるレシピ |
| TEバッファー: | |||
| EDTA二ナトリウム塩二水和物 | シグマ | E5134 | |
| Trizma-HClを | シグマ | T-3253 | |
| CiDecon | ディーコン·ラボラトリーズ社 | 8504 | 消毒剤 |
| エタノール | フィッシャー·サイエンティフィック | A406 | 消毒剤として使用するために、蒸留水で70%(v / v)を準備する |
参考文献
- Barker, K. At the Bench: A Laboratory Navigator. , Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. (1998).
- Biosafety in Microbiological And Biomedical Laboratories (BMBL). , 5th Ed, US Department of Health and Human Services (DHHS), Centers for Disease Control and Prevention (CDC) and National Institutes of Health (NIH), U.S. Government Printing Office. Washington DC. Available from: http://www.cdc.gov/biosafety/publications/bmbl5/index.htm (2009).
- Bykowski, T., Stevenson, B. Aseptic Technique. Current Protocols in Microbiology. Appendix 4, Appendix 4D(2008).
- Coté, R. J. Aseptic Technique for Cell Culture. Current Protocols in Cell Biology. Chapter 1, Unit 1.3(2001).
- Grimes, S. E. A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. RAP Publication. AC802/E, 12-13 (2002).
- Guzman, K. Pipetting: A Practical Guide. The American Biology Teacher. 63 (2), 128-131 (2001).
- Jordan, T., et al. RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , Howard Hughes Medical Institute. (2008).
- Sambrook, J., Russell, D. W. Molecular Cloning - A Laboratory Manual. , 3rd Ed, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. 978-087969576 (2001).
- Seidman, L. A., Moore, C. J. Basic Laboratory Methods for Biotechnology: Textbook and Laboratory Reference. , Prentice Hall, Inc. Upper Saddle River, New Jersey. (2000).
- Pipettes, Calibration & Repair Service - Pipette.com [Internet]. , Available from: http://pipette.com/public/staticpages/guidetopipetting.aspx (2012).
- On-Line Resources for Biology: Table of Contents [Internet]. , Available from: http://abacus.bates.edu/~ganderso/biology/resources/index.html (2012).
- PIPETMAN P User's Guide. , Gilson Inc. Available from: http://www.gilson.com/Resources/LT801120_a_eng_030209%20BD.pdf (2012).
- Sterile Technique - Laboratory Wiki [Internet]. , Available from: http://lab.wikia.com/wiki/Sterile_Technique (2012).
- Air displacement pipette - Wikipedia, the free encyclopedia [Internet]. , Available from: http://en.wikipedia.org/wiki/Air_displacement_pipette (2012).
- Disinfectant - Wikipedia, the free encyclopedia [Internet]. , Available from: http://en.wikipedia.org/wiki/Disinfectant (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved