Method Article
Aseptische Labortechnik: Volume Transfers mit serologischen Pipetten und Mikropipetten
In diesem Artikel
Zusammenfassung
Bei der Arbeit in einem Labor, ist es zwingend notwendig, um Quellen der Kontamination zu minimieren. Aseptische Technik bezieht sich auf Verfahren, die Übertragung von Kulturen und Reagenzien ermöglichen, während der Kontakt mit nicht-sterilen Oberflächen. Serologische Pipetten und Mikroliterpipetten werden verwendet, um genaue Volumen, ohne dabei die Sterilität der Lösungen in Versuchen verwendet zu messen.
Zusammenfassung
Mikroorganismen sind überall - in der Luft, des Bodens und menschlichen Körper als auch auf unbelebten Oberflächen wie Labortische und Computer-Tastaturen. Die weite Verbreitung von Mikroben erzeugt eine reichliche Menge von möglichen Verunreinigungen in einem Labor. Um experimentelle Erfolg zu gewährleisten, muss die Zahl der Verunreinigungen an Geräten und Arbeitsflächen minimiert werden. Gemeinsame unter vielen Experimenten in der Mikrobiologie sind Techniken, bei denen die Messung und Übertragung von Kulturen mit bakteriellen Zellen oder Viruspartikeln. Um dies tun, ohne Kontakt mit unsterilen Oberflächen oder verunreinigen sterilen Medien erfordert (1) Herstellung einer sterilen Arbeitsbereich (2) eine exakte Einstellung und genau liest Instrumente für die aseptische Transfer von Flüssigkeiten, und (3) richtig zu manipulieren Instrumente, Kulturen Flakons, Flaschen und Rohre in einem sterilen Bereich. Lernen Sie diese Verfahren ruft für Ausbildung und Praxis. Zunächst sollten die Maßnahmen nur langsam, bedächtig und kontrolliert mit dem Ziel einer für die aseptische technik zur zweiten Natur werden bei der Arbeit an der Werkbank. Hier präsentieren wir Ihnen die Schritte zur Messung von Volumes mit serologischen Pipetten und Mikroliterpipetten in einem sterilen Bereich durch einen Bunsenbrenner erstellt. Volumenbereich von Mikroliter (ul) bis Milliliter (ml) je nach Instrument eingesetzt. Flüssigkeiten im Allgemeinen übertragen gehören steriler Bouillon oder chemische Lösungen sowie bakterielle Kulturen und Phagen-Aktien. Durch die folgenden Verfahren sollen die Studierenden in der Lage:
- Die Arbeiten innerhalb des sterilen Feldes durch die Bunsenbrennerflamme erstellt.
- Verwenden Sie serologischen Pipetten, ohne Sterilität der Instrumente.
- Absaugen von Flüssigkeiten mit serologischen Pipetten, genau zu lesen kalibrierten Volumina durch Ausrichten des Meniskus durch die Flüssigkeit zu den Teilstrichen auf der Pipette gebildet.
- Halten Kultur Flaschen, Flakons, Tuben und ihrer jeweiligen Caps sterile Flüssigkeit während des Transfers.
- Identifizieren verschiedene Anwendungen für Kunststoff gegenüber Glas serologische pipEttes.
- Staatliche Grenzen für Genauigkeit Mikroliterpipetten.
- Präzise und genau eingestellt Volumes auf Mikroliterpipetten.
- Wissen, wie man richtig mit dem ersten und zweiten Station auf einer Mikropipette zum Ansaugen und übertragen richtige Bände.
Protokoll
1. Bereiten Sie ein steriler Arbeitsraum
- Vor Beginn der Sterilisationsverfahren in Ihrem Arbeitsbereich, waschen Sie Ihre Hände gründlich mit antiseptischen Seife und warmem Wasser.
- Achten Sie darauf, wieder die Hände waschen, immer wenn Sie den Verdacht haben, haben Kontamination von Ihrem experimentelle Manipulationen.
- Räumen Sie alle Materialien, überladen Sie Ihren Arbeitsbereich auf dem Labortisch. Entfernen Sie Vorbefeuchtetes Desinfektionsmittel aus dem Kanister wischen und wischen Sie den gesamten Bereich. Lassen Sie das Desinfektionsmittel verdunstet - nicht trocken wischen!
- Desinfektionsmittel wie Alkohol (Isopropanol oder 70% Ethanol) oder phenolischen Verbindungen (o-Phenylphenol).
- Um Aerosolisiermechanismus oder die Erzeugung eines feinen Nebels mit bakteriellen Zellen, und die Ausbreitung von mikrobiellen Verunreinigungen zu vermeiden, sollten Abgabe Desinfektionsmittel aus einer Spritzflasche.
- Die Trocknung von Mikroorganismen ist eine der wirksamsten Mittel zur Oberflächen zu dekontaminieren.
- Selbst wenn jemand hat vor kurzem den Labortisch eingesetzt und das Tischgerät wurde nach unten mit einem Desinfektionsmittel abgewischt, beginnen immer Ihr Labor Zeit durch Abwischen der Bank.
- Nachdem das Desinfektionsmittel vollständig getrocknet ist, verwenden Sie einen Zünder, um den Bunsenbrenner anzünden. Stellen Sie die Flamme, so daß ein blauer Kegel in der Mitte der Flamme zu sehen ist. Die Flamme wird nun produziert einen Aufwind oder in der Luft Konvektionsströme, in denen warme Luft steigt nach oben und weg von der Flamme (Abbildung 1). Als Wärme steigt, sind Mikroorganismen und Staubpartikel nach oben und weg von der unmittelbaren Arbeitsumgebung gezwungen. Arbeiten Sie langsam, sorgfältig und bewusst zu jeder Zeit in diesem Bereich durch den Bunsenbrenner geschaffen, um als sterile Feld bezeichnet. Halten Sie den Bunsenbrenner an während des gesamten Verfahrens.
- Die Spitze des blauen Kegels ist der heißeste Teil der Flamme.
- Achten Sie darauf, den Aufwind durch schnelle Bewegungen, die sich dramatisch verändern die ai störenr Strömungen rund um den Labortisch. Erstellen eines Aufwind mit dem Bunsenbrenner minimiert die Möglichkeit von Mikroorganismen und Staub fällt auf die Bank oder in offene Flaschen, Tuben oder Flaschen in den Arbeitsbereich.
- Ordnen Sie die Vorräte für das Verfahren auf dem Labortisch in der Nähe des sterilen Feldes benötigt. Achten Sie darauf, alle Materialien richtig beschriftet sind.
- Lieferungen können serologischen Pipetten und Mikroliterpipetten, sterile Kulturröhrchen, sterile Flaschen-, Medien-Flaschen mit Brühe, sterile Mikrozentrifugenröhrchen, Mikropipettierer Tipps, Racks für Röhrchen, Bakterienkulturen und Phagen-Aktien.
- Flüssige Medien sollten in einem Autoklaven bei 121 ° C werden für mindestens 15 Minuten auf dem flüssigen Einstellung sterilisiert. Größere Mengen an Medien (> 1 l) erfordern längere Zeiten Autoklaven. Labware sollte in einem Autoklaven bei 121 ° C für mindestens 30 Minuten auf die Schwerkraft (trocken) Einstellung sterilisiert.
- Im Allgemeinen können sterile Lösungen bei 4 gespeichert werden° C für bis zu 5 Monate. Beachten Sie, dass Lagerzeit wesentlich ist für Lösungen, die instabile Komponenten wie zB Antibiotika reduziert - immer überprüfen, den Empfehlungen des Herstellers.
2. Umfüllen von Flüssigkeiten mit serologischen Pipetten
- Serologische Pipetten in vielen Größen und Ausführungen erhältlich: Kunststoff oder Glas, Einweg-oder Mehrweg, gezogen oder gesteckt. Diese werden kalibriert, um Volumina von 0,1 ml bis 25 ml zu liefern.
- Gängige Größen sind für serologischen Pipetten 5 ml, 10 ml und 25 ml und sollte für die keimfreie Flüssigkeit Transfers von 0,1 ml oder mehr (Panel A von Abbildung 2) verwendet werden. Es gibt auch größere serologischen Pipetten, die Volumina von bis zu 100 ml liefern kann, allerdings ist der Schwerpunkt dieses Protokoll auf den häufigeren, kleineren Pipetten.
- Vorsterilisiert Pipetten mit einem Wattebausch für Mikrobiologie und Gewebekulturexperimenten benötigt. Der Stecker sollte nicht von der zu entfernendenp der Pipette, es ist entworfen, um als Barriere, um eine Überfüllung der Pipette zu funktionieren.
- Verschiedene Anwendungen erfordern im Vergleich zu Kunststoff Glas serologischen Pipetten. Glas wird für organische Lösungsmittel benötigt. Entweder kann verwendet werden, bei der Durchführung von BSL-1 Experimente auf dem Labortisch werden. Nur Kunststoff kann verwendet werden, bei der Arbeit in einer biologischen Sicherheitswerkbank mit BSL-2 Organismen, wo ein Bunsenbrenner nicht verwendet werden kann. Es wird auch empfohlen, dass Kunststoff für Anwendungen, die Übertragung von geschmolzenem Agar verwendet werden.
- Serologische Pipetten sind in zwei Ausführungen: TC ("zu enthalten") oder TD ("to deliver"). TC Pipetten liefern all das Volumen, einschließlich der Spitze, und muss "ausgeblasen" werden oder gespült, um das angegebene Volumen zu bekommen. TD Pipetten werden kalibriert, um ein klein wenig in der Spitze nicht zu verlassen, ausgeliefert. Achten Sie darauf, das Etikett auf dem Körper der Pipette nahe der Spitze, um festzustellen, welcher Art sie ist (Abbildung 3) zu überprüfen. Die am häufigsten verwendeten sind TD Pipetten, die Mar sindked mit Doppel-Ringe an der Spitze.
- Werfen Sie einen sterilen Plastik serologischen Pipette (auch genannt eine volumetrische Pipette) und entfernen Sie vorsichtig das Papier Hülse am Ende mit dem Wattebausch durch Schälen sie weg wie die Haut einer Banane - entfernen Sie nicht den ganzen Ärmel, Schutz der Spitze des die Pipette, die in Kontakt mit der Flüssigkeit zu übertragenden kommen. Berühren Sie nur den oberen Teil der Pipette (oberhalb der Graduierung) mit den Händen.
- Niemals in einer sterilen Lösung gehen mit einer Pipette verwendet, auch wenn große Sorgfalt darauf verwendet wurde, damit es steril.
- Glas serologischen Pipetten werden typischerweise in Behältnissen (Panel B der 2) gespeichert. Lösen Sie die Oberseite des Behälters dann vorsichtig abnehmen, und Flammen die offenen Enden der Kappe und Kanister. Setzen Sie die Kappe nach unten, auf die Seite, auf der Bank desinfiziert. Nehmen Sie eine Pipette aus dem Kanister, indem es horizontal und sanft schütteln, so dass die Spitzen von ein oder zwei PipettenTES ragen etwa einen Zentimeter und leicht ergriffen werden können. Legen Sie den Kanister auf die Seite und entfernen Sie eine Pipette, aber vorsichtig sein, nicht um die anderen Pipetten in den Behälter zu berühren. Berühren Sie nicht die untere Spitze der Pipette mit den Händen, und vermeiden Sie den Kontakt der Spitze mit anderen nicht-sterilen Oberflächen.
- Bringen Sie eine Pipette Hilfe wie eine Glühbirne, Pumpe oder Pistole auf das obere Ende der serologischen Pipette. Nehmen Sie das Papier aus dem Ärmel Plastikpipette. Halten Sie die Pipette Hilfe in der rechten Hand.
- Bei Verwendung einer Glaspipette, vorbei an der unteren Drittel der Pipette durch den blauen Kegel in der Bunsenbrenner-Flamme für 1-3 Sekunden. Drehen der Pipette 180 °, wie es durch die Flamme durchsetzt. Kunststoff-Pipetten und Röhrchen kann nicht geflammt werden.
- Wenn Linkshänder, halten Sie die Pipette Hilfe in der linken Hand und führen nachträgliche Manipulationen Kultur Flaschen und Tuben mit der rechten Hand.
- Verschmutzung neigt dazu, mit Kunststoff-Pipetten auftreten, wenn die endgültige Aberkennung inc.hes der Pipette aus dem Ärmel, weil die sterile Spitze kommt in Kontakt mit dem Teil der Hülse durch Ihre Hände berührten.
- Entfernen Sie den Deckel der Flasche mit sterilen Medien. Setzen Sie die Kappe auf dem Labortisch, sondern halten Sie ihn zwischen Ihren Ringfinger und Handfläche der rechten Hand, während die Manipulation der Pipette Beihilfe mit dem Daumen, Zeige-und Mittelfinger der gleichen Hand (Abbildung 4). Halten Sie die Flasche in einem 45 ° Winkel, vorbei am Rand der Flasche durch die Flamme des Bunsenbrenners, die Schaffung eines sterilen Bereich rund um die offene Flasche.
- Obwohl am besten vermieden werden, wenn Sie die Kappe muss legte, legen Sie sie verdeckt auf einer desinfizierten Fläche. Mit einer Kappe, die nach oben weist, besteht eine größere Wahrscheinlichkeit einer Kontamination von Bewegungen von Objekten oder Hände, wodurch Luftströmungen, die Mikroorganismen und Staubpartikel auf der Innenfläche der Kappe steigen verursachen.
- Der Zweck des flammenden ist nicht zu sterilisieren, sondern um die Öffnung o erwärmenf die Flasche und erstellen Luft Konvektionsströme nach oben und weg von der Öffnung (dh Aufwind). Das warme, aufsteigende Luft verhindert, dass Staubpartikel und andere Verunreinigungen in die Flasche.
- Halten Sie den sterilen Behälter offen für so wenig Zeit wie möglich. Es ist wichtig, halten die Punkte für die Zulassung von Mikroorganismen in der Luft auf ein Minimum während des gesamten Verfahrens.
- Vermeiden Sie Husten, Niesen, Sprechen und andere unbeabsichtigte Bewegung während sterilen Behältern geöffnet sind.
- Nie passieren Hände und Finger über den Rand eines sterilen Bereich (dh offene Flaschen oder Flakons, die Innenseite von Rohren und Flaschenverschlüsse), sobald sie durch die Bunsenbrennerflamme weitergegeben worden sein.
- Immer mit offener Flamme arbeiten beim Öffnen von sterilen Röhrchen oder Flaschen. Nie mehr als eine Tube, Flasche oder Kolben offen auf der Bank zu einem Zeitpunkt. Flaming sollte sofort nach dem Öffnen und kurz vor Schließung Tuben, Flaschen und Fläschchen getan werden.
- Setzen Sie die Spitze des Seromiologische Pipette in die Flasche mit den sterilen Medien dann absaugen, oder zeichnen Sie die Probe aseptisch, aus der Flasche. Verwenden Sie die Pipette Hilfe, um den Fluss der Probe in die Pipette zu kontrollieren. Genau lesen Sie die Lautstärke in die Pipette durch Ausrichten des Meniskus auf der Oberseite der Flüssigkeitssäule auf die Teilstriche auf dem geeichten Pipette (Abbildung 5) gebildet gezogen.
- Nicht mit dem Mund pipettieren! Verwenden Sie immer eine Pipette Hilfe (Pumpe, Birne, oder Pistole).
- Beachten Sie die Folge von Zahlen bei der Bestimmung des Volumens abgesaugt. Die Zahlen können gedruckt Spitze nach oben, oder umgekehrt, oder oft mal in beide Richtungen werden.
- Beim Lesen der Lautstärke, immer Pipette senkrecht halten, senkrecht zum Boden, und zeigen Sie die Flüssigkeitsmeniskus Dead-on auf Augenhöhe.
- Serologische Pipetten sind nur so genau wie die kleinste Schrittweite markierten, die typischerweise 0,1 ml für 5 ml und 10 ml-Pipetten und 0,2 ml für 25 ml-Pipetten. Ichf genauer benötigt wird, kann eine serologische Pipette in Kombination mit einer Mikropipette verwendet werden.
- Führen Sie den Rand der Flasche durch den Bunsenbrenner wieder einmal, dann setzen Sie die Kappe wieder auf die Flasche. Stellen Sie die Flasche beiseite Medien.
- Brennen Sie nicht selbst mit dem Bunsenbrenner in Eile, um die Flasche zu schließen.
- Halten Sie ein Reagenzglas oder Kolben in der linken Hand. Entfernen Sie und halten Sie die Kappe wie in Schritt 4 beschrieben. Erstellen Sie einen sterilen Bereich durch Abflammen den Rand der Röhre oder der Kolben in den Bunsenbrenner.
- Dosieren Sie die Medien in der Pipette in das Röhrchen oder Kolben. Steuern den Fluss der Probe, damit es nicht spritzt aus dem Rohr oder Kolben.
- Die Volumina können so bemessen, dass das gesamte Volumen zugeführt wird und die Pipette Drains vollständig oder ein spezifisches Volumen, wenn wir eine Punkt-zu-Punkt-Zustellung (ein Volumen Kennzeichnung zu einem anderen) erreicht werden.
- Führen Sie den Rand der Röhre oder der Kolben durch die Verbrennung BunsenER Flamme noch einmal, dann setzen Sie die Kappe. Stellen Sie den Schlauch oder die Kolben beiseite. Nehmen Sie die Pipette Hilfe, und entsorgen Sie die Pipette in die richtigen Abfallbehälter.
- Plastic serologischen Pipetten sind Einweg, während Glas serologischen Pipetten kann sterilisiert und wieder verwendet werden. Die ordnungsgemäße Entsorgung erfordert Kunststoffpipetten in einem dafür vorgesehenen Behälter für scharfe Gegenstände (starr mit Kunststoff ausgekleidet Entsorgungssack) platziert werden, während Glaspipetten sollte zunächst in einem Behälter mit 10% Bleichmittel, um die inneren und äußeren Oberflächen desinfizieren eingetaucht werden. Dann werden die Glas-Pipetten sollten gründlich mit Labor-Waschmittel gewaschen werden, mit destilliertem Wasser gespült und im Autoklaven sterilisiert.
- Die gleichen Schritte sollten bei der Impfung Medien mit einer Bakterienkultur oder Phagen Lager oder beim Durchführen einer seriellen Verdünnungen werden.
3. Übertragen von Flüssigkeiten mit Mikropipetten
- Präzise Messung und Dosierung von Kleinstmengen können accompli seinvergossen mit Mikropipetten (auch als Pipetman genannten, Tafel A von 6). P2 für 0,2-2 ul, P10 für 1-10 ul, P20 für 2-20 ul, P200 für 20 bis 200 ul und P1000 für 200 bis 1000 ul: Diese Instrumente in verschiedenen Größen jeweils mit einem spezifischen Volumen Reichweite kommen.
- Gönnen Mikroliterpipetten mit Sorgfalt, wie sie sind Präzisionsinstrumente. Lassen Sie sie nicht liegend auf dem Labortisch unbeaufsichtigt, wo sie abgeschlagen werden kann und beschädigt wird. Nicht in die Pipetten in Kontakt mit ätzenden Chemikalien kommen.
- Für Volumina von mehr als 1000 ul, verwenden Sie eine serologische Pipette.
- Obwohl die Arbeit innerhalb des sterilen Feldes durch den Bunsenbrenner erstellt, nicht Flamme Mikroliterpipetten, Rohren und Kunststoff-Tipps. Die Rohre und Tipps sollten im Voraus sterilisiert werden. Die Mikroliterpipetten kann sich mit einem vorbefeuchtete Desinfektionsmittel abgewischt werden vor Gebrauch abwischen.
- Ein numerischer Volumeter zeigt die abgegebene Volumen kann durch Drehen Einstellknopf eingestellt werden. EINSTELLBARt das Volumen, bevor Sie mit # 3 fort.
- NIEMALS Drehen Sie den Einstellknopf über dem vorgesehenen Bereich!
- Um höchste Genauigkeit zu erhalten, wenn die Verringerung der Lautstärke-Einstellung auf der Mikropipette, langsam Rad nach unten, das Rändelrad darauf achten, nicht zu über das Ziel hinausschießen Teilstrich.
- Um höchste Genauigkeit zu erhalten, wenn die Erhöhung der Lautstärke-Einstellung auf der Mikropipette, wählen Sie das Rändelrad up, vorbei an der gewünschten Teilstrich um 1/3 einer Umdrehung. Dann langsam nach unten wählen Sie das Rändelrad, um das beabsichtigte Volumen zu erreichen, so dass Sie darauf, nicht über das Ziel hinausschießen Teilstrich.
Der Volumenzähler zeigt drei Zahlen. Abhängig von der Mikropipette, werden die Zahlen anders interpretiert. Beachten Sie, dass jeder Mikropipette nur so genau wie das kleinste Teilstrich ist.
P2: Für Volumina zwischen 0,2 bis 2,0 pl. Die obere Zahl gibt Volumen im Mikroliter. Die zweite Zahl indicates Zehntel Mikroliter (0,1 ul), und die dritte Zahl darstellt Hundertstel Mikroliter (0,01 ul). Jeder Teilstrich entspricht einem Zuwachs von zwei Tausendstel (0,002 ul) von einem Mikroliter.
P10: Für Volumina zwischen 1,0 bis 10,0 ul. Die obere Reihe ist für zehn Mikroliter; dies in der Regel wird bei "0" gesetzt und sollte nur bei "1" mit den beiden anderen Zahlen auf "0" gesetzt bei der Abgabe von 10,0 ul eingestellt werden. Die mittlere Zahl gibt Volumen im Mikroliter. Die dritte Zahl gibt zehntel Mikroliter (0,1 ul). Jeder Teilstrich entspricht einem Zuwachs von zwei Hundertstel (0,02 ul) von einem Mikroliter.
P20: Für Volumina zwischen 2,0 bis 20,0 ul. Die obere Reihe in Schwarz ist für zehn Mikroliter; sollte dies nur bei "2" mit den beiden anderen Zahlen auf "0" gesetzt bei der Abgabe von 20,0 ul eingestellt werden. Die zweite Zahl in Schwarz zeigt das Volumen in Mikroliter. Die dritte Zahl in Rot zeigt an, zehnths von einem Mikroliter (0,1 ul). Jeder Teilstrich entspricht einem Zuwachs von zwei Hundertstel (0,02 ul) von einem Mikroliter.
P200: Bei Volumen zwischen 20,0 bis 200 ul. Die obere Reihe ist für Hunderte von Mikroliter; sollte dies nur bei "2" mit den beiden anderen Zahlen auf "0" gesetzt bei der Abgabe von 200 ul eingestellt werden. Die mittlere Zahl gibt die dosierte Volumen in zehn Mikrolitern, und die dritte Zahl zeigt den Volumen in Mikroliter. Jeder Teilstrich entspricht einem Zuwachs von zwei ein Zehntel (0,2 ul) von einem Mikroliter.
P1000: Für Mengen zwischen 200-1000 ul. Die obere Reihe ist für Tausende von Mikroliter; dies in der Regel wird bei "0" gesetzt und sollte nur bei "1" mit den beiden anderen Zahlen auf "0" gesetzt bei der Abgabe von 1000 ul eingestellt werden. Die mittlere Zahl ist seit Hunderten von Mikroliter. Die untere Reihe ist für zehn Mikroliter. Jeder Teilstrich entspricht einem Zuwachs von zwei (2 ul) Mikroliter.
- Performance-Check: Diese Instrumente sollten jährlich kalibriert werden, wodurch Genauigkeit und Präzision werden beibehalten, um innerhalb von ± 5% der Spezifikationen bleiben. Verwenden Sie einen analytischen Maßstab, um Wasser zu messen und sicherstellen, die minimalen und maximalen Einstellungen, um die beabsichtigte Volumen entsprechen. Verwenden Sie zum Beispiel einen P1000 für Transfers 200 ul Wasser bis zu einem Gewicht von Schüssel auf die Waage. Da Wasser eine Dichte von 1, dann 1 ml Wasser entspricht 1 Gramm (g). Somit sollte 200 ul (0,2 ml) Wasser gleich 0,2 g. Stellen Sie außerdem sicher, dass die Spitze nicht auslaufen und pflegen können, bis die gewünschte Lautstärke mit Hilfe verzichtet Kolben-System.
- Mikropipetten müssen mit Kunststoff-Einweg-Tips zu jeder Zeit benutzt werden. Fit eine Spitze fest auf dem Ende des Zylinders der Mikropipette. Nach unten drücken und drehen sich leicht auf eine luftdichte Abdichtung zu gewährleisten.
- Trinkgelder sind in der Regel in Plastikboxen, die durch Autoklavieren sterilisiert werden kann verpackt. Öffnen Sie den Tipp aktivieren, um eine Spitze abrufenSchließen Sie dann die Spitze Box, um Kontakt mit Verunreinigungen in der Luft zu minimieren.
- Einige Tipps haben Filter ähnlich den Wattepfropfen auf serologischen Pipetten. Diese Tipps sind oft teurer als regelmäßige Tipps und somit sind für spezielle Anwendungen eingesetzt. Zum Beispiel bei der Messung von flüchtigen Chemikalien wie Chloroform oder radioaktiven Flüssigkeiten, wie zB 32 P-markierte DNA, mit Filterspitzen hilft zu verhindern, den Lauf der Mikropipette vom Erhalten kontaminiert.
- Halten Sie die Mikropipette in eine vertikale Position.
- Keeping the Mikropipette wird aufrecht Auslaufen von Flüssigkeiten innerhalb und verunreinigen den Lauf der Mikropipette zu verhindern.
- Die Mikropipette hat drei Positionen: (1) Ruhestellung (2) Der erste Halt, und (3) Zweite Station (Abbildung 6, Panel B). Das Instrument hat eine Zwei-Stopp-Kolben-System. Die erste Station hat zwei Funktionen. Die erste ist, in der gewünschten Menge von Flüssigkeit in die Spitze zu ziehen WHEn Lösen des Kolbens von der ersten Station in die Ruheposition. Die zweite Funktion ist, die Mehrheit der Flüssigkeit aus der Spitze verzichtet beim Niederdrücken des Kolbens aus der Ruheposition in die erste Station. Weitere Herunterdrücken des Kolbens bis zum zweiten Anschlag verzichtet auf was auch immer flüssig bleibt in der Spitze.
Drücken Sie die Taste auf den Kolben aus der Ruhelage bis zum ersten Anschlag. Air gleich dem Volumen der Einstellung verschoben wird. - Tauchen Sie die Spitze in die Flüssigkeit bei gedrückter Taste bis zum ersten Anschlag.
- Berühren Sie nicht die Mikropipette sich zu den Seiten der Flaschen, Tuben und Flaschen, sonst die Innenflächen dieser Schiffe wird nicht verunreinigt wird. Nur die Spitzen sind steril.
- Lassen Sie die Taste, um die Flüssigkeit langsam in die Spitze zu saugen. Aufhören, sobald die Drucktaste ist zurück in die Ruheposition. Warten Sie einen Moment so flüssig in die Spitze gezogen werden können.
- Das Volumen der Flüssigkeit in der Spitze wird gleich dem Volumen of die Einstellung der Mikropipette.
- Viskose Flüssigkeiten wie solche, die Glycerin benötigen mehr Zeit, um die Spitze zu gelangen.
- Entfernen Sie die Spitze aus der Flüssigkeit, und die Inaugenscheinnahme der Spitze, um zu bestätigen, dass die Flüssigkeit aufgestellt hat das erwartete Niveau in der Spitze erreicht und es gibt keine Luftblasen in der Spitze.
- Wenn nötig, zu vertreiben und die Flüssigkeit manuell ziehen Sie die Tipps auf der Mikropipette. Zeichnen Sie die Flüssigkeit und erneut prüfen.
- Die Spitze in einem Winkel (10 ° bis 45 °) gegen die Wand des Rohres Aufnahme der Flüssigkeit. Um die Flüssigkeit zu vertreiben, langsam drücken Sie die Taste auf den Kolben bis zum ersten Anschlag. Warten Sie einen Moment und drücken Sie die Taste bis zum zweiten Anschlag, um die restliche Flüssigkeit in der Spitze zu vertreiben.
- Drücken Sie den Kolben zu schnell kann dazu führen, wobei die Flüssigkeit ausgestoßen zu spritzen oder werden unerwünschte Blasen in der Röhre.
- Bevor er den Kolben in die Ruheposition, neubewegen Sie die Spitze aus der Flüssigkeit.
- Die Spitzen in bestimmten Sharps Abfallbehälter durch Drücken der Auswurf-Taste auf der Mikropipette.
4. Reinigen der Arbeitsumgebung
- Wenn es mit einem Experiment zur Verwendung von aseptischen Bedingungen fertig sind, schalten Sie den Bunsenbrenner, dann weglegen alle Lieferungen und Reagenzien. Wischen Sie die Außenflächen geräte (Flaschen, Mikroliterpipetten, Pipettenspitze Boxen) mit einem vorbefeuchtete Desinfektionsmittel abwischen, um sicherzustellen, Verunreinigungen nicht auf den Speicherort übertragen.
- Ort kontaminierte Glaswaren und gefährliche Abfälle in die ordnungsgemäße Entsorgung Behälter. Laborabfälle umfasst Laborgeräte aus wie Handschuhe, Pipetten, Spitzen und Rohren. Nicht infektiöse gefährlichen Abfällen erzeugt wird, wenn die Durchführung von Experimenten mit nicht-pathogenen Organismen (BSL-1), während infektiösen Sondermüll wird erzeugt, wenn mit pathogenen Organismen (BSL-2 oder höher). Infektiöse Abfälle müssen autoklaviert oder desinfiziert werden vor deme es verworfen wird. Befolgen Sie die Sicherheit im Labor-Richtlinien in BMBL (5 th Ed.) Als auch solche von der OSHA und institutionelle Environmental Health and Safety-Abteilungen zur Verfügung gestellt beschrieben.
- Wischen Sie den gesamten Arbeitsbereich auf dem Labortisch mit Vorbefeuchtetes Desinfektionsmittel aus dem Kanister zu wischen, so dass wieder einmal das Desinfektionsmittel verdunstet ist.
- Waschen Sie Ihre Hände gründlich mit antiseptischen Seife und warmem Wasser vor dem Verlassen des Labors.
5. Repräsentative Ergebnisse
Ein Anwendungsbeispiel für die Verwendung von serologischen Pipetten auf Flüssigkeiten übertragen wird in Abbildung 7 dargestellt. Diese Pipetten werden häufig im mikrobiologischen Labor verwendet werden, um Medien für die Impfung mit bakteriellen Kulturen vorzubereiten. Zum Beispiel, sterilen Kolben zuerst mit einer angegebenen Menge Kulturbrühe gefüllt, in diesem Fall Luria Broth (LB), dann eine kleine Anzahl von Zellen (wie zB E. coli) zu den Medien zugegeben. Mit Hilfe eines serologischen pipette zunächst die Brühe muss aseptisch aus der Media-Flasche werden, um den Kolben überführt. In diesem Fall wurden 25 ml LB in einen 125 ml sterile Flasche unter Verwendung einer 25 ml serologische Pipette zugegeben. Als nächstes muss die Brühe mit E. geimpft werden coli-Zellen. Hier wurden 10 ul Zellen aseptisch mit einer P20 Mikropipette aus einer zuvor wachsenden Kulturflasche zur 25 ml frisches LB übertragen. Der Kolben wird in einer Wachstumskammer für eine bestimmte Zeitdauer inkubiert, so dass die Zellen zu replizieren (in diesem Beispiel, die E. coli-Zellen wurden über Nacht bei 37 ° C auf einem Schüttler inkubiert). Das Ergebnis ist eine trübe Bakterienzellkultur, die für den nachfolgenden Experimenten verwendet werden können.
Serologische Pipetten können auch verwendet, um Medien in einer Flasche Teströhrchen zugeführt übertragen werden, oder zwischen Reagenzgläser, als getan, wenn die Verdünnungen einer Bakterienkultur. Wenn aseptische Technik ist nicht in all diesen Arten von Medien Manipulationen aufrechterhalten , Dann Kulturen verunreinigt werden, und nachfolgende Experimente unter Verwendung dieser Kulturen wird verzögert, weil frische, unberührte Kulturen werden müssen vorbereitet werden. Fehler auftreten, weil ein steriles Feld wird nicht während des gesamten Verfahrens beibehalten. Zum Beispiel können Sie vergessen, den Labortisch oder Flamme der Rand einer Kultur Flasche oder Tube zu desinfizieren. Möglicherweise berühren Sie die Spitze der Pipette oder setzen Sie die Kappe von der Flasche oder dem Reagenzglas auf der Bank statt Halten in der Hand. Richtige Verfahren ist für halten Kontamination von Medien und Kulturen auf ein Minimum. 8A zeigt ein Beispiel eines reinen gegenüber kontaminierten Kultur von E. coli in einem Röhrchen, das 5 ml LB. Die linke Tafel zeigt eine Kultur Anzeige gleichmäßige feine Trübung typisch für einen reinen E. coli-Kultur. Im Gegensatz dazu zeigt das rechte Fenster eine verunreinigte Kultur, in der die Wachstumseigenschaften von denen für diesen Bakterienstamm erwarteten Ergebnissen abweichen.
"> Technische Fehler kann auftreten, wenn die Manipulation serologischen Pipetten was zu fehlerhaften Übertragung der Volumina von Medien zwischen Reagenzgläsern. Zum Beispiel können Sie die Lautstärke an der Pipette falsch gelesen (dh oben gegen unten im Meniskus) oder Sie können die Medien zu vertreiben komplett aus einer Pipette TD, die entworfen, um ein klein wenig in der Spitze nicht zu liefernden verlassen wurde. Bei der Durchführung einer Punkt-zu-Punkt-Bereitstellung von Medien, können Sie den falschen Kalibrierung Marken verwenden und verzichten die falsche Lautstärke. 8B zeigt ein Beispiel von Teströhrchen mit korrekter gegenüber falschen Mengen von Nährmedien. Das Rohr auf der linken enthält 3,5 ml LB mit einer 5 ml serologische Pipette gemessen. Der Student durchgeführt eine Punkt-zu-Punkt-Zuführung des Mediums, in dem LB ausgestellt wurde auf die 5,0 ml Teilstrich und verzichtet auf die 1,5-ml-Marke. Die Röhre auf der rechten Seite enthält 2,5 ml LB mit einer Pipette von der gleichen Größe gemessen, weil der Student, der die Punkt-zu-Punkt-Bereitstellung von Medien durchgeführt incorrectly verzichtet sie aus dem 5,0-ml-Markierung auf dem 2,5-ml-Marke. Dieser Fehler wird in einer Bakterienkultur, die in einer höheren Konzentration als geplant sein wird, führen, was nachfolgenden Verdünnungen falsch zu sein. Diese Ausbreitung von Fehlern kann in einem fehlgeschlagenen Experiment, das müssen Sie mit den richtigen Zellkonzentrationen wiederholt werden würde.Ein Anwendungsbeispiel für die Verwendung von Mikropipetten auf Flüssigkeiten übertragen wird in Abbildung 9 dargestellt. Diese Pipetten werden für eine Vielzahl von Experimenten in der Molekularbiologie, Mikrobiologie, einschließlich der Herstellung von Proben für die PCR und Gelelektrophorese oder Impfen sterilem Medium oder Puffer mit kleinen Mengen (weniger als 1,0 ml) von Bakterienzellen oder Phagenpartikel verwendet. In dem Beispiel bereitgestellt, übertragen die Schüler 12,5 ul TE Puffer in ein 1,8 ml Mikrozentrifugenröhrchen (linke Rohr in Panel A; beachten Sie, dass Farbstoff in den Puffer wurde hinzugefügt, um die Visualisierung der Flüssigkeit im Inneren der klaren Mikrozentrifugenröhrchen zu erleichtern).Dieses Verfahren benötigt der Student zuerst die richtige Mikropipette wählen, in diesem Fall ein P20, und neben dem Volumeter auf die richtige Lautstärke (Panel B) eingestellt. Eine Spitze verwendet, enthält eine Wattebausch am Ende, um mögliche Verunreinigungen, die aus dem Lauf der Mikropipette vom Erreichen der Puffer Tröpfchen in der Spitze vertreiben konnte verhindern. Diese Vorsichtsmaßnahme ist nicht erforderlich, wenn darauf geachtet wird, wenn Ansaugen von Flüssigkeiten in die Spitzen, Drücken Sie den Kolben langsam, so dass die Flüssigkeit nicht in die Pipette Fass spritzen. Technische Fehler können auftreten, die zu einem Transfer von falschen Bände. Zum Beispiel können Sie wählen den falschen Mikropipette für den Job oder stellen Sie den Volumeter auf die richtige Mikropipette auf eine falsche Lautstärke. Vor dem Eintauchen der Spitze in den Puffer, können Sie den Kolben vorbei an der ersten Haltestelle hineingeschoben werden, sodass ein Überschuss an Puffer, um in die Spitze gezogen werden, wenn der Kolben losgelassen wird. Alternativ können Sie Tauchen Sie die Spitze weit genug in den Puffer, so dass Luft gezogen wirdin die Spitze anstelle von Puffer. Sie können vergessen, den Kolben bis zum zweiten Anschlag schieben bei der Abgabe in den Puffer Mikrozentrifugenröhrchen was weniger als das gewünschte Volumen an von der Spitze gelöst werden. Die rechte Tube in A von 9 zeigt ein Mikrozentrifugenröhrchen, das den falschen Volumen Puffer relativ zu dem Rohr auf der linken Seite. Anstelle der Abgabe von 12,5 ul Puffer, verzichtet der Student 125 ul. Wodurch die Abgabe einer im Wesentlichen größeren Volumen an Puffer, in diesem Fall, obwohl die Zahl identisch auf den Volumenmesser gesetzt sind, wurde der falsche Mikropipette für den Job (Panel B der Schüler verwendet eine P200 anstelle eines P20) ausgewählt ist. Wenn diese Lösung verwendet wurde, um eine Mischung von Reagenzien für eine Anwendung wie z. B. PCR herzustellen, dann wird dieser Fehler zu ändern Endkonzentration von allen Reagenzien zugegeben, um das gleiche Rohr. Folglich ist es unwahrscheinlich, dass der Versuch erfolgreich sein wird, da Molekularbiologie Verfahren wieals PCR erfordern, dass alle Komponenten bei bestimmten Konzentrationen für die Reaktion, um korrekt zu arbeiten.
Weil es nicht immer möglich ist, um sicherzustellen, Mikroliterpipetten (vor allem die Innenseite des Fasses) sind steril, können Stammlösungen kontaminiert verursacht sogar Fehlersuche Bemühungen zum Scheitern verurteilt, wenn die Durchführung von Experimenten. Bei der Verwendung von sterilen Lösungen Mikroliterpipetten zu übertragen, wird dringend empfohlen, dass aliquoter Teile der Stammlösungen (Medien, Puffer, Wasser) hergestellt unter aseptischen Bedingungen mit serologischen Pipetten werden. Es ist üblich, pflegen arbeiten Stammlösungen in 15 ml oder 50 ml konischen Röhrchen steril. Diese sind oft leichter zu manipulieren, während Sie ein Mikropipette und kann mit einem frischen Aliquot der Stammlösung ersetzt werden, wenn während des Volumens Transfers kontaminiert.
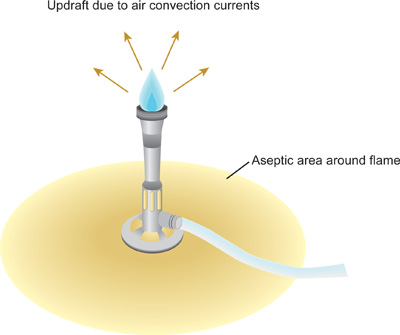
Abbildung 1. Sterile Bereich von Aufwind der Bunsenbrenner-Flamme erzeugt. Auf minimize Kontamination von sterilen Lösungen und Kulturen, ist es wichtig, dass alle Manipulationen in den sterilen Bereich durchgeführt werden. Die Felgen aus Glas Kultur Röhren und Kolben sollten durch die Spitze des blauen Kegels, dem heißesten Teil der Flamme übergeben werden. Kunststoffrohre und Tipps können nicht geflammt werden - diese sollten durch alternative Methoden vor, um die Pre-sterilisiert werden.

Abbildung 2. Serologische Pipetten für aseptische Transfer von Flüssigkeiten eingesetzt. (A) von links nach rechts abgebildet sind Zeichnungen von 25 ml, 10 ml und 5 ml Pipetten. (B) Serologische Pipetten kann aus Kunststoff oder Glas sein. Kunststoff-Einweg-Pipetten sind (einmalige Verwendung) und in der Regel einzeln in Papier und Kunststoff-Hülsen, in denen alle Innenflächen sind steril (linke Seite) gewickelt. Glas-Pipetten können mehrfach verwendet, sofern sie gereinigt und sterilisiert zwischen verwendet werden, diese sind typischerweise in Metalldosen aufbewahrt (rechtsauf dieser Seite).

. Abbildung 3 Serologische Pipetten sind in zwei Ausführungen: TC ("zu enthalten") oder TD ("to deliver"). Dargestellt ist die erklärende Beschriftung eines TD 5 ml Pipette.

Abbildung 4. Aseptische Arbeitsweise. Beim Absaugen von Flüssigkeiten aus einer Flasche, Flasche, Tube oder mit Kappen, stellen Sie niemals den Deckel auf der Bank. Stattdessen halten Sie die Kappe in der gleichen Hand wie Pipette Hilfe beim Lenken des Gefäß mit der Flüssigkeit mit der anderen Hand, wie gezeigt.
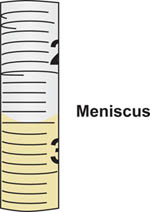
Abbildung 5. Meniskus gebildet beim Zeichnen Flüssigkeit in serologischen Pipette. Das Volumen entspricht dem Teilstrich auf der Pipette, wo der Boden des Meniskus ausrichtet. In diesem Beispiel richtet der Meniskus mit der 2,5 ml gradua tion-Marke.
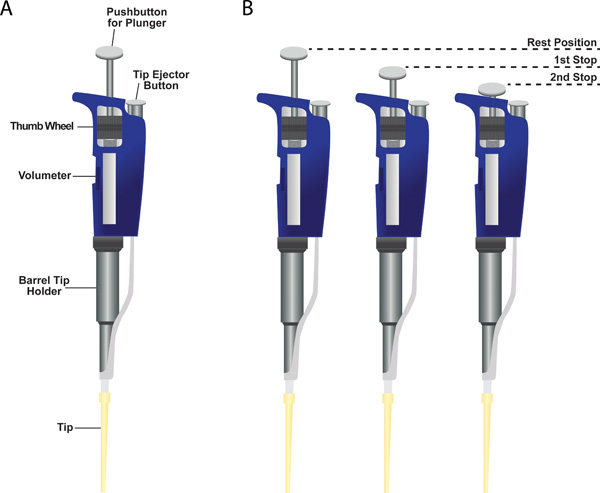
Abbildung 6. Einkanal-Mikropipette. (A) gezeigt ist ein Beispiel Mikropipette mit einer Spitze aus Kunststoff an der Unterseite des Zylinders Düsenstock. Angegeben sind die Standorte der Volumeter, das Stellrad für die Änderung der Einstellung Volumeter, der Lauf Düsenstock, der Spitzenabwurf-Taste und die Taste für den Kolben. (B) Zwei-Stopp-System auf einem Stößel Mikropipette.

Abbildung 7. Mit serologischen Pipetten, um Medien in sterile 125 ml Kolben zu übertragen. Der linke Kolben hat 25 ml Medium nur (LB), während der rechte Kolben ist eine Kultur von E. coli durch Inokulieren LB mit Zellen, und dann Inkubation über Nacht bei 37 ° C Beachten Sie, wie die Medien in den Kolben auf der rechten Seite ist trüb durch das Zellwachstum.
E 8 "src =" / files/ftp_upload/2754/2754fig8.jpg "/>
Abbildung 8. Mit serologischen Pipetten, um Medien in sterile Reagenzgläser übertragen. (A) Die linke Tube enthält 5 ml einer reinen E. coli-Kultur, während die rechte Tube enthält 5 ml einer verseuchten bakteriellen Zellkultur. Beachten Sie die Unterschiede im Wachstumsverhalten zwischen den beiden Kulturen. Obwohl beide trüb sind, hat die Kultur auf der rechten Seite mit einem Pilz oder andere Mikroorganismen in der Luft geben dem Kultur eine andere Farbe und Konsistenz aus, dass für E. erwartet kontaminiert worden coli-Zellen. (B) Die linke Kultur Röhrchen enthält 3,5 ml LB, während die rechte Röhre enthält nur 2,5 ml LB. Dieses Volumen Unterschied resultierte aus einem Fehler während der Durchführung einer Punkt-zu-Punkt-Bereitstellung von Medien an den Rohren gemacht.

Abbildung 9. Using Mikroliterpipetten zu Puffer in sterile Reaktionsgefäße übertragen. (A) Die linke Mikrozentrifugenröhrchen enthält nur 12,5 ul TE Puffer, während die rechte Tube enthält 125 ul. Beachten Sie, dass man einen Farbstoff auf den Puffer wurde hinzugefügt, um die Visualisierung der Flüssigkeit im Inneren der klaren Mikrozentrifugenröhrchen erleichtern. (B) Die linke Volumenmesser ist aus einer Mikropipette P20, während die rechte Volumenmesser ist aus einer Mikropipette P200. Ein häufiger Fehler ist die Auswahl der falschen Mikropipette. Obwohl die Zahlen sind identisch auf dem P20 und P200 Volumeter, die falsche Wahl der Mikropipette resultiert im Transfer falsche Volumina eingestellt.

Abbildung 10. Laminarströmungshaube verwendet, um eine Kontamination von Lösungen und Kulturen zu verhindern. Gezeigt ist ein Biosicherheitswerkbank für die Arbeit mit BSL-2 Organismen zugelassen.
Diskussion
Aseptische Technik bezieht sich auf eine Reihe von Routine-Verfahren erfolgen, um sterile Lösungen und Kulturen kontaminiert werden durch unerwünschte Mikroorganismen im Labor zu verhindern. Solche Techniken sind für Experimente, die wachsenden Zellen erfordern. Obwohl ein Werk-Einstellung, die völlig steril ist, kann nicht erreicht werden, dass Verfahren wie desinfizierende Oberflächen im Labor, die Schaffung eines sterilen Bereich mit einem Bunsenbrenner, die Begrenzung der Exposition der nicht begrenzten Kulturen und Medien an der Luft, Sterilisieren Materialien wie Flaschen, Tuben und Glaspipetten, und die Vermeidung von Kontakt von sterilen Instrumenten mit nicht-sterilen Oberflächen verringert die Möglichkeit einer Kontaminierung Lösungen und Kulturen in einem Experiment. Das Ziel ist, für diese vorsorgliche Verfahren zur zweiten Natur werden, dies wird mit Ausbildung und Praxis während der Arbeit in einem Labor.
Volume Transfers mit sterilen Lösungen und Kulturen mit Instrumenten wie serologischen Pipetten und Mikrofonropipettors sind eine von vielen Arten von Routinetechniken in einem Labor durchgeführt. Verschiedene experimentelle Anwendungen erfordern Instrumente übertragen kann eigenständig, aber präzise und genau, Bände. Serologische Pipetten werden in mikrobiologischen Laboratorien verwendet werden, um Zellkulturen erfordern Medien Vorbereitungen beteiligt Milliliter Volumen vorzubereiten, während Mikroliterpipetten unbedingt molekularbiologische Experimente, die nur Mikroliter-Mengen von Lösungen benötigen. Wenn aseptischen Bedingungen mit diesen Instrumenten ausgeübt wird, wird Verunreinigung während Volumen Übertragungen unabhängig von der Höhe der Flüssigkeit oder Art von Experiment minimiert.
Obwohl es in diesem Protokoll beschrieben, ist ein weiteres Mittel häufig verwendet, um eine Kontamination zu verhindern in einer Sterilbank (10) arbeiten. Diese Ausrüstung ist entscheidend für Gewebekulturen und für Experimente mit Mikroorganismen wie BLS-2 oder höher eingestuft durchgeführt. Ein Laminarströmungshaube enthält einen HEPA (high-efficiencyParticulate Air)-Filter, der Verunreinigungen aus der Luft entfernt von der strömenden Luft in die Haube und verhindert gleichzeitig ungefilterte Luft aus dem Raum durchdringt den Arbeitsbereich aus. Zu beachten ist, kann ein Bunsenbrenner nicht in einer Sterilbank verwendet werden, da die Wärme von der Flamme stört Luftstrom wesentlich für die Funktion der Haube.
Es ist oft hilfreich, um die Qualität Ihrer aseptischen Bedingungen zu überprüfen, wenn die Durchführung von Experimenten. Um Lösungen zu bestätigen und Kulturmedien nicht während experimentelle Manipulationen verunreinigt, stets einen negativen Kontrolle. Zum Beispiel, wenn Herstellung Röhren-Bouillon für das Wachstum von Bakterienkulturen, nicht zu inokulieren ein Rohr so dass nur sterile Medien. Inkubieren Sie das Medium neben den inokulierten Röhrchen dann inspizieren inokulierten Kontrolle Rohr auf Anzeichen von Kontamination wie Trübung von Wachstum unerwünschter Zellen unbeabsichtigt in das Rohr eingeführt. Wenn das Steuerrohr verunreinigt ist, die Versuchsröhres wahrscheinlich ist es, wie auch, kontaminiert und das Experiment muss wiederholt werden. Diese Vorsicht sollte bei jedem Experiment durchgeführt werden.
Offenlegungen
Ich habe nichts zu offenbaren.
Danksagungen
Besonderer Dank geht an Cori Sanders bei Iroc Designs zur Vorbereitung von Illustrationen und Kris Reddi an der UCLA für die Einrichtung Probe Kulturen für Zahlen. Finanzierung für dieses Projekt wurde von HHMI (HHMI Grant Nr. 52006944) zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| LB-Nährlösung | Difco | 244620 | Rezept auch in Referenz 6 |
| TE-Puffer: | |||
| EDTA Dinatriumsalz Dihydrat | Sigma | E5134 | |
| Trizma-HCl | Sigma | T-3253 | |
| CiDecon | Decon Laboratories, Inc. | 8504 | Desinfektionsmittel |
| Ethanol | Fisher Scientific | A406 | Für die Verwendung als Desinfektionsmittel, bereiten 70% (v / v) mit destilliertem Wasser |
Referenzen
- Barker, K. . At the Bench: A Laboratory Navigator. , (1998).
- . . Biosafety in Microbiological And Biomedical Laboratories (BMBL). , (2009).
- Bykowski, T., Stevenson, B. Aseptic Technique. Current Protocols in Microbiology. Appendix 4, Appendix 4D (2008).
- Coté, R. J. Aseptic Technique for Cell Culture. Current Protocols in Cell Biology. Chapter 1, Unit 1.3 (2001).
- Grimes, S. E. A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. RAP Publication. AC802/E, 12-13 (2002).
- Guzman, K. Pipetting: A Practical Guide. The American Biology Teacher. 63 (2), 128-131 (2001).
- Jordan, T., et al. . RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , (2008).
- Sambrook, J., Russell, D. W. . Molecular Cloning - A Laboratory Manual. , 978-087969576 (2001).
- Seidman, L. A., Moore, C. J. . Basic Laboratory Methods for Biotechnology: Textbook and Laboratory Reference. , (2000).
- . . PIPETMAN P User's Guide. , (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten