Method Article
Techniques de laboratoire aseptiques: Transferts en volume avec pipettes sérologiques et Micropipettes
Dans cet article
Résumé
Lorsque vous travaillez dans un laboratoire, il est impératif de minimiser les sources de contamination. Une technique aseptique se réfère aux procédures qui permettent le transfert des cultures et des réactifs, tout en évitant le contact avec les surfaces non stériles. Pipettes sérologiques et Micropipettes sont utilisés pour mesurer des volumes précis sans compromettre la stérilité des solutions utilisées dans les expériences.
Résumé
Micro-organismes sont partout - dans l'air, le sol, et le corps humain ainsi que sur des surfaces inanimées comme des bancs de laboratoire et les claviers d'ordinateur. L'omniprésence des microbes crée une offre abondante des contaminants potentiels dans un laboratoire. Pour assurer le succès expérimental, le nombre de contaminants sur les surfaces de l'équipement et les travaux doivent être minimisés. Commune parmi les nombreuses expériences en microbiologie sont des techniques associées à la mesure et le transfert des cultures contenant des cellules bactériennes ou des particules virales. Pour ce faire, sans contact avec les surfaces non stériles ou de contaminer les médias stériles exige (1) préparer un espace de travail stérile, (2) à un réglage précis et avec précision la lecture des instruments pour le transfert aseptique des liquides, et (3) correctement la manipulation des instruments, des flacons, des bouteilles et des cultures des tubes à l'intérieur d'un champ stérile. L'apprentissage de ces procédures exige une formation et la pratique. Dans un premier temps, les actions devraient être lent, délibéré et contrôlé par l'objectif étant pour t aseptiquesechnique pour devenir une seconde nature lorsque l'on travaille sur le banc. Nous présentons ici les étapes à suivre pour mesurer les volumes utilisant des pipettes sérologiques et Micropipettes dans un champ stérile créée par un bec Bunsen. Plage de volumes de microlitres (ul) en millilitres (ml) en fonction de l'instrument utilisé. Liquides couramment transférés comprennent bouillon stérile ou des solutions chimiques, ainsi que des cultures bactériennes et des stocks de phages. En suivant ces procédures, les élèves devraient être en mesure de:
- Le travail au sein du champ stérile créée par la flamme du brûleur Bunsen.
- N'utiliser que des pipettes sérologiques sans compromettre la stérilité instrument.
- Aspirer des liquides avec des pipettes sérologiques, précisément la lecture des volumes calibrés en alignant le ménisque formé par le liquide à des marques de graduation de la pipette.
- Conservez les bouteilles, flacons, culture tubes et leurs casquettes respectives stériles lors des transferts de liquides.
- Identifier les différentes applications pour le plastique contre verre sérologique pipettes.
- Limites de précision d'État pour micropipettes.
- Précisément, et régler avec précision des volumes sur micropipettes.
- Savoir comment utiliser correctement l'arrêt de première et deuxième sur une micropipette pour aspirer et transférer des volumes corrects.
Protocole
1. Préparer un espace de travail stérile
- Avant de commencer les procédures de stérilisation dans votre zone de travail, lavez-vous soigneusement les mains avec du savon antiseptique et de l'eau chaude.
- Assurez-vous de re-se laver les mains chaque fois que vous croyez que vous avez la contamination de vos manipulations expérimentales.
- Dégagez tous les matériaux qui encombrent votre espace de travail sur le banc de laboratoire. Suppression d'un pré-humidifié lingette désinfectante de la cartouche et essuyez toute la région. Laisser le désinfectant à s'évaporer - ne pas essuyer à sec!
- Utiliser des désinfectants tels que l'alcool (isopropanol ou l'éthanol à 70%) ou les composés phénoliques (o-phénylphénol).
- Pour éviter l'aérosolisation ou la production d'une fine brume contenant des cellules bactériennes, et la propagation des contaminants microbiens, d'éviter de distribution de désinfectant à partir d'un flacon souple.
- La dessiccation des micro-organismes est l'un des moyens les plus efficaces pour décontaminer les surfaces.
- Même si quelqu'un a récemment utilisé la paillasse du laboratoire et de la paillasse a été essuyé avec un désinfectant, toujours commencer votre temps en laboratoire par essuyer le banc.
- Après le désinfectant a complètement séché, utiliser un allumeur pour allumer le brûleur Bunsen. Régler la flamme de façon à ce que d'un cône bleu peut être vu dans le milieu de la flamme. La flamme est maintenant la production d'un courant d'air ascendant, ou les courants de convection d'air dans lequel l'air chaud et humide s'élève et loin de la flamme (figure 1). Comme la chaleur monte, les microorganismes et les particules de poussière sont forcés vers le haut et loin de la zone de travail immédiate. Travaillez lentement, attentivement, et délibérément, à tout moment au sein de cette zone créée par le brûleur Bunsen, considéré comme un champ stérile. Maintenir le brûleur Bunsen durant toute la procédure.
- La pointe du cône bleu est la partie la plus chaude de la flamme.
- Veillez à ne pas perturber le courant d'air ascendant par des mouvements rapides qui ont considérablement changer l'IAcourants r autour de la table de laboratoire. Création un courant ascendant avec le brûleur Bunsen minimise la possibilité de micro-organismes et de poussière tombant sur la paillasse ou dans des bouteilles ouvertes, tubes ou flacons de la zone de travail.
- Disposer tous les approvisionnements nécessaires à la procédure sur la paillasse du laboratoire à proximité du champ stérile. Assurez-vous que tous les matériaux sont correctement étiquetés.
- Les fournitures peuvent inclure pipettes sérologiques et Micropipettes, tubes, flacons de culture stériles stériles, des bouteilles contenant des médias bouillon, des microtubes stériles, des conseils micropipette, supports pour tubes, des cultures de cellules bactériennes, et les stocks de phages.
- Les milieux liquides doivent être stérilisés dans un autoclave à 121 ° C pendant au moins 15 minutes sur la mise en liquide. Les volumes plus importants de médias (> 1L) nécessitent des temps de plus en autoclave. Labware doivent être stérilisés dans un autoclave à 121 ° C pendant au moins 30 minutes sur la gravité (à sec) de réglage.
- En général, les solutions stériles peuvent être conservés à 4° C pendant jusqu'à 5 mois. Notez que la durée de stockage est réduit de façon significative des solutions contenant des composants instables tels que les antibiotiques - toujours vérifier recommandations du fabricant.
2. Le transfert de liquides en utilisant des pipettes sérologiques
- Pipettes sérologiques existent en plusieurs tailles et options: en plastique ou en verre, jetables ou réutilisables, branché ou débranché. Ceux-ci sont calibrés pour fournir des volumes allant de 0,1 ml à 25 ml.
- Les tailles courantes pour pipettes sérologiques sont de 5 ml, 10 ml et 25 ml et doivent être utilisés pour les transferts aseptiques liquides de 0,1 ml ou plus (tableau A de la figure 2). Il ya aussi des grandes pipettes sérologiques qui peuvent fournir des volumes jusqu'à 100 ml, mais l'objet de ce protocole est mis sur les plus courantes, les petites pipettes de taille.
- Pré-stérilisés pipettes avec un tampon de laine de coton sont nécessaires pour la microbiologie et des expériences de culture de tissus. La fiche ne doit pas être retiré de la àp de la pipette et qui est destinée à fonctionner comme une barrière à la pipette débordement.
- Différentes applications appellent pour les pipettes en plastique par rapport verre sérologiques. Le verre est nécessaire pour les solvants organiques. Soit peut être utilisé lors de l'exécution BSL-1 des expériences sur la paillasse de laboratoire. Seulement en plastique peuvent être utilisés lorsque l'on travaille dans un cabinet de biosécurité avec BSL-2 organismes où un bec Bunsen ne peuvent pas être utilisés. Il est également recommandé que le plastique être utilisé pour des applications impliquant le transfert de gélose fondue.
- Pipettes sérologiques sont de deux types: TC ("à contenir") ou TD ("à fournir"). Pipettes TC livrer tout le volume, y compris la pointe, et doit être "soufflé" ou rincés pour obtenir le volume spécifié. Pipettes TD sont calibrés pour laisser un tout petit peu dans la pointe qui ne devrait pas être livré. Soyez sûr de vérifier l'étiquette sur le corps de la pipette vers le haut pour vérifier quel type il est (figure 3). Les plus couramment utilisés sont des pipettes TD, qui sont marked d'anneaux doubles en haut.
- Prenez un plastique stérile pipette sérologique (également appelé une pipette de transfert volumétrique) et retirez soigneusement la pochette en papier à la fin avec le tampon de laine de coton en le détachant comme la peau d'une banane - ne pas enlever le manchon ensemble, la protection de la pointe de la pipette, qui viennent en contact avec le liquide à transférer. Ne toucher que le haut de la pipette (au-dessus des marques de graduation) avec vos mains.
- Ne jamais entrer dans une solution stérile avec une pipette utilisée, même si le plus grand soin a été pris pour le garder stérile.
- Pipettes en verre sérologiques sont généralement stockés dans des boîtes métalliques (Groupe B de la figure 2). Desserrer la partie supérieure de la cartouche, puis retirer le bouchon, et la flamme des extrémités ouvertes de la calotte et la cartouche. Placez le bouchon vers le bas, de son côté, sur le banc désinfectés. Sortir une pipette de la cartouche en la tenant horizontalement et doucement en secouant de sorte que les sommets d'un ou deux pipettetes tenir le coup environ un pouce et peut être facilement compris. Couchez le boîtier sur le côté et retirer une pipette, mais soyez prudent de ne pas toucher les autres pipettes dans le conteneur. Ne touchez pas la pointe inférieure de la pipette avec vos mains, et éviter tout contact de la pointe avec d'autres surfaces non stériles.
- Apposer une aide de pipette telle qu'une ampoule, la pompe, ou un pistolet à l'extrémité supérieure de la pipette sérologique. Retirez le manchon de papier de la pipette en plastique. Maintenez l'aide de la pipette dans votre main droite.
- Si vous utilisez une pipette en verre, passer le tiers inférieur de la pipette à travers le cône bleu dans la flamme du brûleur Bunsen pour 1-3 secondes. Faire tourner la pipette 180 ° lors de son passage à travers la flamme. Pipettes et tubes en plastique ne peut pas être brûlé.
- Si la main gauche, maintenez l'aide de la pipette dans votre main gauche et effectuer les manipulations ultérieures des flacons de culture et de tubes avec votre main droite.
- La contamination tend à se produire avec des pipettes en plastique lors du retrait de la finale inches de la pipette à partir du manchon à cause de la pointe stérile entre en contact avec la partie du manchon touché par les mains.
- Retirez le bouchon de la bouteille contenant milieux stériles. Ne placez pas le capuchon sur la paillasse du laboratoire, mais le tenir entre votre annulaire et la paume de la main droite tout en manipulant l'aide de la pipette avec le pouce, index et le médius de la main même (figure 4). Tenir le flacon à un angle de 45 °, passer le rebord de la bouteille par la flamme du bec Bunsen, la création d'un champ stérile autour de la bouteille ouverte.
- Bien qu'il vaut mieux éviter, si vous devez mettre le bouchon vers le bas, placez-le face vers le bas sur une surface désinfectée. Avec un capuchon qui fait face, il ya un plus grand risque de contamination par des mouvements d'objets ou les mains, créant des courants d'air qui provoquent micro-organismes et les particules de poussière de descendre à la surface intérieure du capuchon.
- Le but de flammes n'est pas de stériliser, mais pour réchauffer l'ouverture of la bouteille pour créer des courants de convection d'air jusqu'à et à l'écart de l'ouverture (c.-à-courant ascendant). L'air chaud permet d'éviter la hausse des particules de poussière et d'autres contaminants de pénétrer dans la bouteille.
- Garder le récipient stérile ouverte aussi peu de temps que possible. Il est important de garder les points d'entrée des micro-organismes aéroportés à un minimum tout au long de la procédure.
- Éviter la toux, les éternuements, de parler, et d'autres mouvements par inadvertance alors que les conteneurs stériles sont ouverts.
- Ne dépassez jamais les mains et les doigts sur le dessus d'un champ stérile (c.-à-bouteilles ouvertes ou flacons, l'intérieur des tubes et des capsules de bouteilles) une fois qu'ils ont été adoptés par la flamme du bec Bunsen.
- Toujours travailler avec une flamme nue lors de l'ouverture des tubes ou des bouteilles stériles. Jamais plus d'un tube, flacon, flacon ouvert ou sur le banc à la fois. Flaming devrait être fait immédiatement à l'ouverture et de clôture juste avant tubes, bouteilles et flacons.
- Placez la pointe de l'Serolpipette ogi dans la bouteille contenant les milieux stériles puis aspirer, ou tirer l'échantillon de façon aseptique, de la bouteille. Utiliser l'aide de pipette pour contrôler l'écoulement de l'échantillon dans la pipette. Lire le volume précisément dans la pipette en alignant le ménisque formé sur le dessus de la colonne de liquide à des repères de graduation sur la pipette calibrée (figure 5).
- NE PAS BOUCHE PIPET! Utilisez toujours une aide pipette (pompe, ampoule, ou un pistolet).
- Faites attention à la séquence de nombres pour déterminer le volume aspiré. Les numéros peuvent être imprimés basculer versa de haut niveau, ou vice versa, ou Souvent, dans les deux directions.
- Lors de la lecture du volume, maintenez toujours le verticalement la pipette, perpendiculaire au sol, et de visualiser le ménisque liquide morts à au niveau des yeux.
- Pipettes sérologiques sont aussi précis que le plus petit incrément marquée, ce qui est typiquement de 0,1 ml pour 5 ml et 10 ml et pipettes de 0,2 ml pour 25 ml pipettes. Jef est plus grande précision nécessaire, d'une pipette sérologique peut être utilisé en combinaison avec une micropipette.
- Passez le rebord de la bouteille à travers la flamme du brûleur Bunsen une fois de plus, puis placez le bouchon sur la bouteille. Réglez la bouteille médias de côté.
- Ne vous brûlez pas avec le bec Bunsen à la hâte pour fermer la bouteille.
- Tenez un tube à essai ou un ballon dans votre main gauche. Retirer et tenir le cap, comme décrit à l'étape n ° 4 ci-dessus. Créer un champ stérile à la flamme de la jante du tube ou le flacon dans le bec Bunsen.
- Distribuer des médias dans la pipette dans le tube ou le flacon. Contrôler le flux de l'échantillon afin de ne pas éclabousser sur le tube ou le flacon.
- Volumes peuvent être mesurée de telle sorte que la totalité du volume est fournie et la pipette décharge complètement, ou un volume spécifique est atteinte au moyen d'une livraison de point à point (un volume de marquage à l'autre).
- Passez le bord du tube ou le flacon à travers la brûlure Bunsener la flamme une fois de plus, puis remettez le bouchon. Réglez le tube ou le flacon de côté. Retirer à l'aide de pipette, et jeter la pipette dans le récipient à déchets approprié.
- Plastique pipettes sérologiques sont jetables, tout en verre pipettes sérologiques peuvent être stérilisés et réutilisés. L'élimination appropriée exige pipettes en plastique placé dans un contenant pour objets pointus désigné (boîte rigide garni du sachet en plastique disposition), tandis que des pipettes en verre initialement devrait être immergée dans un récipient avec une solution javellisée à 10% pour désinfecter les surfaces à l'intérieur et à l'extérieur. Ensuite, les pipettes en verre doivent être soigneusement lavés avec du détergent de laboratoire, rincés à l'eau distillée, et stérilisé à l'autoclave.
- Ces mêmes étapes doivent être suivies lors inoculant des médias avec une culture bactérienne ou stock de phages ou lorsque vous effectuez des dilutions en série.
3. Liquides transférant à l'aide Micropipettes
- Précisément mesure et de distribution des volumes de minutes peut être accompliversé à l'aide de micropipettes (aussi appelé Pipetman; Groupe A de la figure 6). Ces instruments sont de tailles différentes, chacune avec une gamme de volume spécifique: 0,2 à 2 pl P2 pour, P10 pour pl 1-10, 2-20 pour les P20, P200 pour ul ul 20-200, et P1000 pour 200-1000 ul.
- Traiter micropipettes avec soin, car ils sont des instruments de précision. Ne pas les laisser traîner sur le banc de laboratoire sans surveillance où ils peuvent les faire tomber et endommagé. Ne pas laisser les pipettes à entrer en contact avec des produits chimiques corrosifs.
- Pour des volumes supérieurs à 1000 pi, utiliser une pipette sérologique.
- Bien que travaillant dans le champ stérile créée par le bec Bunsen, ne micropipettes flammes, des tubes et des conseils en matière plastique. Les tubes et des conseils devraient être pré-stérilisés. Les micropipettes peut être essuyé avec un pré-humidifié lingette désinfectante avant de l'utiliser.
- Un débitmètre numérique montrant le volume distribué peut être réglée en tournant le bouton de réglage. Adjust le volume avant de passer à l'étape n ° 3.
- NE JAMAIS METTRE LE BOUTON ajustement ci-dessus la gamme destinée!
- Pour obtenir une précision maximale lors de la diminution du réglage du volume sur la micropipette, lentement composer en bas de la molette, en veillant à ne pas dépasser la graduation.
- Pour obtenir une précision maximale lors de l'augmentation du réglage du volume sur la micropipette, composer la molette jusqu'à, en passant la graduation souhaitée par 1/3 de tour. Puis, lentement, cadran vers le bas de la molette pour atteindre le volume prévu, en veillant à ne pas dépasser la graduation.
Le volumètre montre trois numéros. Selon le micropipette, les chiffres sont interprétés différemment. Notez que chaque micropipette est aussi précis que la marque plus petite graduation.
P2: Pour les volumes entre 0.2 à 2.0 pi. Le nombre supérieur représente le volume en microlitres. Le deuxième numéro INDICATdixièmes es d'un microlitre (0,1 pi), et le troisième nombre représente centièmes de microlitres (0,01 pi). Chaque marque de graduation équivaut à une augmentation de deux millièmes (0,002 pi) d'un microlitre.
P10: Pour les volumes de 1.0 à 10.0 pi entre. Le nombre supérieur représente des dizaines de microlitres, ce qui est généralement fixé à «0» et ne doit être fixé à "1" avec les deux autres numéros indiqués à "0" lors de la distribution 10,0 pi. Le nombre du milieu indique le volume en microlitres. Le troisième chiffre indique dixièmes de un microlitre (0,1 pi). Chaque marque de graduation équivaut à une augmentation de deux centièmes (0,02 pi) d'une microlitre.
P20: Pour les volumes entre 2,0 à 20,0 pi. Le nombre supérieur au noir est pour des dizaines de microlitres, ce qui ne devrait être fixé à "2" avec les deux autres numéros indiqués à "0" lors de la distribution 20,0 pi. Le second numéro en noir désigne le volume en microlitres. Le troisième numéro en rouge indique dixths d'un microlitre (0,1 pi). Chaque marque de graduation équivaut à une augmentation de deux centièmes (0,02 pi) d'un microlitre.
P200: Pour les volumes entre 20,0 à 200 pl. Le nombre supérieur représente pour des centaines de microlitres, ce qui ne devrait être fixé à "2" avec les deux autres numéros indiqués à "0" lors de la distribution 200 pi. Le nombre du milieu indique le volume distribué des dizaines de microlitres, et le troisième nombre représente le volume en microlitres. Chaque marque de graduation équivaut à une augmentation de deux dixièmes (0,2 pi) d'une microlitre.
P1000: Pour les volumes entre 200-1000 ul. Le nombre supérieur représente pour des milliers de microlitres, ce qui est généralement fixé à «0» et ne doit être fixé à "1" avec les deux autres numéros indiqués à "0" lors de la distribution 1000 ul. Le nombre du milieu est pour des centaines de microlitres. Le nombre du bas est pour des dizaines de microlitres. Chaque marque de graduation équivaut à une augmentation de deux (2 pi) microlitres.
- Performance vérifier: Ces instruments doivent être étalonnés chaque année, d'assurer l'exactitude et la précision sont maintenus à rester à ± 5% du cahier des charges. Utilisez une échelle d'analyse pour mesurer l'eau, en s'assurant que les valeurs minimum et maximum correspondent au volume prévu. Par exemple, utiliser un P1000 à des transferts 200 pi de l'eau dans un plat de peser sur la balance. Comme l'eau a une densité de 1, puis 1 ml d'eau est équivalent à 1 gramme (g). Ainsi, 200 pi (0,2 ml) d'eau doit être égale à 0,2 grammes. Aussi, assurez-vous que la pointe ne fuit pas et ne peut maintenir le volume désiré jusqu'à ce que distribuée en utilisant le système de piston.
- Micropipettes doit être utilisé avec embouts jetables en plastique, à tout moment. Monter une pointe bien sur le bout du canon de la micropipette. Appuyez sur le bas et tourner légèrement pour assurer une fermeture hermétique.
- Les pourboires ne sont généralement emballés dans des boîtes en plastique qui peuvent être stérilisées à l'autoclave. Ouvrez la boîte de pointe pour récupérer une pointe, Puis fermez la boîte de pointe pour minimiser le contact avec des contaminants dans l'air.
- Quelques conseils ont des filtres similaires aux bouchons de coton sur pipettes sérologiques. Ces conseils sont souvent plus chers que des conseils réguliers et sont donc utilisés pour des applications spécialisées. Par exemple, lors de la mesure des produits chimiques volatils tels que le chloroforme ou de liquides radioactifs comme le 32 P-ADN marqué, en utilisant pointes à filtre permet d'éviter le canon de la micropipette de la contamination.
- Maintenez la micropipette dans une position verticale.
- Garder la micropipette verticale sera empêcher les liquides de l'intérieur en cours d'exécution et de contaminer le corps de la micropipette.
- La micropipette a trois positions: position de repos (1), (2) Le premier arrêt, et (3) Deuxième arrêt (Figure 6, panneau B). L'instrument dispose d'un système de piston à deux arrêts. Le premier arrêt a deux fonctions. La première consiste à dessiner dans le volume désiré de liquide dans la pointe de l'EPMn libérant le piston de la première butée à la position de repos. La deuxième fonction est de distribuer la majorité du liquide de la pointe lors d'enfoncer le piston de la position de repos à la première étape. En outre en appuyant sur le piston pour les dispense stop seconde quelle que soit liquide reste dans la pointe.
Appuyez sur le bouton-poussoir sur le piston de la position de repos à la première étape. L'air égal au volume de l'réglage est déplacée. - Immerger l'embout dans le liquide tout en maintenant enfoncée la touche pour la première étape.
- Ne touchez pas la micropipette lui-même aux côtés de bouteilles, tubes et flacons, sinon les surfaces intérieures des ces navires sera contaminé. Seules les conseils sont stériles.
- Relâcher le bouton poussoir lentement pour aspirer le liquide dans la pointe. Arrêtez une fois que le bouton-poussoir est de retour à la position de repos. Attendez un instant afin de liquide peut être aspiré dans la pointe.
- Le volume de liquide dans la pointe sera égal au volume de of le réglage de la micropipette.
- Les liquides visqueux tels que ceux contenant du glycérol nécessitent plus de temps pour entrer dans la pointe.
- Retirez la pointe du liquide, et une inspection visuelle de la pointe de confirmer que le liquide élaboré a atteint le niveau attendu dans la pointe et il n'ya pas de bulles d'air dans la pointe.
- Si nécessaire, d'expulser le liquide et serrer à la main les embouts sur la micropipette. Aspirer le liquide et vérifier de nouveau.
- Placer la pointe à un angle (10 ° à 45 °) contre la paroi du tube de réception du liquide. Pour expulser le liquide, appuyez lentement le bouton-poussoir sur le piston pour le premier arrêt. Attendez un moment puis appuyez sur le bouton poussoir pour la deuxième étape d'expulser le liquide résiduel dans la pointe.
- Enfoncer le piston trop rapidement peut amener le liquide étant expulsé à des projections ou se produisent des bulles indésirables dans le tube.
- Avant de libérer le piston en position de repos, de nouveaudéplacer la pointe du liquide.
- Jeter des conseils dans un récipient désigné objets tranchants en appuyant sur le bouton d'éjection sur le micropipette.
4. Nettoyage de l'espace de travail
- Lorsque vous avez terminé avec une expérience exigeant l'utilisation de techniques d'asepsie, éteindre le brûleur Bunsen, puis mis de côté toutes les fournitures et les réactifs. Essuyez les surfaces extérieures de matériel de laboratoire (bouteilles, boîtes Micropipettes, pipette à pointe) avec un pré-humidifié lingette désinfectante pour assurer les contaminants ne sont pas transférés à l'emplacement de stockage.
- Lieu contaminé la verrerie et de déchets dangereux dans le récipient d'élimination adéquat. Déchets de laboratoire comprend du matériel de laboratoire tels que des gants, pipettes, embouts et tubes. Les déchets non infectieux dangereux est généré lors de l'exécution des expériences avec des organismes non pathogènes (BSL-1) tandis que infectieuse déchets dangereux sont produits lors de l'utilisation d'organismes pathogènes (BSL-2 ou au-dessus). Les déchets infectieux doivent être désinfectés en autoclave ou before il est jeté. Suivez les directives de sécurité en laboratoire décrits dans BMBL (5 e éd.) Ainsi que ceux fournis par la santé environnementale et institutionnelle OSHA et les ministères de sécurité.
- Essuyer la zone de travail sur la table de laboratoire avec un pré-humidifiée lingette désinfectante à partir de la cartouche, une fois le désinfectant permettant d'évaporer.
- Se laver les mains soigneusement avec du savon antiseptique et de l'eau chaude avant de quitter le laboratoire.
5. Les résultats représentatifs
Un exemple d'application pour l'utilisation de pipettes sérologiques pour transférer les liquides est illustré à la figure 7. Ces pipettes sont souvent utilisés dans le laboratoire de microbiologie pour préparer les médias pour l'inoculation avec des cultures bactériennes. Par exemple, des flacons stériles premières sont rempli avec un volume spécifié de bouillon de culture, en l'espèce Luria Broth (LB), puis un petit nombre des cellules (par exemple E. coli) sont ajoutés à la presse. L'utilisation d'un p sérologiqueipette, d'une part le bouillon doit être transférés de manière aseptique de la bouteille multimédia dans le ballon. Dans ce cas, 25 ml de LB a été ajouté à un ballon de 125 ml stérile à l'aide d'une pipette de 25 ml sérologique. Ensuite, le bouillon doit être inoculé avec E. des cellules de E.. Ici, 10 ul de cellules ont été transférées de façon aseptique à l'aide d'une micropipette P20 à partir d'une fiole de culture précédemment croissante pour les 25 ml de LB frais. Le flacon est incubé dans une chambre de croissance pour un montant donné de temps, permettant aux cellules de se répliquer (pour cet exemple, les cellules de E. coli ont été incubées pendant une nuit à 37 ° C sur une plate-forme de la secousse). Le résultat est une culture de cellules trouble bactérienne qui peut être utilisé pour des expériences ultérieures.
Pipettes sérologiques peuvent aussi être utilisés pour transférer des médias fournis à l'origine dans une bouteille pour des tubes à essai, ou entre les tubes à essai, comme on le fait pour préparer les dilutions d'une culture bactérienne. Si une technique aseptique n'est pas maintenu tout au long de ces types de manipulations des médias , Puis les cultures deviennent contaminés, et des expériences ultérieures utilisant ces cultures sera retardée parce que les cultures fraîches, non contaminés devront être préparés. Des erreurs se produisent parce qu'un champ stérile n'est pas maintenu tout au long de la procédure. Par exemple, vous risquez d'oublier de désinfecter la paillasse du laboratoire ou à la flamme de la jante d'un flacon de culture ou d'un tube. Vous pouvez toucher la pointe de la pipette ou de définir le bouchon d'une bouteille ou tube à essai sur le banc au lieu de la tenir dans votre main. La procédure appropriée est essentielle pour maintenir la contamination des milieux et des cultures à un minimum. Figure 8A fournit l'exemple d'une culture pure par rapport contaminé de E. coli dans un tube contenant 5 ml de LB. Le panneau de gauche montre une culture uniforme affichant la turbidité bien typique d'un pur E. coli culture. En revanche, le panneau de droite montre une culture contaminée dans laquelle les caractéristiques de croissance sont différentes de celles attendues pour cette souche bactérienne.
"> Des erreurs techniques peuvent se produire lors de la manipulation pipettes sérologiques résultant dans le transfert de volumes incorrects des médias entre les tubes à essai. Par exemple, vous pouvez lire le volume de la pipette de manière incorrecte (c.-à-top par rapport bas du ménisque) ou vous pouvez expulser les médias complètement d'une pipette TD, qui a été conçu pour laisser un tout petit peu dans la pointe de ne pas être livrés. Lorsque vous effectuez une livraison point à point des médias, vous pouvez utiliser les marques d'étalonnage erronées et distribuer le volume incorrecte. La figure 8B montre un exemple de tubes à essai avec des volumes corrects par rapport incorrect des médias. Le tube sur la gauche contient 3,5 ml de LB mesurés avec une pipette sérologique de 5 ml. L'étudiant a effectué une livraison point à point des milieux dans lesquels LB a été élaboré à la marque de graduation 5,0 ml et distribué à la marque de 1,5 ml. Le tube sur la droite contient 2,5 ml de LB mesurés avec une pipette de la même taille parce que l'étudiant qui a effectué la livraison point à point des médias incorrectly il dispensé de la marque 5,0 ml à 2,5 ml de la marque. Cette erreur se traduira par une culture bactérienne, qui sera à une concentration plus élevée que prévu, entraînant des dilutions ultérieures d'être incorrecte. Cette propagation des erreurs peuvent se traduire par une expérience ratée qui aurait besoin d'être répété avec les concentrations cellulaires correctes.Un exemple d'application pour l'utilisation de micropipettes pour transférer les liquides est illustré à la figure 9. Ces pipettes sont utilisées pour une variété d'expériences en biologie moléculaire et microbiologie, y compris la préparation des échantillons pour la PCR et électrophorèse sur gel ou l'inoculation milieux stériles ou tampons avec de petits volumes (moins de 1,0 ml) de cellules bactériennes ou des particules de phages. Dans l'exemple fourni, l'étudiant transféré 12,5 pi de tampon TE dans un microtube de 1,8 ml (tube de gauche dans le panneau A, note que le colorant a été ajouté à la mémoire tampon pour faciliter la visualisation du liquide à l'intérieur des microtubes claires).Ce procédé nécessaire à l'étudiant d'abord sélectionner le micropipette correcte, dans ce cas un P20, et à côté de régler le débitmètre au volume correct (panneau B). Un embout a été utilisé qui contient un tampon d'ouate à l'extrémité pour empêcher une contamination possible pouvant être expulsé de l'barillet de la micropipette d'atteindre l'échantillon de tampon dans la pointe. Cette précaution n'est pas nécessaire si l'on prend soin lors de l'aspiration des liquides dans les conseils, appuyant doucement sur le piston de sorte que le liquide ne pas éclabousser dans le canon pipette. Des erreurs techniques peuvent se produire qui se traduisent par le transfert de volumes incorrects. Par exemple, vous pouvez sélectionner la micropipette mauvais pour l'emploi ou mettre le débitmètre sur la micropipette correcte pour un volume incorrecte. Avant de plonger la pointe dans la mémoire tampon, vous pouvez appuyer sur le piston au-delà de la première étape, ce qui provoque un excès de tampon pour être aspiré dans la pointe avant de relâcher le piston. Alternativement, vous ne pouvez pas plonger la pointe assez loin dans la mémoire tampon, afin que l'air est aspirédans la pointe, au lieu de tampon. Vous pouvez oublier de pousser le piston jusqu'à la deuxième butée lors de la distribution de tampon dans le microtube causant moins que le volume désiré d'être libéré de la pointe. Le tube droit dans la partie A de la figure 9 représente un microtube contenant le volume de tampon incorrecte par rapport au tube à gauche. Au lieu de distribuer 12,5 ul de tampon, l'étudiant distribué 125 pi. Dans ce cas, même si les chiffres sont mis à l'identique sur le débitmètre, la micropipette erronée a été sélectionné pour le travail (l'élève a utilisé un P200 au lieu d'un P20, panneau B) résultant de la livraison d'un volume sensiblement plus important de tampon. Si cette solution a été utilisée pour préparer un mélange de réactifs pour une application telle que la PCR, puis cette erreur va changer la concentration finale de tous les réactifs ajoutées par la suite dans le même tube. Par conséquent, il est peu probable que l'expérience sera couronnée de succès, car les procédures de biologie moléculaire tellesque la PCR exiger que tous les composants d'être à des concentrations spécifiques pour la réaction de travailler correctement.
Parce qu'il n'est pas toujours possible d'assurer micropipettes (en particulier à l'intérieur du canon) sont stériles, des solutions d'achat d'actions peuvent être contaminés provoquant même des efforts de dépannage à l'échec lors de l'exécution des expériences. Si vous utilisez micropipettes pour transférer des solutions stériles, il est fortement recommandé que les parties aliquotes de solutions d'achat d'actions (les médias, un tampon, de l'eau) être faites en utilisant une technique aseptique avec des pipettes sérologiques. Il est commun de maintenir des solutions de travail actions dans 15 ml ou 50 ml tubes coniques stériles. Ce sont souvent plus faciles à manipuler tout en fonctionnant d'une micropipette et peut être remplacée par une autre partie aliquote de la solution mère si elle est contaminée lors des transferts de volume.
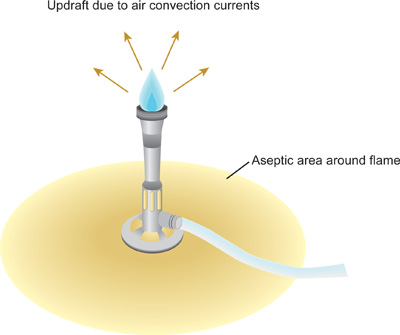
Figure 1. Champ stérile créée par courant ascendant de la flamme du bec Bunsen. Pour minmum la contamination des solutions stériles et des cultures, il est essentiel que toutes les manipulations être menées dans le champ stérile. Les jantes de tubes de culture en verre et flacons doivent être transmis à travers la pointe du cône bleu, partie la plus chaude de la flamme. Les tubes en plastique et des conseils ne peuvent pas être flambé - ceux-ci devraient être pré-stérilisés par des méthodes alternatives avant de les utiliser.

Figure 2. Pipettes sérologiques utilisés pour le transfert aseptique des liquides. (A) De gauche à droite sont des dessins de 25 ml, 10 ml, et 5 ml pipettes. (B) pipettes sérologiques peuvent être en plastique ou en verre. Pipettes en plastique sont à usage unique (une seule utilisation) et sont généralement emballés individuellement dans des pochettes en papier et en plastique dans lequel toutes les surfaces intérieures sont stériles (côté gauche). Pipettes en verre peut être utilisé plusieurs fois à condition qu'ils soient nettoyés et stérilisés entre chaque utilisation; elles sont généralement sont stockés dans des boîtes métalliques (à droitecôté).

. Pipettes sérologiques Figure 3 sont de deux types: TC ("à contenir") ou TD ("à fournir"). Montré est le label explicatif d'une pipette TD 5 ml.

Figure 4. Technique aseptique. Lors de l'aspiration des liquides à partir d'une bouteille, un flacon ou un tube avec des bouchons, ne jamais placer le capuchon sur le banc. Au lieu de cela, maintenez le cap dans la même main que l'aide pipette tout en manipulant le récipient contenant le liquide avec la main opposée, comme indiqué.
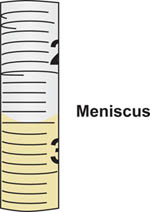
Figure 5. Ménisque formé lors de l'élaboration du liquide dans une pipette sérologique. Le volume correspond à la graduation de la pipette où le bas du ménisque aligne. Dans cet exemple, le ménisque soit aligné avec le diplomation 2,5 ml point d'interrogation.
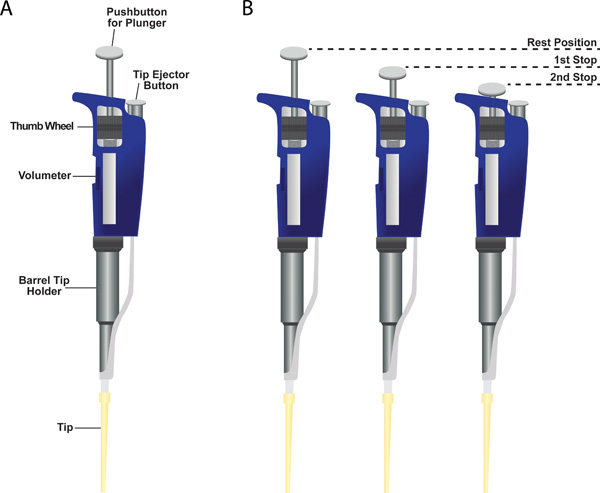
Figure 6. Micropipette monocanal. (A) indiquée est une micropipette échantillon avec un embout en plastique fixée sur le fond du porte-pointe barillet. Indiqués sont des destinations de l'volumètre, la molette pour modifier le réglage volumètre, le porte-pointe barillet, le bouton d'éjection, et le bouton-poussoir pour le piston. (B) Deux-système d'arrêt de piston sur une micropipette.

Figure 7. Aide de pipettes sérologiques pour transférer des médias dans 125 flacons stériles ml. Le ballon de gauche a 25 ml de milieu LB (seulement), tandis que le ballon droit est une culture de E. coli résultant de l'inoculation LB avec des cellules, puis une nuit d'incubation à 37 ° C. Notez comment les médias dans le ballon sur la droite est trouble en raison de la croissance cellulaire.
e 8 "src =" / files/ftp_upload/2754/2754fig8.jpg "/>
Figure 8. Aide de pipettes sérologiques pour transférer des médias dans des tubes à essai stériles. (A) Le tube de gauche contient 5 ml d'une pure E. la culture coli, tandis que le tube de droite contient 5 ml d'une culture de cellules bactériennes contaminée. Notez les différences dans les caractéristiques de croissance entre les deux cultures. Bien que les deux sont troubles, la culture sur le droit a été contaminée par un champignon ou d'autres micro-organismes aéroportés donnant la culture d'une couleur différente et la cohérence de celui attendu pour E. des cellules de E.. (B) Le tube de culture gauche contient 3,5 ml de LB tandis que le tube de droite contient seulement 2,5 ml de LB. Cette différence de volume résulte d'une erreur commise alors qu'il effectuait une livraison point à point des médias pour les tubes.

Figure 9. Usinmicropipettes g de transférer tampon dans des microtubes stériles. (A) Le microtube de gauche contient seulement 12,5 ul de tampon TE, tandis que le tube de droite contient 125 pi. Noter qu'un colorant a été ajouté à la mémoire tampon pour faciliter la visualisation du liquide à l'intérieur des microtubes claires. (B) Le volumètre gauche est d'une micropipette P20, tandis que le débitmètre droite est tirée d'une micropipette P200. Une erreur commune est de choisir le mauvais micropipette. Bien que les chiffres sont mis à l'identique sur le débitmètre P20 et P200, la sélection des résultats erronés dans micropipette transfert de volumes incorrects.

Figure 10. Hotte à flux laminaire pour prévenir la contamination de solutions et de cultures. Montré est un cabinet de prévention des risques biotechnologiques approuvés pour le travail avec BSL-2 organismes.
Discussion
Une technique aseptique se réfère à une série de procédures de routine effectuées afin de prévenir des solutions stériles et des cultures de devenir contaminés par des micro-organismes indésirables dans les laboratoires. Ces techniques sont indispensables pour des expériences qui nécessitent des cellules en croissance. Bien qu'un cadre de travail qui est complètement stérile ne peut être atteint, des procédures telles que la désinfection des surfaces de laboratoire, la création d'un champ stérile à l'aide d'un bec Bunsen, en limitant l'exposition des cultures non plafonnés et les médias à l'air, de stérilisation de matériaux tels que des bouteilles, tubes et pipettes en verre, et en évitant tout contact avec des instruments stériles non-stériles surfaces réduit la possibilité de contamination des solutions et des cultures dans une expérience. L'objectif est pour ces mesures de précaution pour devenir une seconde nature, ce qui est livré avec la formation et la pratique tout en travaillant dans un laboratoire.
Transferts de volume avec des solutions stériles et des cultures en utilisant des instruments tels que pipettes sérologiques et des microropipettors sont l'un des nombreux types de techniques de routine effectués dans un laboratoire. Différentes applications expérimentales appel à des instruments capables de transférer des volumes distincts, mais précis et exacts. Pipettes sérologiques sont utilisés dans les laboratoires de microbiologie pour préparer les cultures cellulaires nécessitant des préparations des médias portant sur des volumes millilitre, alors que micropipettes sont indispensables pour des expériences de biologie moléculaire qui ont besoin de montants ne microlitres de solutions. Lorsque la technique aseptique est pratiquée avec ces instruments, la contamination est réduit au minimum pendant les transferts de volume indépendamment de la quantité de liquide ou de type d'expérience.
Bien que n'étant pas discuté dans le présent protocole, un autre moyen couramment utilisés pour prévenir la contamination est de travailler au sein d'une hotte à flux laminaire (Figure 10). Cet équipement est essentiel pour la culture de tissus et pour des expériences effectuées avec des micro-organismes classés comme BLS-2 ou plus. Une hotte à flux laminaire contient un filtre HEPA (haute efficacitéparticulaire de l'air) de filtre qui supprime les contaminants en suspension dans l'air s'écoulant le capot tout en empêchant l'air non filtré de la chambre de perméation de l'espace de travail. Fait à noter, un bec Bunsen ne peuvent pas être utilisés à l'intérieur d'une hotte à flux laminaire, car la chaleur de la flamme perturbe l'écoulement de l'air indispensable à la fonctionnalité de la hotte.
Il est souvent utile de vérifier la qualité de votre technique aseptique lors de la réalisation d'expériences. Pour valider des solutions, et des milieux de culture ne se contaminent au cours des manipulations expérimentales, toujours préparer un contrôle négatif. Par exemple, si la préparation des tubes de bouillon pour la croissance des cultures bactériennes, ne pas ensemencer un tube ne laissant que les médias stériles. Incuber le milieu aux côtés des tubes inoculés ensuite inspecter le tube témoin non inoculé des signes de contamination tels que la turbidité de la croissance de cellules indésirables involontairement introduits dans le tube. Si le tube de contrôle est contaminé, le tube d'expérienceest probable sont contaminés en tant que bien, et l'expérience devra être répétée. Ces mesures de précaution doit être fait avec toutes les expériences.
Déclarations de divulgation
Je n'ai rien à communiquer.
Remerciements
Un merci spécial à Cori Sanders aux conceptions IROC pour la préparation des illustrations et de Kris Reddi à l'UCLA pour la mise en place des cultures d'échantillons de chiffres. Le financement de ce projet a été fourni par HHMI (HHMI Grant n ° 52006944).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Bouillon LB | Difco | 244620 | Recette également disponible en référence 6 |
| TE Buffer: | |||
| Dihydraté EDTA disodique | Sigma | E5134 | |
| Trizma-HCl | Sigma | T-3253 | |
| CiDecon | Decon Laboratories, Inc | 8504 | Désinfectant |
| L'éthanol | Fisher Scientific | A406 | Pour utilisation comme désinfectant, préparer 70% (v / v) avec de l'eau distillée |
Références
- Barker, K. . At the Bench: A Laboratory Navigator. , (1998).
- . . Biosafety in Microbiological And Biomedical Laboratories (BMBL). , (2009).
- Bykowski, T., Stevenson, B. Aseptic Technique. Current Protocols in Microbiology. Appendix 4, Appendix 4D (2008).
- Coté, R. J. Aseptic Technique for Cell Culture. Current Protocols in Cell Biology. Chapter 1, Unit 1.3 (2001).
- Grimes, S. E. A basic laboratory manual for the small-scale production and testing of I-2 Newcastle disease vaccine. RAP Publication. AC802/E, 12-13 (2002).
- Guzman, K. Pipetting: A Practical Guide. The American Biology Teacher. 63 (2), 128-131 (2001).
- Jordan, T., et al. . RESEARCH: National Genomics Research Initiative Phage Resource Laboratory Manual. , (2008).
- Sambrook, J., Russell, D. W. . Molecular Cloning - A Laboratory Manual. , 978-087969576 (2001).
- Seidman, L. A., Moore, C. J. . Basic Laboratory Methods for Biotechnology: Textbook and Laboratory Reference. , (2000).
- . . PIPETMAN P User's Guide. , (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon