Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En la reconstitución in vitro de los activos T. castaneum telomerasa
En este artículo
Resumen
Esfuerzos para aislar a la subunidad catalítica de la telomerasa, TERT, en cantidades suficientes para realizar estudios estructurales, han tenido un éxito limitado desde hace más de una década. En este sentido, los actuales métodos para el aislamiento de la recombinación del TERT Tribolium castaneum ( Tc TERT) y la reconstitución de los activos T. castaneum Telomerasa ribonucleoproteína (RNP) complejo In vitro.
Resumen
Esfuerzos para aislar a la subunidad catalítica de la telomerasa, TERT, en cantidades suficientes para realizar estudios estructurales, han tenido un éxito limitado desde hace más de una década. En este sentido, los actuales métodos para el aislamiento de la recombinación del TERT Tribolium castaneum (Tc TERT) y la reconstitución de la T. activos telomerasa castaneum ribonucleoproteína (RNP) complejos in vitro.
La telomerasa es una transcriptasa reversa especializada 1 que añade repeticiones cortas de ADN, llamados telómeros, al extremo 3 'de los cromosomas lineales dos que sirven para protegerse de la fusión de extremo a extremo y la degradación. Después de la replicación del ADN, un segmento corto se pierde al final del cromosoma 3, y sin telomerasa, las células siguen dividiendo hasta que finalmente llegando a su límite Hayflick 4. Además, la telomerasa está inactiva en la mayoría de las células somáticas cinco en adultos, pero está presente en seis células de cáncer en la que promueve la inmortalidad celular 7.
La enzima telomerasa mínima consta de dos componentes básicos: la subunidad de la proteína (TERT), que comprende la subunidad catalítica de la enzima y un componente integral de ARN (TER), que contiene el TERT plantilla utiliza para sintetizar telómeros 8,9. Antes de 2008, sólo las estructuras de los dominios individuales de la telomerasa se había resuelto 10,11. Un gran avance en este campo llegó a la determinación de la estructura cristalina de los 12 activos, subunidad catalítica de la T. telomerasa castaneum, Tc TERT 1.
Aquí, se presentan métodos para producir grandes cantidades de TERT activo, soluble Tc para estudios estructurales y bioquímicos, y la reconstitución del complejo RNP telomerasa in vitro para los ensayos de actividad de la telomerasa. Una visión general de los métodos experimentales utilizados se muestra en la Figura 1.
Protocolo
1. Expresión de proteínas recombinantes TERT Tc
- Inocular 6 L de 2YT los medios de comunicación (6 x 2 L Desconcertado matraces Erlenmeyer que contiene 1 l de caldo de 2YT en cada uno) de seis nuevas placas de las células transformadas pLysS Rosetta (DE3) que contiene la síntesis Tc TERT plásmido con un TEV escindibles N-terminal hexahistidina- etiqueta.
- Se cultivan las células a 37 ° C mientras se agita a 220 rpm a una OD 600 de 0.5-0.6.
- Inducir la expresión de proteínas mediante la adición de 1 mM IPTG.
- Reduzca la temperatura a 30 ° C, lenta agitación a 150 rpm, y permiten a las células expresan la proteína de 04.05 h.
- Las células de la cosecha por centrifugación a 4 ° C y 3500 rpm durante 30 minutos.
- Resuspender cada una L sedimento celular en 20 ml de solución tampón que contiene 25 mM Tris, pH 7,5, 10% de glicerol, 0,5 M KCl, 15 mM imidazol, 5 mM β-mercaptoetanol, y 0,1 mM de fluoruro de sulfonilo fenilmetil (PMSF) y benzamidina.
- Flash congelar mezcla de células se resuspendieron goteando lentamente por las células en un tubo de plástico de 50 ml cónico lleno de nitrógeno líquido, para que cada gota se congela en el impacto en el N2 líquido. Almacenar células congeladas a -80 ° C hasta el momento de purificación de proteínas.
2. La purificación de Tc TERT
- Células descongele a temperatura ambiente hasta obtener una consistencia líquida que se alcanza y luego pasar a vasos de metal en el hielo de ultrasonidos.
- Sonicar las células en hielo durante 2 minutos en intervalos de 30 segundos con 30 segundos hace una pausa, aproximadamente a 51 W de potencia.
- Centrifugar las células lisadas a 18.000 rpm durante 20 minutos para separar las fracciones de proteína soluble e insoluble y retirar con cuidado el sobrenadante por cromatografía de afinidad de níquel.
- Equilibrar el Ni-NTA (níquel-ácido nitrilotriacético) columna con un tampón que contiene 25 mM Tris, pH 7,5, 10% de glicerol, 0,5 M KCl, 15 mM imidazol, 5 mM β-mercaptoetanol, y 0,1 mM PMSF y benzamidina.
- Sobrenadante de carga sobre la resina y recoger el flujo a través.
- Lavar la columna con un tampón que contiene 25 mM Tris, pH 7,5, glicerol al 10%, 500 mM KCl, 15 mM imidazol, 5 mM β-mercaptoetanol, y 0,1 mM PMSF para eliminar todas las proteínas residuales y no específicamente de ruedas.
- Eluir Tc TERT de la resina Ni-NTA utilizando un gradiente de imidazol de 15 - 300 mm y cobrar fracciones de 3 ml para el análisis de SDS-PAGE.
- Utilizar el análisis de página para determinar qué fracciones de proteína TERT contienen Tc y concentrar estas fracciones en un Amicon 30 kDa (Millipore) de filtro.
- Concentrado Tc fracciones TERT en un volumen inferior a 10 ml para una mayor purificación.
- El TERT Tc se purifica aún más sobre la columna de intercambio catiónico (SA poros, Applied Biosystems) pre-equilibrada con un tampón que contiene 25 mM Tris, pH 7,5, glicerol al 10%, 500 mM KCl y 1 mM DTT.
- Cargar la mezcla de proteínas en la columna SA poros y lavar para eliminar todas las proteínas y ácidos nucleicos contaminantes.
- Lavar la columna con un tampón que contiene 500 mM KCl seguido por 700 mM KCl para eliminar cualquier contaminante restante.
- Eluir la proteína TERT Tc de la columna SA poros con un buffer M KCl. En este punto, la proteína debe ser más del 99% de pureza.
- Eliminar cualquier agregados de la proteína al pasar la proteína en una columna de Superdex-200 de tamaño (el tamaño de cromatografía de exclusión - GE Healthcare), previamente equilibrada con un tampón que contiene 25 mM Tris, pH 7,5, glicerol al 10%, 500 mM KCl y 1 mM TCEP.
3. Tribolium castaneum escarabajo cultura
- El T. castaneum escarabajos en un principio como un regalo por el Dr. S. Brown, de la División de Biología de la Universidad Estatal de Kansas.
- Inicio T. castaneum la cultura mediante la adición de cien escarabajos adultos a un contenedor, con 28,5 g de harina y 1,5 g de levadura seca de panadería.
- Tienda de las culturas del escarabajo a temperatura ambiente y en un ambiente oscuro y húmedo de tres a cuatro semanas para permitir la reproducción y crecimiento. Coloque un vaso con agua en el área de almacenamiento del escarabajo para asegurar un ambiente húmedo.
- Cosecha de las larvas de escarabajos, según sea necesario para el aislamiento de ARN. Deje que el resto de las larvas a madurar a los adultos, manteniéndolos en la misma cultura.
- Cada mes, la transferencia de los escarabajos más activos (no más de un centenar) en un nuevo frasco que contiene la harina y la levadura fresca para reponer el suministro de alimentos.
4. T. castaneum total aislamiento de ARN
- Cosecha de 20 larvas del escarabajo de la cultura (cada cultura debe contener entre 500 a 1000 larvas), separándolos de los escarabajos adultos y la cultura de harina / levadura. Eliminar las partículas de harina o la levadura unido a los escarabajos antes de molerlos.
- Esterilizar la zona de banquillo, el mortero y el pilón (considerar el tratamiento de los guantes, así) que se utiliza para este procedimiento con RNaseZap (Ambion, Inc.) para eliminar todos los rastros de ribonucleasas antes de la molienda de los escarabajos.
- Triturar las larvas en N2 líquido en un polvo fino utilizando un mortero y ttransferencia se entiende el polvo a un tubo de centrífuga de 50 ml, mientras que el mantenimiento de la N 2 líquido para asegurarse de que el polvo se queda congelado hasta que el tampón de extracción, se añade.
- Permita que el exceso de líquido se evapore N 2 a partir del polvo. Después de que el N 2 líquido se haya evaporado, homogeneizar el polvo de escarabajo en 200 l de tampón de extracción (por las larvas del escarabajo 20) que contiene 25 mM Tris-HCl, 5 mM β-mercaptoetanol, 1 mM EGTA, 0,1 benzamidina mM, 200 mM KCl, 10 % de glicerol, 10 mM imidazol y 20U de RNasin, pH 7,5 e incubar en hielo durante 30 minutos.
- Centrifugar el homogeneizado a 15.000 rpm durante 20 minutos a 4 ° C, recoger el sobrenadante y el flash congelar la muestra en N 2 líquido. Si es necesario, las muestras pueden ser almacenadas a -80 ° C durante la noche.
- Extraer el ARN total utilizando el RNeasy Mini Kit (Qiagen).
5. Reconstitución in vitro de la telomerasa Tribolium castaneum
- Mezclar 20 g de proteínas recombinantes de etiquetado Su TERT Tc con 50 l de T. castaneum ARN total en el tampón de unión que contiene 25 mM Tris-HCl, 200 mM KCl, 10% de glicerol, 5 mM β-mercaptoetanol, y 10 mM imidazol, pH 7,5.
- Incubar el TERT Tc - total mezcla de ARN durante dos horas a 22 ° C en T. castaneum lisado en la presencia de un inhibidor RNasin para evitar la degradación del ARN.
- Purificar el complejo en una columna de Ni-NTA para eliminar las impurezas lisado y el ARN en exceso.
6. Repetir la telomerasa protocolo de amplificación (TRAP) ensayos
- Mezcle 4 mg de Ni-NTA purificado T. castaneum telomerasa en 50 l de amortiguación elongación que contiene 20 mM Tris-HCl (pH - 8,3), 7,5 mM MgCl2, 63 mM KCl, 0,05% de Tween 20, 1 mM EGTA, el 0,01% de BSA, 0,5 mM dNTPs, 1 M ATC-TS ADN primer (5'-AAGCCGTCGAGCAGAGTC-3 '), y se incuba la mezcla a 30 ° C durante 60 minutos para permitir el alargamiento de la cartilla de ADN ATC-TS por el reconstituido T. castaneum telomerasa.
- Extracto de la alargada ADN de cadena sencilla (ssDNA) mediante la adición de un volumen igual de fenol cloroformo a la mezcla de reacción. Agite la mezcla suavemente hasta que la emulsión es homogénea.
- Centrifugar la muestra a 12.000 rpm durante cinco minutos a 4 ° C para separar el ADN de cadena simple de los contaminantes.
- La transferencia de la capa superior acuosa de la muestra a un tubo eppendorf de 1,5 ml, añadir una concentración final de 10 mM NaOAc (pH 5,0), 1 mM de MgCl 2, y el 66,4% EtOH y luego dejar que la muestra para precipitar la noche a -20 ° C.
- Girar la muestra a 15.000 rpm durante treinta minutos a 4 ° C para que sedimenten las ssDNA precipitado. Se decanta la solución con una pipeta y luego añadir 200 l de EtOH al 70% de la muestra para lavar restantes NaOAc y MgCl 2 de la muestra. Centrifugar la muestra durante cinco minutos a la misma velocidad y temperatura para volver a pellet de la muestra.
- Decantar la solución EtOH con una pipeta y eliminar los rastros restantes de etanol al permitir que el tubo eppendorf para la incubación de abrir a temperatura ambiente durante tres minutos. Contar con la presencia de etanol en la muestra va a interferir con el paso de amplificación de PCR.
- Resuspender el precipitado ssDNA (que contiene el producto telomerasa alargada y el primer ATC-TS) en 50 l de tampón de reacción de PCR que contiene 10 mM Tris-HCl (pH 8), 50 mM KCl, 2 mM MgCl 2, dNTPs 100 mM (dATP, dGTP y dTTP), 10 M [32 P] dCTP, 1 M ATC-CX primer (5'-GTGTGACCTGACCTGACC-3 ') y 1,25 U de Taq polimerasa de ADN.
- Amplificar por PCR los productos de alargamiento de la telomerasa (29 ciclos de 94 ° C durante 30 segundos, 50 ° C durante 30 segundos y 72 ° C durante 1 minuto), de modo que sean visibles en un gel de poliacrilamida al 12%.
- Pre-ejecutar el gel del 12% con Tris-borato-EDTA (TBE) en funcionamiento un tampón que contiene 44,5 mM Tris, 44,5 mM de ácido bórico, 1 mM EDTA, pH 8 durante treinta minutos antes de correr las muestras de PCR. Después de pre-ejecución y la carga del gel con la reacción de PCR, ejecute el gel a 185 voltios de 1.5 a 2 horas a 4 ° C o en hielo.
- Secar el gel y el uso de la placa de fósforo de imagen para visualizar la actividad.
7. Los resultados representativos:
Un ejemplo de la TERT purificada Tc después de cromatografía de exclusión se muestra en la Figura 2. La proteína concentrada después de la purificación se ejecuta en un 12% SDS-gel de poliacrilamida y se demuestra que es más de 99% (Figura 2). La exclusión de tamaño (S200) cromatograma también se proporciona (Figura 2B) para demostrar la pureza y la falta de agregados de la muestra de proteína purificada. Un rendimiento de 5 mg de proteína después de todos los pasos de purificación se han completado, aunque generalmente se obtiene el rendimiento final puede variar.
Un ensayo TRAP representante de la reconstituida T. telomerasa castaneum se muestra en la Figura 3 como se informó anteriormente por Mitchell et al. 12. La escala gradual de los productos de la telomerasa se puede ver en la calle 1, sin embargoestán ausentes tanto en la telomerasa RNasa tratados y la TERT sitio activo de las muestras de mutantes (D251A) en las calles 2 y 3, respectivamente.
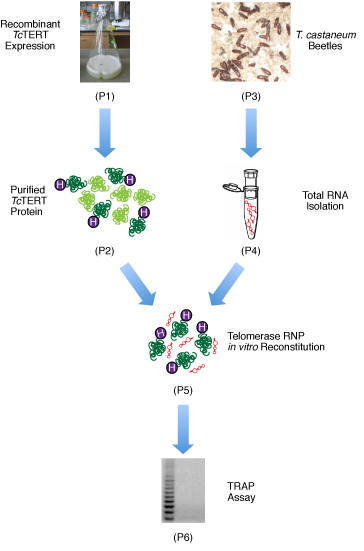
Figura 1. Diagrama de flujo de los pasos necesarios para la reconstitución de la recombinación del TERT Tc. En primer lugar, la recombinación del TERT Tc está sobre-expresado en E. coli. La proteína se purifica por el níquel, el intercambio de cationes y cromatografía de exclusión por tamaño. El T. escarabajos castaneum se cultivan en casa y sus larvas se utilizan para aislar el ARN total. El purificado Tc TERT y el ARN total se mezclan para reconstituir el complejo RNP telomerasa, y un posterior ensayo TRAP se utiliza para confirmar el complejo RNP es una telomerasa activa.
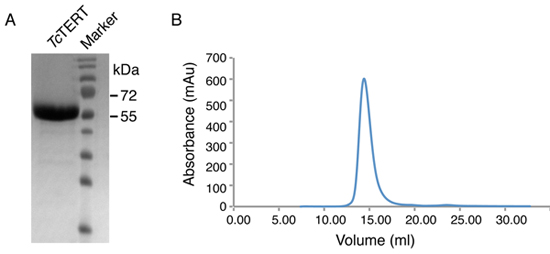
Figura 2. Tamaño cromatograma de exclusión y el análisis de SDS-PAGE de la proteína TERT Tc. (A) 12% SDS-gel de poliacrilamida de la proteína TERT Tc después de cromatografía de exclusión. La proteína TERT Tc (70 kDa), emigra más rápido en el gel SDS-PAGE, ya que tiene un alto punto isoeléctrico (pI - 9,8). (B) Cromatograma de exclusión de tamaño (Superdex S200) de la proteína TERT Tc.

Figura 3. Ensayos trampa de la in vitro reconstituido Tribolium castaneum telomerasa adaptado de Mitchell et al. 12. Pista 1: tipo salvaje Tc TERT y el ARN total aislado de las larvas del escarabajo. Carril 2: de tipo salvaje Tc TERT y RNasa tratados ARN total de las larvas y los extractos de células. Carril 3: sitio activo mutantes Tc TERT (D251A) y el escarabajo de ARN total de las larvas de las larvas.
Access restricted. Please log in or start a trial to view this content.
Discusión
El método aquí presentado permite la producción de grandes cantidades de la subunidad catalítica de la T. castaneum TERT de la telomerasa en forma soluble y activa para realizar estudios estructurales y bioquímicos. El método de Tc TERT sobre-expresión es sensible a los cambios sutiles en la temperatura o la densidad de las células de las arriba indicadas y puede afectar dramáticamente los niveles de expresión de la proteína. En concreto, hemos encontrado que la inducción de las células pa...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
La investigación presentada aquí fue apoyado por el Departamento de Salud de Pennsylvania, la Asociación Médica Ellison, V y Los fundamentos de esmeralda.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| Rosetta (DE3) pLysS células | Novagen | 70956 | |
| 2YT caldo | Teknova | Y0215 | |
| IPTG | Oro Biotecnología | I2481C | |
| Misonix Sonicator 3000 | Qsonica, LLC. | ||
| ÄKTA purificador FPLC | GE Ciencias de la Vida | ||
| Ni-NTA SuperFlow resina | Qiagen | 30410 | |
| Amicon Ultra-15 Dispositivo de filtro centrífugo | Millipore | UFC903008 | |
| POROS 50 SA intercambio de cationes fuerte embalaje | Applied Biosystems | 1-3359-06 | |
| POROS 50 HQ intercambio de cationes fuerte embalaje | Applied Biosystems | 1-2559-06 | |
| Superdex 200 10/300 de exclusión por tamaño de columna | GE Ciencias de la Vida | 17-5175-01 | |
| Fenol: cloroformo: isoamílico 25:24:1 con 10 mM Tris, pH 8, 1 mM EDTA | Sigma | P3803-100 ml | |
| RNaseZap | Ambion | AM9780 | |
| Recombinante inhibidor de la ribonucleasa RNasin | Promega | N251B | |
| RNeasy Mini Kit | Qiagen | 74104 | |
| Oligonucleótidos de ADN | Integrado las tecnologías de ADN |
Referencias
- Gillis, A. J., Schuller, A. P., Skordalakes, E. Structure of the Tribolium castaneum telomerase catalytic subunit TERT. Nature. 455, 633-637 (2008).
- Greider, C. W., Blackburn, E. H. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell. 43, 405-413 (1985).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345, 458-460 (1990).
- Hayflick, L. The Limited in vitro Lifetime of Human Diploid Cell Strains. Exp Cell Res. 37, 614-636 (1965).
- Blackburn, E. H. Telomeres: no end in sight. Cell. 77, 621-623 (1994).
- Kim, N. W. Specific association of human telomerase activity with immortal cells and cancer. Science. 266, 2011-2015 (1994).
- Bodnar, A. G. Extension of life-span by introduction of telomerase into normal human cells. Science. 279, 349-352 (1998).
- Greider, C. W., Blackburn, E. H. The telomere terminal transferase of Tetrahymena is a ribonucleoprotein enzyme with two kinds of primer specificity. Cell. 51, 887-898 (1987).
- Greider, C. W., Blackburn, E. H. A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis. Nature. 337, 331-337 (1989).
- Jacobs, S. A., Podell, E. R., Cech, T. R. Crystal structure of the essential N-terminal domain of telomerase reverse transcriptase. Nat Struct Mol Biol. 13, 218-225 (2006).
- Rouda, S., Skordalakes, E. Structure of the RNA-binding domain of telomerase: implications for RNA recognition and binding. Structure. 15, 1403-1412 (2007).
- Mitchell, M., Gillis, A., Futahashi, M., Fujiwara, H., Skordalakes, E. Structural basis for telomerase catalytic subunit TERT binding to RNA template and telomeric DNA. Nat Struct Mol Biol. 17, 513-518 (2010).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados