Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Método rentable para el Rastreo de uso microbiana específica virus humanos y animales
En este artículo
Resumen
El estudio describe un método costo-efectivo para la identificación de la fuente de contaminación fecal / orina o la contaminación por nitratos en el agua utilizando qPCR para la cuantificación específica de los virus de ADN humano / porcino / bovino, adenovirus y poliomavirus, propuesto como herramientas de MST.
Resumen
La contaminación microbiana del medio ambiente representa un riesgo significativo para la salud. Clásicos indicadores fecales bacterianos han demostrado que tienen limitaciones significativas, los virus son más resistentes a procesos de inactivación y muchos indicadores estándar fecal no informan sobre la fuente de contaminación. El desarrollo de métodos eficientes para la concentración de virus a partir de agua y ensayos moleculares facilita la aplicación de los virus como indicadores de contaminación fecal y herramientas de software como el seguimiento microbiano (MST). Adenovirus y poliomavirus son virus ADN infectar a especies específicas de vertebrados incluyendo a los humanos y son persistentemente excreta en las heces y / o de orina en todas las áreas geográficas estudiadas. En estudios anteriores, hemos sugerido la cuantificación de los adenovirus humanos (HAdV) y poliomavirus JC (JCPyV) por PCR cuantitativa (qPCR) como un índice de contaminación fecal humana. Recientemente, se han desarrollado ensayos de PCR cuantitativa para la cuantificación específica del porcine adenovirus (PADV) y poliomavirus bovina (BPYV) como animales marcadores de contaminación fecal con la sensibilidad de copias del genoma 1.10 por tubo de ensayo. En este estudio, se presenta el procedimiento a seguir para identificar la fuente de contaminación en muestras de agua usando estas herramientas. Como ejemplo de resultados representativos, el análisis de virus en el agua subterránea presenta altos niveles de nitratos se muestra.
Detección de virus en las aguas contaminadas de baja o moderada requiere la concentración de los virus por lo menos de varios litros de agua en un volumen mucho menor, un procedimiento que generalmente consta de dos etapas de concentración en serie. Este procedimiento un tanto engorroso y la variabilidad observada en la recuperación viral significativamente interferir con el procesamiento simultáneo de un gran número de muestras de agua.
Con el fin de eliminar los cuellos de botella causados por los procedimientos de dos pasos que hemos aplicado un protocolo de un solo paso desarrollado en Studie anteriors, y aplicable a una diversidad de matrices de agua. El procedimiento incluye: la acidificación de las muestras de agua de diez litros, floculación de la leche desnatada en polvo, sedimentación por gravedad de los materiales floculada, la recogida del precipitado y centrifugación, resuspensión del precipitado en tampón fosfato 10 ml. El concentrado viral se utiliza para la extracción de ácidos nucleicos virales y los adenovirus y poliomavirus específicos de interés se han cuantificado mediante qPCR. Alto número de muestras se podrá analizar simultáneamente con este método de concentración de bajo costo.
El procedimiento se ha aplicado al análisis de las aguas de baño, agua de mar y agua de los ríos y en este estudio, se presentan los resultados de analizar muestras de agua subterránea. Este método cuantitativo de alto rendimiento es fiable, sencilla y rentable.
Protocolo
1. Concentración de las partículas virales presentes en muestras de agua
- Recolección y acondicionamiento de muestras de agua
- Recoger un mínimo de dos réplicas de 10 L por cada muestra en recipientes de plástico con fondo plano y una muestra adicional, como el control del proceso. Esta última muestra se enriquece con una cantidad conocida de partículas virales y se utiliza como control.
Nota: Se recomienda contar con un material especial independiente (botellas, tubos, etc) para muestras adicionadas. - Verificar la calibración del conductímetro y volver a calibrar si es necesario. Preparar un control negativo con agua del grifo previamente ajustado a la conductividad adecuada (ver más abajo 1.6) en un recipiente de plástico adicional L 10.
- Para muestras adicionadas: Añadir el volumen estándar de la lucha contra el virus (aproximadamente 10 5 copias del genoma por cada 10 litros de agua) a la muestra. Mezclar por agitación evitar salpicaduras y aerosoles. Los controles positivos que podría consistir en una cepa poco común de adenovirus sran como HAdV-35 o un bacteriófago como MS2.
- Si la muestra presenta gran cantidad de material en suspensión (arena u otros materiales), hizo que los sedimentos durante 15 minutos. Transferir el agua en un recipiente nuevo.
- Ajustar el pH de la muestra de agua a 3,5 (± 0,1) con la adición de HCl 1 N. Este paso es importante para la concentración de los virus, así que asegúrese de que el pH se ha ajustado correctamente. Mezcle el agua bien por agitación vigorosa, mientras que la adición de HCl. (Nota: Si el pH es inferior a 3,5 añadir NaOH 1 M).
- Ajustar la conductividad. Si la muestra tiene una conductividad de 1500 uS / cm o más, este paso no es necesario. Si la conductividad es inferior a 1.500 uS / cm la formación de material floculado (flóculos) no está garantizada para ajustar la conductividad de 1500 uS / cm por la adición de sales de mar artificial (Sigma). Mezclar enérgicamente con agitación, mientras que la adición de las sales del mar.
- Registre el pH de las muestras antes y después del acondicionamiento, así como uns el volumen de HCl utilizado. La conductividad también deben ser registrados después de ajustar el pH. Siempre desinfectar los electrodos de pH-metro y conductímetro con una nueva solución de HCl, el cloro con una solución de sodio al 10% Tiosulfato y finalmente enjuagar con agua destilada.
- Recoger un mínimo de dos réplicas de 10 L por cada muestra en recipientes de plástico con fondo plano y una muestra adicional, como el control del proceso. Esta última muestra se enriquece con una cantidad conocida de partículas virales y se utiliza como control.
- Preparación de pre-floculado leche desnatada 1% (PSM)
- Verificar la calibración del pH-metro y conductímetro y volver a calibrar si es necesario.
- Prepare una solución pre-floculado leche desnatada (1 PSM%, w / v) disolviendo 10 g de polvo de leche descremada (Difco) en un agua de mar artificial L (se disuelven 33,3 g de sal marina artificial en 1 litro de agua del grifo sin cloro y autoclave) y cuidado de ajustar el pH a 3,5 con HCl 1N. Los flóculos deben ser visibles. Prepare la solución justo antes de ser utilizado o se almacenan a 4 ° C durante 24 h. Para decloración uso 1 ml de solución Tiosulfato 10% por cada 100 ml de agua.
- Floculación de las partículas virales presentes en las muestras de agua
- Añadir 100 ml de 1% PSM a la muestra de agua 10-L.
- Agitar las muestras de 80-10 h para permitir que el virus de absorber a los flóculos. Use un temporizador para apagar la agitación después de 8-10 h.
- Detener la agitación y dejar que el sedimento flóculos por la gravedad de 80-10 h.
- Recolección y re-disolver los flóculos. Centrifugación
- Eliminar el sobrenadante mediante una bomba peristáltica y una pipeta de plástico conectada a un tubo de plástico. Para muestras adicionadas el sobrenadante debe ser recogida en una botella y desinfectados de acuerdo a los procedimientos internos. En todos los casos CUIDAR no recoger el sedimento.
- Recoger los sedimentos con los flóculos (500 ml) en una botella de centrífuga.
- Balance de las ollas con la adición de pH 3,5 PSM.
- Centrífuga de las macetas en una centrífuga de alta velocidad a 8.000 xg durante 30 min a 4 ° C. Tan pronto como se detiene la centrífuga, retire con cuidado los botes de centrífuga de la centrifugadora.
- Muy gently verter y desechar el sobrenadante. Siga las medidas apropiadas para material infeccioso.
- 7 ml de solución amortiguadora de fosfato para disolver el precipitado en cada botella de centrífuga.
- Una vez que los copos se han disuelto, medir y añadir tampón fosfato para llegar a un volumen total de 10 ml.
- Homogeneizar el concentrado viral por agitación y distribuir los 10 ml en microtubos limpia que debería estar congelado a -80 ° C hasta que se necesite en su posterior análisis.
2. Extracción del ácido nucleico
- Realizar una extracción de ácidos nucleicos con el QIAamp Viral RNA Mini Kit de las instrucciones del fabricante. Este kit permite la utilización de una plataforma automatizada (como Qiacube, Qiagen).
3. PCR cuantitativa de los adenovirus humanos (HAdV), poliomavirus JC (JCPyV), adenovirus porcino (PADV) y poliomavirus bovina (BPYV)
- La cuantificación de copias del genoma en las muestras
- Prepararla mezcla de PCR cuantitativa en un área separada limpia utilizando TaqMan PCR Master Mix Ambiental 2x (Applied Biosystems). La reacción tiene lugar en una placa de reacción de 96 pozos cubierto con óptica cubre adhesivo óptico. Las concentraciones de la mezcla maestra, primers y sondas se describen en la Tabla 1.
- Una vez que la mezcla ha sido preparado, 15μl alícuotas en cada pozo incluyendo los controles (ver 3.2). El volumen total de una reacción después de la adición de la meta se 25μl (mezcla de 15μl de la muestra + 10μl o estándar).
- Añadir el ácido nucleico extracciones de las muestras (10μl) en un área separada. Ejecutar directa y una dilución de diez veces en agua purificada de cada muestra por duplicado. Cubrir los pozos que contienen las muestras con parte de una cubierta adhesiva, tenga la otra parte de la cubierta para el siguiente paso.
- Añadir las diluciones de la suspensión de ADN estándar (10μl) de 10 0 a 10 6 GC/10μl por triplicado y con una micropipeta de uso exclusivo para el Stanestándar de ADN. Es recomendable añadir las normas en una zona equipada con la radiación UV para la destrucción de ADN plásmido, y para limpiar la micropipeta tras cada uso. Cubrir los pozos que contienen las normas de la cubierta adhesiva pre-cortadas.
Nota: Para preparar suspensiones estándar para ser utilizado en la cuantificación de copias del genoma, la región del ADN objetivo debe ser clonado en un plásmido y lineal. En la siguiente dirección se encuentra un procedimiento detallado de cómo crear curvas de nivel con las plantillas de ADN plásmido para ser utilizados en qPCR:
http://www.appliedbiosystems.com/support/tutorials/pdf/quant_pcr.pdf - Realizar la qPCR en un sistema adecuado de seleccionar los parámetros adecuados (teniendo en cuenta el uso de la cubierta adhesiva y el volumen total en cada pozo, etc.) Tras la activación del AmpliTaq Gold durante 10 min a 95 ° C, 40 ciclos de amplificación se realizan de la siguiente manera: 15 s a 95 ° Cy 1 min a 60 ° C durante HAdV, JCPyV y BPYV, y 15 s a 95 ° C, 20 a 55 ° C y 20 a 60 ° C para PADV.
- Una vez que las reacciones se han completado, los datos almacenados y los resultados como se describe en el manual del usuario de los equipos utilizados. La cantidad de ADN se define como la mediana de los datos obtenidos después de corregir el factor de dilución cuando sea necesario.
- Controles
- Utilice los controles positivos y negativos. El ensayo debe incluir más de un no-modelo de control (NTC) para probar la mezcla no produce fluorescencia. Es aconsejable que ejecute el control de procesos positivos con el fin de evaluar la potencial inhibición enzimática debido a los inhibidores presentes en las muestras estudiadas.
- Registrar los resultados de los ensayos de qPCR de dos diferentes diluciones del ADN estándar y de control de procesos. Usar los resultados para elaborar gráficos de control para el control de calidad (QC) los programas relacionados con la sensibilidad y la eficiencia de los ensayos.
- La confirmación deresultados
- Los resultados positivos pueden ser confirmado mediante secuenciación PCR anidada y de nucleótidos de los amplicones, la producción de datos sobre las secuencias de nucleótidos de las cepas detectadas 1,5,6,7,9,12.
Siguiendo el procedimiento descrito, los virus humanos y animales han sido detectados y cuantificados en las aguas de baño, agua de mar y agua de los ríos 2,3. Como ejemplo representativo, las muestras de agua subterránea de las áreas que presentan altos niveles de nitratos fueron evaluados para definir las fuentes de la contaminación. Diez litros de muestras de agua fueron recolectadas en cuatro pozos diferentes en las zonas rurales de una región del noreste de España. Cinco réplicas se obtuvieron en cada una repetición bienestar sembrado con adenovirus humanos 2 utilizadas como control de procesos. Las muestras fueron procesadas de acuerdo al protocolo representadas en la figura 1. Las cuatro réplicas analizadas en uno de los cuatro sitios estudiados mostraron resultados positivos para PADV (valor medio 7.74x10 2 GC / L), que se relaciona con la presencia de purines de cerdo en los alrededores del sitio de muestreo y apoyaría la contaminación fecal porcina como la fuente de nitratos en el agua subterránea (Tabla 2).
4. Los resultados representativos:
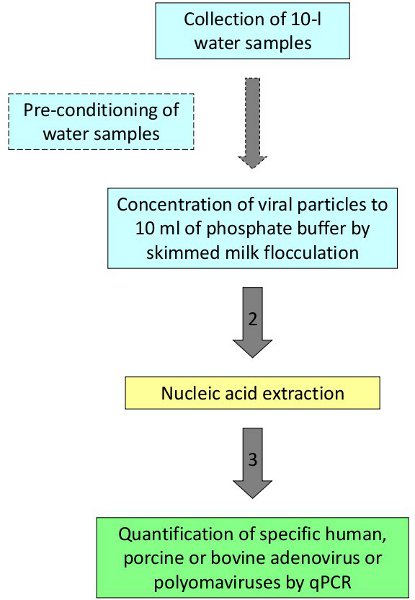
Figura 1. Procedimiento para la detección y cuantificación de virus en el agua.
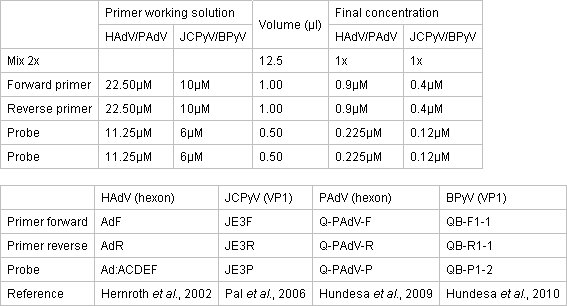
Tabla 1. Concentración de los cebadores y sondas para ensayos de PCR cuantitativa.

Tabla 2. Detección y cuantificación de adenovirus humanos y animales y poliomavirus en muestras de agua subterránea.
n número de réplicas analizadas
Porcentaje% de los positivos se replica
(-) No detectados
Discusión
El procedimiento descrito se cumplen las condiciones para un método de ajuste de rutina de los laboratorios de salud ambiental y pública: reproducible, fiable, sencillo y rentable. El protocolo es sencillo, sin embargo, deben seguirse estrictamente. Baja conductividad en las muestras sin necesidad de añadir la concentración de sales pidió agua de mar artificial reduciría dramáticamente la recuperación de los virus, como sería el caso si el tiempo de agitación para la floculación es significativamente re...
Divulgaciones
Dos solicitudes de patente presentadas en 2009 para proteger la propiedad intelectual de los protocolos para la cuantificación de PADV y BPYV.
Agradecimientos
Este trabajo fue parcialmente financiado por el Gobierno español "Ministerio de Educación y Ciencia" (proyecto AGL2008-05275-C01/ALI), por el Marco Europeo de Investigación de la Unión siete proyectos financiados VIROBATHE (Contrato N º 513.648), VIROCLIME (Contrato N º 243923 ) y por la Agencia Catalán de agua, Agència Catalana de l'Aigua (ACA), Departamento de Control i Millora dels Ecosistemes acuáticos. Durante el estudio desarrollado Marta Rusiñol era un compañero del catalán Gobierno "AGAUR" (FI-DGR).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Centrífuga de alta velocidad (8.000 xg) | Berckman Coulter | Avanti J-20XP | |
| pH-metro, termómetro y conductímetro | Afora | LPPC3003 | |
| Tubos de plástico 100-200 cm de longitud | Deltalab | 350059 | |
| Se graduó pipetas desechables estériles | Labclinics | PN10E1 | |
| Tubos estériles de plástico de 1,5 y 10-15 ml (Eppendorf, halcones, etc) | Afora | KA298/00 | |
| Ollas centrifugadora (500 mL) | Fisher Scientific | SE5753512 | |
| Agitadores magnéticos e imanes (uno porde la muestra) | Fisher Scientific | 10510 | |
| De vidrio o recipientes de plástico con fondo plano para permitir el uso de agitadores magnéticos | Deltalab | 191642 | |
| Una bomba peristáltica para retirar el sobrenadante (o una bomba de vacío por chorro de agua) | Watson-Marlow | 323E / D | |
| Temporizador para apagar la agitación después de 8-10 horas | Deltalab | 900400 | |
| El ácido clorhídrico (1 N y 0,1 N) | Panreac | 141020.1611 | |
| Hidróxido de sodio (1N) | Panreac | 131687.1211 | |
| Sales del agua de mar artificial mar | Sigma | S9883 | |
| La leche desnatada (SM) | Difco | 232100 | |
| Fosfato de pH 7, 5 | 1:2 v / v de estériles Na 2 HPO 4 0,2 M y NaH 2 PO 4 0,2 M a pH 7,5 | ||
| Tiosulfato | Panreac | 121879.1209 | Prepare una solución de 10% en agua |
| QIAamp Viral RNA Mini Kit | Qiagen | 52904 | |
| De 96 pocillos placa de reacción óptica (500 unidades) | Applied Biosystems | 43426659 | |
| Óptica cubre adhesivo (100 unidades) | Applied Biosystems | 4311971 | |
| TaqMan PCR Master Mix Ambiental 2x | Applied Biosystems | 4396838 |
Referencias
- Bofill-Mas, S., Clemente-Casares, P., Major, E. O., Curfman, B., Girones, R. Analysis of the excreted JC virus strains and their potential oral transmission. J. Neurovirol. 9 (4), 498-507 (2003).
- Bofill-Mas, S., Albinana-Gimenez, N., Clemente-Casares, P., Hundesa, A., Rodriguez-Manzano, J., Allard, A., Calvo, M., Girones, R. Quantification and stability of human adenoviruses and polyomavirus JCPyV in wastewater matrices. Appl. Environ. Microbiol. 72 (12), 7894-7896 (2006).
- Calgua, B., Mengewein, A., Grunert, A., Bofill-Mas, S., Clemente-Casares, P., Hundesa, A., Wyn-Jones, A. P., López-Pila, J. M., Girones, R. Development and application of a one-step low cost procedure to concentrate viruses from seawater samples. J. Virol. Methods. 153 (2), 79-83 (2008).
- Hernroth, B. E., Conden-Hansson, A. C., Rehnstam-Holm, A. S., Girones, R., Allard, A. K. Environmental factors influencing human viral pathogens and their potential indicator organisms in the blue mussel, Mytilus edulis: the first Scandinavian report. Appl. Environ. Microbiol. 68, 4523-4533 (2002).
- Hundesa, A., Bofill-Mas, S., de Motes, M. a. l. u. q. u. e. r., Rodriguez-Manzano, C., Bach, J., Casas, A., M, ., Girones, R. Development of a quantitative PCR assay for the quantitation of bovine polyomavirus as a microbial source-tracking tool. J. Virol. Methods. 163 (2), 385-389 (2010).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Albinana-Gimenez, C., Rodriguez-Manzano, N., Bofill-Mas, J., Suñen, S., E, ., Girones, R. Development of a qPCR assay for the quantification of porcine adenoviruses as an MST tool for swine fecal contamination in the environment. J. Virol. Methods. 158 (1-2), 130-135 (2009).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Bofill-Mas, C., Albinana-Gimenez, S., N, ., Girones, R. Identification of human and animal adenoviruses and polyomaviruses for determination of sources of fecal contamination in the environment. Appl. Environ. Microbiol. 72 (12), 7886-7893 (2006).
- Layton, B. A., Walters, S. P., Lam, L. H., Boehm, A. B. Enterococcus species distribution among human and animal hosts using multiplex PCR. J. Appl. Microbiol. 109, 539-547 (2010).
- de Motes, M. a. l. u. q. u. e. r., Clemente-Casares, C., Hundesa, P., Martín, M., Girones, R. Detection of bovine and porcine adenoviruses for tracing the source of fecal contamination. Appl. Environ. Microbiol. 70 (3), 1448-1454 (2004).
- Pal, A., Sirota, L., Maudru, T., Peden, K., Lewis, A. M. Real-time PCR assays for the detection of virus-specific DNA in simples with mixed populations of polyomaviruses. J. Virol. Methods. 135 (1), 32-42 (2006).
- Stapleton, C. M., Kay, D., Wyer, D. a. v. i. e. s., Watkins, C., Kay, J., McDonald, C., Porter, A. T., J, ., Gawler, A. Evaluating the operational utility of a Bacteroidales quantitative PCR-based MST approach in determining the source of faecal indicator organisms at a UK bathing water. Water Res. 43, 4888-4899 (2010).
- Wang, J., Horner, G. W., Keef, O., S, J. Detection and molecular characterization of bovine polyomavirus in bovine sera in New Zealand. N. Z. Vet. J. 53, 26-30 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados