Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Özgül İnsan ve Hayvan Virüsler Mikrobiyal Kaynak Takip için maliyet-etkin Yöntemi
Bu Makalede
Özet
Bu çalışma, MST araçları olarak önerilen insan / / sığır domuz DNA virüsleri, adenovirüs ve polyomaviruses, belirli bir miktar tayini için qPCR kullanarak suda nitrat dışkı / idrar kirlenme veya kontaminasyon kaynağının belirlenmesi için maliyet-etkin bir yöntem açıklanır.
Özet
Ortamında mikrobiyal kirlenme önemli bir sağlık riski temsil eder. Klasik bakteri dışkı göstergeler önemli sınırlamalar olduğu gösterilmiştir, virüs bulaşma kaynağı bilgi birçok inaktivasyon işlemleri ve standart fekal göstergeler daha dayanıklıdır. Virüslerin su ve moleküler testlerin konsantrasyon için maliyet-etkin yöntemlerin geliştirilmesi, fekal kontaminasyon göstergeleri ve mikrobiyal kaynağı olarak izleme (MST) araçları gibi virüslerin uygulanabilirliği kolaylaştırır. Adenovirüsler ve polyomaviruses DNA virüsleri insanlarda dahil olmak üzere belirli omurgalı türlerin bulaşmasını ve ısrarla dışkı ve / veya incelenen tüm coğrafi bölgelerde idrar ile atılır. Daha önceki çalışmalarda, biz insan adenovirüs (HAdV) ve insan fekal kontaminasyonun bir göstergesi olarak kantitatif PCR (qPCR) JC polyomaviruses (JCPyV) miktarının önerdi. Son zamanlarda, biz por özel ölçümü için qPCR testleri geliştirdikcine adenovirüs (PAdV) ve büyükbaş hayvan fekal kontaminasyon belirteç olarak test tüpü başına 1-10 genom kopya hassasiyetleri polyomaviruses (BPyV). Bu çalışmada, biz bu araçları kullanarak su örneklerinde kirlilik kaynağını belirlemek için izlenecek prosedür mevcut. Temsili sonuçlar örnek olarak, yüksek düzeyde nitrat sunan yeraltı suyu virüs analizi gösterilmektedir.
Düşük veya orta derecede kirli sularda virüslerin tespiti çok daha küçük bir hacim, genellikle iki seri konsantrasyon adımları içeren bir prosedür en azından birkaç litre su virüslerin konsantrasyonu gerektirir. Bu biraz hantal bir prosedür ve viral kurtarma gözlenen değişkenlik su örneklerinin çok sayıda eşzamanlı işlem önemli ölçüde engel teşkil etmektedir.
Önceki Studie geliştirilen bir adım protokolü uygulanan iki adım yordamlar kaynaklanan darboğaz ortadan kaldırmak içins ve su matrisler bir çeşitlilik için de geçerlidir. Asitlenme on litre su örneklerinin, yağsız süt ile flokülasyon, topaklanmalara malzemelerin ağırlık sedimantasyon, çökelti ve santrifüj toplama, 10 ml fosfat tamponu çökelti, tabanda: Bu prosedür içerir. Viral konsantre viral nükleik asitler ve özel adenovirüs ve ilgi polyomaviruses qPCR tarafından sayısal çıkarılması için kullanılır. Çok sayıda numune eş zamanlı olarak bu düşük maliyetli konsantrasyon yöntemi kullanılarak analiz edilebilir.
Bu prosedür, suları, deniz suyu ve nehir suyu analiz uygulanmış ve bu çalışmada, yeraltı suyu numuneleri analiz sonuçları sunmak olmuştur. Bu yüksek verim nicel yöntem, basit, güvenilir ve maliyet-etkin.
Protokol
1. Viral parçacıkların konsantrasyonu su örneklerinde mevcut
- Koleksiyon, klima ve su örnekleri
- En az 2 plastik kaplar içinde bir proses kontrolü gibi düz dipli ve bir ekstra numune örnek başına 10 L çoğaltır toplayın. Bu son örnek, bilinen bir viral parçacıkların miktarı ile çivili ve kontrol olarak kullanılan olacaktır.
Not: Bu çivili numuneler için özel ayrı bir malzeme (şişe, tüp, vb.) Olması tavsiye edilir. - Conductimeter kalibrasyon kontrol edin ve gerekirse yeniden kalibre. Bir ekstra 10 L plastik konteyner yeterli iletkenliği önceden ayarlanmış musluk suyu (1.6 aşağıya bakınız) kullanarak bir negatif kontrol hazırlayın.
- Çivili örnekleri için örnek kontrol virüsü standart hacmi (10 L su başına yaklaşık 10 5 genom kopya) ekleyin. Sıçrama ve aerosoller kaçınarak karıştırarak karıştırın. Pozitif kontroller adenovirüs s nadir bir zorlanma meydanaHAdV-35 veya MS2 gibi bir bakteriyofaj gibi uch.
- Örnek askıya malzeme (kum veya diğer malzeme) yüksek miktarda sunuyor için tortu, 15 dakika izin verin. Yeni bir kap içine su aktarın.
- 1 N HCl ilave edilerek su numunesi pH 3.5 (± 0.1) ayarlayın. Bu adım, virüs konsantrasyonu için çok önemlidir, bu nedenle pH düzgün ayarlanmış emin olun. HCl eklerken kuvvetli karıştırarak suyu iyice karıştırın. (Not: pH 3.5 eklemek 1 M NaOH daha düşük ise).
- Iletkenlik ayarlayın. Örnek, 1500 μS / cm veya daha yüksek bir iletkenlik varsa, bu adım gerekli değildir. Iletkenliği 1500 μS / cm topaklanmalara malzeme formasyonu (flocs) garanti edilmemektedir daha düşükse yapay deniz tuzu (Sigma) eklenmesiyle 1500 μS / cm iletkenlik ayarlayabilirsiniz. Deniz tuzu ekleyerek karıştırmaya kuvvetlice karıştırın.
- Bir de öncesi ve Klima sonra numunelerin pH kaydedinHCl hacmi kullanılır. Iletkenlik, pH ayarladıktan sonra kayıt altına alınmalıdır. Her zaman taze bir HCl çözeltisi ile pH metre ve conductimeter elektrotlar dezenfekte,% 10 sodyum tiosulphate çözüm dechlorinate ve sonunda saf su ile durulayın.
- En az 2 plastik kaplar içinde bir proses kontrolü gibi düz dipli ve bir ekstra numune örnek başına 10 L çoğaltır toplayın. Bu son örnek, bilinen bir viral parçacıkların miktarı ile çivili ve kontrol olarak kullanılan olacaktır.
- % 1 yağsız süt-topaklanmalara öncesi hazırlanması (PSM)
- PH metre ve conductimeter kalibrasyon kontrol edin ve gerekirse yeniden kalibre.
- 1 L yapay deniz suyu 10 gr yağsız süt tozu (Difco) eriterek ön topaklanmalara yağsız süt çözeltisi hazırlayın (% 1 PSM, w / v) (dechlorinated musluk suyu ve otoklav 1 L 33.3 g yapay deniz tuzu çözülür) ve dikkatle 1N HCl ile 3.5 pH ayarlanması. Flocs görünür olmalıdır. 24 saat boyunca 4 ya da mağaza olarak hemen önce çözüm ° C hazırlayın Deklorinasyonu için 1 ml, 100 ml su başına% 10 tiosulphate çözüm kullanın.
- Viral parçacıkların flokülasyon su örnekleri mevcut
- 10-L su numunesi için% 1 PSM 100 ml ekleyin.
- Virüsler flocs tutunmasını sağlamak için 8-10 saat süreyle örnekleri karıştırın. 8-10 saat sonra kapanma karıştırma için bir zamanlayıcı kullanın.
- Karıştırarak 8-10 saat süreyle durdurun ve yerçekimi ile flocs tortu izin
- Flocs toplanması ve yeniden-çözünür. Santrifüj
- Peristaltik bir pompa ve bir plastik tüpe bağlı plastik bir pipet kullanarak süpernatantı. Çivili örnekleri için süpernatant bir şişeye toplanır ve iç prosedürlerine göre dezenfekte. Tüm durumlarda DİKKATLİ pelet toplamak için değil.
- Tortu santrifüj şişeye flocs (yaklaşık 500 ml) ile toplayın.
- PSM pH 3,5 ilave edilerek tencere Dengesi.
- 4, 30 dakika boyunca 8000 xg yüksek hızda santrifüj tencere Santrifüj ° C En kısa sürede santrifüj durur, santrifüj santrifüj tencere dikkatlice çıkarın.
- Çok gkardiak defekt dökün ve süpernatantı atın. Bulaşıcı malzeme için uygun önlemleri izleyin.
- Her santrifüj şişe pelet çözmek için 7 ml fosfat tamponu ekleyin.
- Flocs çözünmüş sonra, ölçü ve toplam hacmi 10 ml ulaşmak için fosfat tamponu ekleyin.
- Vorteks viral konsantre homojenize ve -80 dondurulmuş olmalıdır temiz mikrotüpler içine 10 ml dağıtmak ° C daha fazla analize ihtiyaç duyulan kadar.
2. Nükleik asit ekstraksiyon
- Nükleik asit ekstraksiyon üretici talimatları izleyerek QIAamp viral RNA Mini Kit ile gerçekleştirin. Bu kit, otomatik bir platform kullanımı (örneğin Qiacube, Qiagen) sağlar.
3. Insan adenovirüs (HAdV), JC polyomaviruses (JCPyV), domuz adenovirüs (PAdV) ve sığır polyomaviruses Kantitatif PCR (BPyV)
- Örneklerinde genom kopya Kantitasyonu
- HazırlamakTaqMan Çevre PCR Master Mix 2x (Biyosistem Uygulamalı) kullanarak temiz bir ayrı alanda qPCR karıştırın. Reaksiyon optik yapışkanlı kapakları ile kaplı bir 96-iyi optik bir reaksiyon plaka yer alır. Master Mix konsantrasyonları, astar ve sondalar Tablo 1'de açıklanmıştır.
- Sonra karışımı kısım 15μl (3.2) kontrolleri de dahil olmak üzere her birine hazırlanan olmuştur. Hedef eklenmesinden sonra bir reaksiyon için toplam hacmi (15μl karışımı + 10μl örnek veya standart) 25μl olacak.
- Ayrı bir alanda örnekleri (10μl) nükleik asit ekstraksiyon ekleyin. Yinelenen her numune saf su doğrudan ve on kat seyreltme çalıştırın. Kapak yapışkan bir kapak parçası örnekleri içeren kuyu kapağının diğer kısmı, sonraki adım için tutun.
- 10 0 10 6 GC/10μl üç nüsha tarafından DNA standart süspansiyonlar (10μl) dilüsyonları ekleyin ve standartları için özel olarak kullanılan bir mikropipet kullanarakDard DNA. Plazmid DNA yok ve her kullanımdan sonra mikropipet temizlemek için UV radyasyonu ile donatılmış bir alanda standartları eklemek için tavsiye edilir. Kapak önceden kesilmiş yapışkan kapaklı standartlarını içeren kuyu.
Not: genom kopya miktarının belirlenmesinde kullanılmak üzere standart süspansiyonlar hazırlamak için, hedef DNA bölgesi plazmid ve lineerleştirilmiş klonlanmış olmalıdır. Aşağıdaki adrese standart eğrileri qPCR kullanılan plazmid DNA şablonları ile nasıl oluşturulacağı hakkında ayrıntılı bir prosedür bulacaksınız:
http://www.appliedbiosystems.com/support/tutorials/pdf/quant_pcr.pdf - Uygun parametreler (yapışkanlı kapak ve her iyi, vb toplam hacmi dikkate alınarak) seçmek yeterli bir sistem içine qPCR gerçekleştirin. AmpliTaq Gold aşağıdaki aktivasyon az 10 dakika süreyle 95 ° C, 40 amplifikasyon döngüsü şu şekilde yapılır: 95 ° C'de 15 sve HAdV, JCPyV ve BPyV ve 95 15 sn için 60 ° C'de 1 dakika ° C, 55 20s ° C ve 20s, 60 ° C PAdV için.
- Reaksiyonlar tamamlandığında, ekipman kullanım kılavuzu açıklandığı gibi mağaza verileri ve sonuçları kullanılır. DNA miktarı, seyreltme faktörü gerektiğinde düzelttikten sonra elde edilen veriler medyan olarak tanımlanabilir.
- Kontrolleri
- Pozitif ve negatif kontrolleri kullanın. Test karışımı floresan üretmek değil kanıtlamak için daha fazla olmayan bir şablon kontrolü (NTC) içermelidir. Incelenen örneklerde mevcut inhibitörleri nedeniyle potansiyel enzim inhibisyonu değerlendirmek için olumlu bir süreç kontrolü çalıştırmak için tavsiye edilir.
- Kayıt, standart DNA ve proses kontrolü iki farklı dilüsyonlarının qPCR testlerinin sonuçları. Tahlillerin hassasiyeti ve verimliliği ile ilgili kalite kontrol (QC) programları için kontrol şemaları hazırlamak için kullanın.
- Onayısonuçları
- Pozitif sonuçlar daha suşlarının nükleotid dizilimleri üzerinde ek veri üreten amplikonlarının iç içe-PCR ve nükleotid sıralama 1,5,6,7,9,12 tespit kullanarak teyit edilebilir.
Prosedürü tarif ardından, insan ve hayvan virüsleri tespit edilmiştir ve banyo suları, deniz suyu ve nehir suyu 2,3 niceliği. Temsili bir örnek olarak, yüksek düzeyde nitrat sunan alanlarda yeraltı suyu örneklerinde kirlilik kaynakları tanımlamak için değerlendirildi. İspanya'nın Kuzeydoğu bölgesi kırsal alanlarda 4 farklı kuyulardan On litre su örnekleri toplanmıştır. Beş süreç kontrolü olarak kullanılan insan adenovirüs ile 2 numaralı seribaşı her bir çoğaltmak toplanmıştır çoğaltır. Örnekler Şekil 1'de temsil edilen protokole göre işlendi. Dört (ortalama değeri 7.7 PAdV için olumlu sonuçlar gösterdi incelenen dört site bir analiz çoğaltırÖrnekleme alanını çevreleyen alanlarda domuz çamurlar varlığı ile ilgili olacak ve fekal porcine kirlenme kaynağı olarak yeraltı suyu nitrat (Tablo 2) destek vereceğini 4x10 2 GC / L).
4. Temsilcisi Sonuçlar:
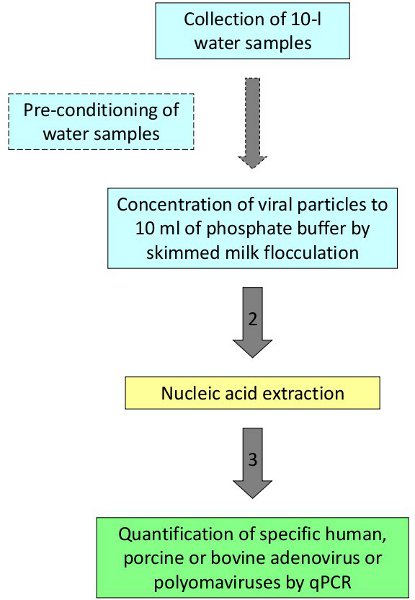
Şekil 1 su virüslerin tespiti ve ölçülmesi için Prosedür.
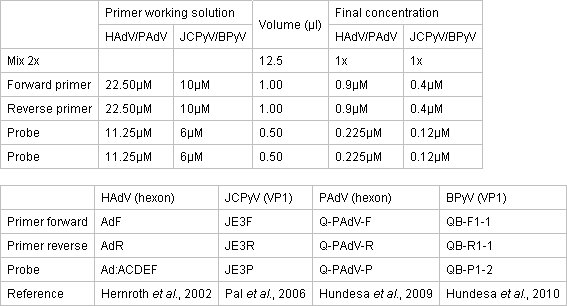
Tablo 1. Konsantrasyon qPCR deneyleri için astar ve probları.

Tablo 2. Tespit ve yeraltı suyu örneklerinde hayvan ve insan adenovirüs ve polyomaviruses ölçümü.
n sayısını çoğaltır analiz
Pozitif% yüzdesini çoğaltır.
(-) Olmayan tespit
Tartışmalar
Tekrarlanabilir, güvenilir, basit ve maliyet-etkin açıklanan prosedürü rutin çevre ve halk sağlığı laboratuvarları için uygun bir yöntem için gerekli koşulları yerine getirecektir. Protokol basittir; ancak dikkatli bir şekilde takip edilmelidir. Flokülasyon için karıştırma süresi önemli ölçüde azalır (örneğin en az 5 saat) durumunda olacağı gibi, yapay deniz suyu tuzlarının istenen konsantrasyon eklemeden örneklerinde düşük iletkenlik virüs kurtarma önemli ölçüde azaltaca...
Açıklamalar
İki patent başvuruları, PAdV ve BPyV ölçümü için protokollerin fikri mülkiyet haklarını korumak için 2009 yılında yayınlandı.
Teşekkürler
Bu çalışma, kısmen Avrupa Birliği Araştırma Çerçeve 7 finanse edilen projeler VIROBATHE (Sözleşme No: 513.648), VIROCLIME (Sözleşme No. 243.923 tarafından, İspanyol Hükümeti "Ministerio de educacion y Ciencia" (proje AGL2008-05275-C01/ALI) tarafından desteklenmiştir. ) ve Su Katalan Ajansı, Agencia Catalana de l'Aigua (ACA), Departament de Kontrolü i Millora dels Ecosistemes Aquatics. Gelişmiş çalışma sırasında Marta Rusiñol Katalan Hükümeti "AGAUR" (FI-DGR) bir adam oldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar |
| Yüksek hızlı santrifüj (8.000 xg) | Berckman Coulter | Avanti J-20XP | |
| pH metre, termometre ve conductimeter | Afora | LPPC3003 | |
| Plastik borular 100-200 cm uzunluğunda | Deltalab | 350059 | |
| Steril tek kullanımlık pipetler bitirdi | Labclinics | PN10E1 | |
| Steril plastik tüpler 1.5 ve 10-15 ml (Eppendorf, Şahinleri, vb.) | Afora | KA298/00 | |
| Santrifüj tencere (500 mL) | Fisher Scientific | SE5753512 | |
| Manyetik karıştırıcı ve mıknatıslar (başına birörneği) | Fisher Scientific | 10510 | |
| Cam veya plastik kaplar, manyetik karıştırıcı kullanılmasına izin vermek düz dipleri | Deltalab | 191642 | |
| Süpernatant (ya da bir su-jeti vakum pompası) kaldırmak için bir peristaltik pompa | Watson-Marlow | 323E / D | |
| Timer kapama 8-10 saat sonra karıştırma | Deltalab | 900400 | |
| Hidroklorik asit (1N ve 0.1N) | Panreac | 141020.1611 | |
| Sodyum hidroksit (1N) | Panreac | 131687.1211 | |
| Suni deniz suyu deniz tuzu | Sigma | S9883 | |
| Yağsız süt (SM) | Difco | 232100 | |
| Fosfat tampon pH 7, 5 | 01:02 v / v steril Na 2 HPO 4 0,2 M ve pH 7.5 NaH 2 PO 4 0,2 M | ||
| Tiyosülfat | Panreac | 121879.1209 | Su içinde% 10'luk bir çözüm olun. |
| QIAamp viral RNA Mini Kit | Qiagen | 52904 | |
| 96-optik tepki plaka (500 adet) | Applied Biosystems | 43426659 | |
| Optik yapışkanlı kapakları (100 adet) | Applied Biosystems | 4311971 | |
| TaqMan Çevre PCR Master Mix 2x | Applied Biosystems | 4396838 |
Referanslar
- Bofill-Mas, S., Clemente-Casares, P., Major, E. O., Curfman, B., Girones, R. Analysis of the excreted JC virus strains and their potential oral transmission. J. Neurovirol. 9 (4), 498-507 (2003).
- Bofill-Mas, S., Albinana-Gimenez, N., Clemente-Casares, P., Hundesa, A., Rodriguez-Manzano, J., Allard, A., Calvo, M., Girones, R. Quantification and stability of human adenoviruses and polyomavirus JCPyV in wastewater matrices. Appl. Environ. Microbiol. 72 (12), 7894-7896 (2006).
- Calgua, B., Mengewein, A., Grunert, A., Bofill-Mas, S., Clemente-Casares, P., Hundesa, A., Wyn-Jones, A. P., López-Pila, J. M., Girones, R. Development and application of a one-step low cost procedure to concentrate viruses from seawater samples. J. Virol. Methods. 153 (2), 79-83 (2008).
- Hernroth, B. E., Conden-Hansson, A. C., Rehnstam-Holm, A. S., Girones, R., Allard, A. K. Environmental factors influencing human viral pathogens and their potential indicator organisms in the blue mussel, Mytilus edulis: the first Scandinavian report. Appl. Environ. Microbiol. 68, 4523-4533 (2002).
- Hundesa, A., Bofill-Mas, S., de Motes, M. a. l. u. q. u. e. r., Rodriguez-Manzano, C., Bach, J., Casas, A., M, ., Girones, R. Development of a quantitative PCR assay for the quantitation of bovine polyomavirus as a microbial source-tracking tool. J. Virol. Methods. 163 (2), 385-389 (2010).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Albinana-Gimenez, C., Rodriguez-Manzano, N., Bofill-Mas, J., Suñen, S., E, ., Girones, R. Development of a qPCR assay for the quantification of porcine adenoviruses as an MST tool for swine fecal contamination in the environment. J. Virol. Methods. 158 (1-2), 130-135 (2009).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Bofill-Mas, C., Albinana-Gimenez, S., N, ., Girones, R. Identification of human and animal adenoviruses and polyomaviruses for determination of sources of fecal contamination in the environment. Appl. Environ. Microbiol. 72 (12), 7886-7893 (2006).
- Layton, B. A., Walters, S. P., Lam, L. H., Boehm, A. B. Enterococcus species distribution among human and animal hosts using multiplex PCR. J. Appl. Microbiol. 109, 539-547 (2010).
- de Motes, M. a. l. u. q. u. e. r., Clemente-Casares, C., Hundesa, P., Martín, M., Girones, R. Detection of bovine and porcine adenoviruses for tracing the source of fecal contamination. Appl. Environ. Microbiol. 70 (3), 1448-1454 (2004).
- Pal, A., Sirota, L., Maudru, T., Peden, K., Lewis, A. M. Real-time PCR assays for the detection of virus-specific DNA in simples with mixed populations of polyomaviruses. J. Virol. Methods. 135 (1), 32-42 (2006).
- Stapleton, C. M., Kay, D., Wyer, D. a. v. i. e. s., Watkins, C., Kay, J., McDonald, C., Porter, A. T., J, ., Gawler, A. Evaluating the operational utility of a Bacteroidales quantitative PCR-based MST approach in determining the source of faecal indicator organisms at a UK bathing water. Water Res. 43, 4888-4899 (2010).
- Wang, J., Horner, G. W., Keef, O., S, J. Detection and molecular characterization of bovine polyomavirus in bovine sera in New Zealand. N. Z. Vet. J. 53, 26-30 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır