Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Rentable méthode de suivi des sources microbiennes spécifiques utilisant des virus humains et animaux
Dans cet article
Résumé
L'étude décrit une méthode rentable pour l'identification de la source de contamination fécale / urinaire ou de la contamination par les nitrates dans l'eau en utilisant qPCR pour la quantification spécifique du virus de l'ADN humain / porcin / bovin, les adénovirus et les polyomavirus, a proposé que les outils MST.
Résumé
La contamination microbienne de l'environnement représente un risque significatif pour la santé. Classique bactérienne indicateurs fécaux ont montré pour avoir des limites importantes, les virus sont plus résistants aux procédés d'inactivation de nombreux standards et indicateurs fécaux n'informent pas sur la source de contamination. Le développement de méthodes rentables pour la concentration de virus dans l'eau et des dosages moléculaires facilite l'applicabilité de virus comme indicateurs de contamination fécale et en tant que sources de pollution microbienne de suivi (MST) des outils. Les adénovirus sont des virus et des polyomavirus ADN infectant les espèces de vertébrés spécifiques, y compris les humains et sont excrétés dans les selles persistante et / ou d'urine dans toutes les zones géographiques étudiées. Dans des études précédentes, nous avons suggéré la quantification des adénovirus humains (HAdV) et polyomavirus JC (JCPyV) par PCR quantitative (qPCR) comme un indice de contamination fécale humaine. Récemment, nous avons développé des tests qPCR pour la quantification spécifique du poradénovirus ciné (PADV) et polyomavirus bovin (BPYV) comme marqueurs fécaux des animaux de la contamination avec des sensibilités de 10 à 10 copies de génome par tube d'essai. Dans cette étude, nous présentons la procédure à suivre pour identifier la source de contamination dans les échantillons d'eau à l'aide de ces outils. Comme exemple de résultats représentatifs, l'analyse des virus dans les eaux souterraines présentant des niveaux élevés de nitrates est affiché.
Détection des virus à faible ou modérée des eaux polluées requiert de la concentration du virus dans au moins plusieurs litres d'eau dans un volume beaucoup plus petit, une procédure qui comporte généralement deux étapes de concentration en série. Cette procédure un peu lourde et la variabilité observée dans les recouvrements virale entravent de manière significative le traitement simultané d'un grand nombre d'échantillons d'eau.
Afin d'éliminer le goulot d'étranglement causés par les procédures en deux étapes, nous avons appliqué un protocole en une seule étape développé dans Studie précédentes et applicables à une diversité de matrices d'eau. La procédure comprend: l'acidification des échantillons d'eau de dix litres, floculation par du lait écrémé, de la sédimentation par gravité des matériaux floculées, la collecte du précipité et la centrifugation, resuspension du précipité dans un tampon phosphate 10 ml. Le concentré viral est utilisé pour l'extraction d'acides nucléiques viraux et les adénovirus et les polyomavirus spécifiques d'intérêt sont quantifiés par qPCR. Nombre élevé d'échantillons peuvent être analysés simultanément en utilisant cette méthode de concentration à faible coût.
La procédure a été appliquée à l'analyse des eaux de baignade, l'eau de mer et d'eau de la rivière et dans cette étude, nous présentons l'analyse des résultats des échantillons d'eau souterraine. Cette méthode quantitative à haut débit est fiable, simple et rentable.
Protocole
1. La concentration des particules virales présentes dans les échantillons d'eau
- Collecte et conditionnement des échantillons d'eau
- Recueillir un minimum de 2 répétitions de 10 L par échantillon dans des contenants en plastique à fond plat et un échantillon supplémentaire comme un contrôle de processus. Ce dernier échantillon sera dopé avec une quantité connue de particules virales et utilisé comme contrôle.
Note: Il est recommandé d'avoir du matériel spécial séparé (bouteilles, tubes, etc) pour les échantillons dopés. - Vérifiez l'étalonnage du conductimètre et recalibrer si nécessaire. Préparer un témoin négatif en utilisant l'eau du robinet préalablement ajusté à la conductivité adéquate (voir ci-dessous 1.6) dans un récipient en plastique 10 supplémentaires L.
- Pour des échantillons enrichis: Ajouter le volume standard du virus de la commande (environ 10 5 copies du génome par 10 L d'eau) à l'échantillon. Mélanger en remuant éclaboussures éviter et les aérosols. Les contrôles positifs pourrait consister en une souche rare de l'adénovirus sUCH que HAdV-35 ou un bactériophage, comme MS2.
- Si l'échantillon présente la quantité élevée de matières en suspension (sable ou autres matériaux), il laisse des sédiments pendant 15 minutes. Transfert de l'eau dans un nouveau récipient.
- Ajuster le pH de l'échantillon d'eau à 3,5 (± 0,1) par l'ajout de HCl 1 N. Cette étape est importante pour la concentration des virus, alors assurez-vous que le pH a été ajusté correctement. Mélangez soigneusement l'eau par une agitation vigoureuse, tout en ajoutant de l'HCl. (Remarque: Si le pH est inférieur à 3,5 ajouter du NaOH 1 M).
- Ajuster la conductivité. Si l'échantillon possède une conductivité de 1500 uS / cm ou plus, cette étape n'est pas nécessaire. Si la conductivité est inférieure à 1500 uS / cm la formation de matière floculée (flocs) n'est pas garanti pour ajuster la conductivité à 1500 uS / cm par l'ajout de sels de mer artificielle (Sigma). Mélanger vigoureusement par l'agitation tout en ajoutant le sel marin.
- Notez le pH des échantillons avant et après le conditionnement ainsi unes le volume de HCl utilisé. La conductivité devrait également être enregistré après ajustement du pH. Toujours désinfecter les électrodes pH-mètre et conductimètre avec une solution fraîche HCl, avec une solution de sodium déchlorer tiosulphate 10% et enfin rincer à l'eau distillée.
- Recueillir un minimum de 2 répétitions de 10 L par échantillon dans des contenants en plastique à fond plat et un échantillon supplémentaire comme un contrôle de processus. Ce dernier échantillon sera dopé avec une quantité connue de particules virales et utilisé comme contrôle.
- Préparation de la pré-floculées lait écrémé 1% (PSM)
- Vérifiez l'étalonnage du pH-mètre et le conductimètre et recalibrer si nécessaire.
- Préparer pré-floculées solution de lait écrémé (1% du PSM, p / v) en dissolvant 10 g de poudre de lait écrémé (Difco) dans une eau de mer artificielle L (dissoudre 33,3 g de sels de mer artificielle dans 1 L d'eau du robinet déchlorée et autoclave) et soin d'ajuster le pH à 3,5 avec HCl 1N. Les flocs doit être visible. Préparer la solution juste avant d'être utilisés ou conserver à 4 ° C pendant 24 h. Pour déchloration utiliser 1 ml de solution tiosulphate 10% par 100 ml d'eau.
- La floculation des particules virales présentes dans les échantillons d'eau
- Ajouter 100 ml de PSM 1% à l'échantillon d'eau de 10 L.
- Incorporer les échantillons pour les 8-10 h pour permettre à des virus à adsorber les flocs. Utilisez une minuterie pour arrêt de l'agitation après 8-10 h.
- Arrêtez l'agitation et laisser les sédiments des flocs par gravité pour les 8-10 h.
- Collecte et re-dissoudre les flocs. Centrifugation
- Eliminer le surnageant à l'aide d'une pompe péristaltique et une pipette en plastique relié à un tube en plastique. Pour des échantillons dopés le surnageant doit être recueilli dans une bouteille et désinfectés conformément aux procédures internes. Dans tous les cas prendre soin de ne pas recueillir le culot.
- Recueillir les sédiments avec les flocs (environ 500 ml) dans une bouteille centrifugeuse.
- Équilibre les pots par l'ajout de 3,5 pH PSM.
- Centrifuger les pots dans une centrifugeuse à grande vitesse à 8000 xg pendant 30 min à 4 ° C. Dès que la centrifugeuse s'arrête, retirez soigneusement les pots à centrifuger de la centrifugeuse.
- Très gently égoutter et jeter le surnageant. Suivez les mesures appropriées pour le matériel infectieux.
- Ajouter 7 ml de tampon phosphate de dissoudre le culot dans chaque bouteille centrifugeuse.
- Une fois les flocs ont été dissous, de mesurer et ajouter un tampon phosphate pour atteindre un volume total de 10 ml.
- Homogénéiser le concentré virale par vortex et de distribuer les 10 ml dans des microtubes propres qui doivent être congelés à -80 ° C jusqu'à ce que nécessaire dans l'analyse plus loin.
2. Extraction des acides nucléiques
- Effectuer une extraction des acides nucléiques avec le kit QIAamp Viral RNA Mini en suivant les instructions du fabricant. Ce kit permet l'utilisation d'une plate-forme automatisée (comme QIAcube, Qiagen).
3. PCR quantitative des adénovirus humains (HAdV), polyomavirus JC (JCPyV), adénovirus porcins (PADV) et polyomavirus bovin (BPYV)
- Quantification des copies du génome dans les échantillons
- Préparerle mix de qPCR dans un endroit propre séparé en utilisant l'environnement TaqMan PCR Master Mix 2x (Applied Biosystems). La réaction a lieu dans une plaque de réaction de 96 puits recouverts de couvertures optiques colle optique. Les concentrations de l'Mix Master, les amorces et les sondes sont décrites dans le Tableau 1.
- Une fois le mélange a été préparé, 15μl aliquotes dans chaque puits, y compris les contrôles (voir 3.2). Le volume total pour une réaction après addition de 25 pi cible sera (mélange 15μl d'échantillon + 10 ul ou standard).
- Ajouter les extractions d'acides nucléiques à partir des échantillons (10 pi) dans une zone séparée. Exécuter direct et une dilution au dixième dans l'eau purifiée de chaque échantillon en double. Couvrir les puits contenant les échantillons avec une partie d'un couvercle adhésif, gardez l'autre partie de la couverture pour l'étape suivante.
- Ajouter des dilutions de la suspension standard de l'ADN (10 ul) de 10 0 à 10 6 GC/10μl par trois exemplaires, et en utilisant une micropipette utilisée exclusivement pour le stanl'ADN standard. Il est conseillé d'ajouter des normes dans un secteur équipé de rayons UV pour détruire l'ADN plasmidique et de nettoyer la micropipette après chaque utilisation. Couvrir les puits contenant les normes avec le couvercle adhésif pré-coupés.
Remarque: Pour préparer des suspensions standard pour être utilisée dans la quantification de copies du génome, la région d'ADN cible doit être cloné dans un plasmide et linéarisé. Dans l'adresse suivante, vous trouverez une procédure détaillée sur la façon de créer des courbes standard avec les modèles d'ADN plasmidique à être utilisés dans qPCR:
http://www.appliedbiosystems.com/support/tutorials/pdf/quant_pcr.pdf - Effectuez la qPCR dans un système adéquat sélectionnant les paramètres appropriés (en considérant l'utilisation de la couverture adhésif et le volume total dans chaque puits, etc.) Après activation de l'AmpliTaq Gold pendant 10 min à 95 ° C, 40 cycles d'amplification sont effectués comme suit: 15 s à 95 ° Cet 1 min à 60 ° C pour HAdV, JCPyV et BPYV, et 15 s à 95 ° C, 20s à 55 ° C et 20s à 60 ° C pour PADV.
- Une fois les réactions terminées, stocker des données et des résultats tels que décrits dans le manuel de l'utilisateur de l'équipement utilisé. La quantité d'ADN va être définie comme la médiane des données obtenues après la correction du facteur de dilution si nécessaire.
- Contrôles
- Utiliser des contrôles positifs et négatifs. Le dosage doit inclure plus d'un non-modèle de contrôle (NTC) pour prouver mélange ne produit pas de fluorescence. Il est conseillé d'exécuter le contrôle des processus positifs en vue d'évaluer le potentiel d'inhibition enzymatique due aux inhibiteurs présents dans les échantillons étudiés.
- Consigner les résultats des analyses qPCR de deux différentes dilutions de l'ADN standard et du contrôle de processus. Utiliser les résultats pour préparer les cartes de contrôle pour le contrôle qualité (CQ) des programmes liés à la sensibilité et l'efficacité des tests.
- Confirmation desles résultats
- Des résultats positifs peuvent être encore confirmés par séquençage PCR nichée et nucléotidiques des amplicons, la production de données supplémentaires sur les séquences nucléotidiques des souches détectées 1,5,6,7,9,12.
Suite à la procédure décrite, les virus humains et animaux ont été détectés et quantifiés dans les eaux de baignade, l'eau de mer et des eaux fluviales 2,3. Comme un exemple représentatif, des échantillons d'eau souterraine des zones présentant des niveaux élevés de nitrates ont été évalués pour définir les sources de la contamination. Échantillons d'eau de dix litres ont été collectés à partir de 4 différents puits dans les zones rurales d'une région du nord de l'Espagne. Cinq répétitions ont été collectées dans chaque puits étant une répétition ensemencé avec deux adénovirus humain utilisé comme contrôle de processus. Les échantillons ont été traités selon le protocole représenté dans la figure 1. Les quatre répétitions analysé dans l'un des quatre sites étudiés ont montré des résultats positifs pour PADV (valeur moyenne 7,74x10 2 GC / L) qui serait lié à la présence de boues de porc dans les zones entourant le site d'échantillonnage et appuierait la contamination fécale porcine comme la source de nitrates dans les eaux souterraines (tableau 2).
4. Les résultats représentatifs:
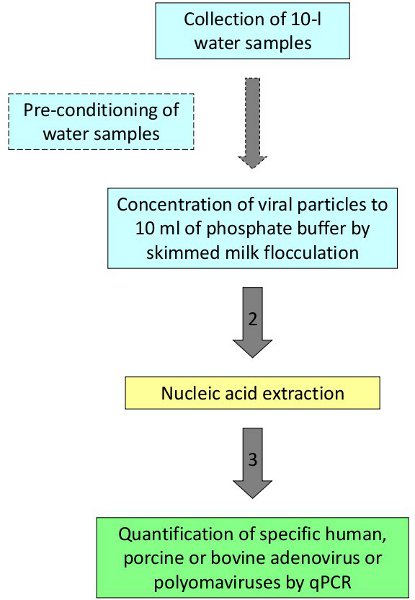
Figure 1. Procédure pour la détection et la quantification des virus dans l'eau.
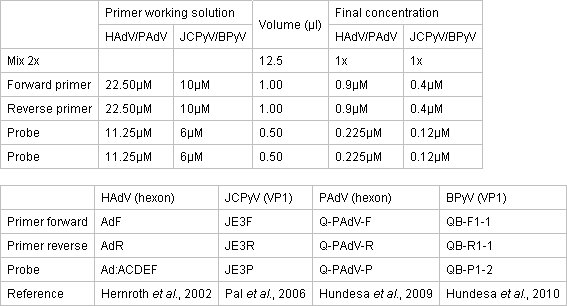
Tableau 1. Concentration des amorces et des sondes pour les tests qPCR.

Tableau 2. Détection et quantification des adénovirus humains et animaux et les polyomavirus dans les échantillons d'eau souterraine.
n nombre de répétitions analysées
Pourcentage% de positifs se réplique
(-) Non détecté
Discussion
La procédure décrite remplirait les conditions pour une méthode d'ajustement de routine des laboratoires de santé publique et d'environnement: reproductible, fiable, simple et rentable. Le protocole est simple, mais elle doit être suivie attentivement. Faible conductivité dans les échantillons sans ajout de la concentration de sels demandé l'eau de mer artificielle réduirait considérablement la récupération des virus comme ce serait le cas si le temps d'agitation pour la floculation est...
Déclarations de divulgation
Deux demandes de brevet ont été déposées en 2009 pour protéger la propriété intellectuelle de protocoles de quantification des PADV et BPYV.
Remerciements
Ce travail a été partiellement financé par le gouvernement espagnol "Ministerio de Educación y Ciencia" (projet AGL2008-05275-C01/ALI), par la Commission européenne cadre sur l'union de recherche 7 projets financés VIROBATHE (contrat n ° 513648), VIROCLIME (contrat n ° 243923 ) et par l'Agence Catalane de l'Eau, Agencia Catalana de l'Aigua (ACA), Departament de contrôle i dels Millora Ecosistemes Aquatics. Au cours de l'étude ont développé Marta Rusiñol était un membre de la Generalitat "AGAUR" (FI-DGR).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| Centrifugeuse à vitesse élevée (8000 xg) | Berckman Coulter | Avanti J-20XP | |
| pH-mètre, thermomètre et conductimètre | Afora | LPPC3003 | |
| Plastique Longueur des tubes cm 100-200 | Deltalab | 350059 | |
| Stérile pipettes graduées jetables | Labclinics | PN10E1 | |
| Stérile tubes en plastique de 1,5 et 10-15 ml (Eppendorf, faucons, etc) | Afora | KA298/00 | |
| Des pots à centrifuger (500 ml) | Fisher Scientific | SE5753512 | |
| Agitateurs magnétiques et aimants (un parl'échantillon) | Fisher Scientific | 10510 | |
| Les récipients en verre ou en plastique ayant un fond plat pour permettre l'utilisation d'agitateurs magnétiques | Deltalab | 191642 | |
| Une pompe péristaltique pour enlever le surnageant (ou une pompe à vide au jet d'eau) | Watson-Marlow | 323E / D | |
| Timer pour arrêt de l'agitation après 8-10 heures | Deltalab | 900400 | |
| L'acide chlorhydrique (1N et 0,1) | Panreac | 141020.1611 | |
| L'hydroxyde de sodium (1N) | Panreac | 131687.1211 | |
| Artificial sels de mer eau de mer | Sigma | S9883 | |
| Lait écrémé (SM) | Difco | 232100 | |
| Tampon phosphate pH 7, 5 | 01:02 v / v de stériles Na 2 HPO 4 0,2 M et NaH 2 PO 4 0,2 M à pH 7,5 | ||
| Thiosulfate | Panreac | 121879.1209 | Faire une solution à 10% dans l'eau |
| QIAamp Viral RNA Mini Kit | Qiagen | 52904 | |
| Plaque de 96 puits de réaction optique (500 unités) | Applied Biosystems | 43426659 | |
| Optique couvre adhésives (100 unités) | Applied Biosystems | 4311971 | |
| TaqMan environnement PCR Master Mix 2x | Applied Biosystems | 4396838 |
Références
- Bofill-Mas, S., Clemente-Casares, P., Major, E. O., Curfman, B., Girones, R. Analysis of the excreted JC virus strains and their potential oral transmission. J. Neurovirol. 9 (4), 498-507 (2003).
- Bofill-Mas, S., Albinana-Gimenez, N., Clemente-Casares, P., Hundesa, A., Rodriguez-Manzano, J., Allard, A., Calvo, M., Girones, R. Quantification and stability of human adenoviruses and polyomavirus JCPyV in wastewater matrices. Appl. Environ. Microbiol. 72 (12), 7894-7896 (2006).
- Calgua, B., Mengewein, A., Grunert, A., Bofill-Mas, S., Clemente-Casares, P., Hundesa, A., Wyn-Jones, A. P., López-Pila, J. M., Girones, R. Development and application of a one-step low cost procedure to concentrate viruses from seawater samples. J. Virol. Methods. 153 (2), 79-83 (2008).
- Hernroth, B. E., Conden-Hansson, A. C., Rehnstam-Holm, A. S., Girones, R., Allard, A. K. Environmental factors influencing human viral pathogens and their potential indicator organisms in the blue mussel, Mytilus edulis: the first Scandinavian report. Appl. Environ. Microbiol. 68, 4523-4533 (2002).
- Hundesa, A., Bofill-Mas, S., de Motes, M. a. l. u. q. u. e. r., Rodriguez-Manzano, C., Bach, J., Casas, A., M, ., Girones, R. Development of a quantitative PCR assay for the quantitation of bovine polyomavirus as a microbial source-tracking tool. J. Virol. Methods. 163 (2), 385-389 (2010).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Albinana-Gimenez, C., Rodriguez-Manzano, N., Bofill-Mas, J., Suñen, S., E, ., Girones, R. Development of a qPCR assay for the quantification of porcine adenoviruses as an MST tool for swine fecal contamination in the environment. J. Virol. Methods. 158 (1-2), 130-135 (2009).
- Hundesa, A., de Motes, M. a. l. u. q. u. e. r., Bofill-Mas, C., Albinana-Gimenez, S., N, ., Girones, R. Identification of human and animal adenoviruses and polyomaviruses for determination of sources of fecal contamination in the environment. Appl. Environ. Microbiol. 72 (12), 7886-7893 (2006).
- Layton, B. A., Walters, S. P., Lam, L. H., Boehm, A. B. Enterococcus species distribution among human and animal hosts using multiplex PCR. J. Appl. Microbiol. 109, 539-547 (2010).
- de Motes, M. a. l. u. q. u. e. r., Clemente-Casares, C., Hundesa, P., Martín, M., Girones, R. Detection of bovine and porcine adenoviruses for tracing the source of fecal contamination. Appl. Environ. Microbiol. 70 (3), 1448-1454 (2004).
- Pal, A., Sirota, L., Maudru, T., Peden, K., Lewis, A. M. Real-time PCR assays for the detection of virus-specific DNA in simples with mixed populations of polyomaviruses. J. Virol. Methods. 135 (1), 32-42 (2006).
- Stapleton, C. M., Kay, D., Wyer, D. a. v. i. e. s., Watkins, C., Kay, J., McDonald, C., Porter, A. T., J, ., Gawler, A. Evaluating the operational utility of a Bacteroidales quantitative PCR-based MST approach in determining the source of faecal indicator organisms at a UK bathing water. Water Res. 43, 4888-4899 (2010).
- Wang, J., Horner, G. W., Keef, O., S, J. Detection and molecular characterization of bovine polyomavirus in bovine sera in New Zealand. N. Z. Vet. J. 53, 26-30 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon