Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Introducción a la técnica de ultrasonido enfocado destrucción de microburbujas
En este artículo
Resumen
Ultrasonido dirigido destrucción de microburbujas (UTMD) se puede utilizar para dirigir el sitio de entrega específicos de moléculas bioactivas, incluyendo genes terapéuticos, para dirigirse a los órganos accesibles a la ecografía, como el corazón y el hígado 1-6.
Resumen
En las moléculas UTMD, bioactivos, tales como carga negativa vectores de ADN plásmido que codifica un gen de interés, se añaden a las capas de lípidos catiónicos de agentes de contraste de microburbujas 7-9. En ratones estas microburbujas llevar por vectores se puede administrar por vía intravenosa o directamente en el ventrículo izquierdo del corazón. En animales de mayor tamaño también pueden ser inyectados a través de un catéter intracoronario. La posterior entrega de la circulación a un órgano blanco se produce por la cavitación acústica a una frecuencia de resonancia de las microburbujas. Parece probable que la energía mecánica generada por los resultados de la destrucción de microburbujas en la formación de poros transitorios en o entre las células endoteliales de la microvasculatura de la región en estudio 10. Como resultado de este efecto sonoporación, la eficiencia de transfección en ya través de las células endoteliales se ha mejorado, y la codificación de los transgenes-vectores se depositan en el tejido circundante. ADN plásmido en el torrente circulatorio se degrada rápidamente por nucleasas en la sangre, lo que reduce aún más la probabilidad de parto para que no se sonicaron tejidos y da lugar a muy específica de órgano blanco de la transfección.
Protocolo
1. Microburbujas preparación de la pasta
- En 10 ml de PBS mezclar 200 mg 1,2-dipalmitoil-sn-glicero-3-fosfatidilcolina y 50 mg de 1,2-dipalmitoil-sn-glicero-3-fosfatidiletanolamina con g de glucosa 1.
- Calentar la mezcla en baño de agua hirviendo 20-30 minutos, una pipeta de mezcla cada 5 minutos.
- La solución se puede almacenar a 4 ° C durante un máximo de 6 meses.
2. Preparación de microburbujas
- Tome un 250 l de la solución preparada de microburbujas y se incuba a 40 ° C durante 15 minutos.
- La solución de microburbujas pre-calentado se transfiere entonces a un microtubo de 1,5 ml que contiene 50 l de glicerol.
- 2.1 mg de ADN purificado de plásmido que codifica para una construcción de expresión de los genes de interés (en este ejemplo purificada por Qiagen endotoxinas MegaPrep kit, Qiagen, Germantown, MD, con una concentración óptima de 4mg/ml). 2.4) tampón fosfato salino se añade a un volumen final de 500 microlitros. Endotoxinas maxipreps Qiagen se utilizan, así como de PBS estéril con el fin de garantizar la esterilidad.
- El aire en el microtubo luego se reemplaza con gas octafluoropropano.
- El microtubo A continuación se agita vigorosamente en un amalgamador dental durante 20 segundos.
- El subnatant de ADN que contienen residuales y de amortiguación que no se haya unido a las microburbujas es cuidadosamente removida y la capa de microburbujas se lavaron tres veces con PBS estéril para extraer el ADN no las tienen, y se coloca en hielo entre cada ciclo de lavado. Por lo general alcanzar una eficacia vinculante de 30-40%. Todos los reactivos son estériles y la atención se hace para minimizar la contaminación.
- El plásmido ADN-vinculados microburbujas se colocan en hielo durante hasta dos horas hasta su uso.
- El subnatant retirado del microtubo tras la mezcla y la PBS se lava, se puede utilizar para determinar la concentración de ADN no consolidadas, y también la cantidad límite basado en la concentración inicial conocida, mediante la medición de la densidad óptica de esta solución en una longitud de onda de 260 nm utilizando un espectrofotómetro.
3. Equipo de calibración
- Antes del primer uso, un transductor de 1 MHz cavitación debe ser calibrado para asegurar índice mecánico y de repetición del pulso. Un sumergible de 1 MHz, transductor de 13mm, fuera de foco está conectado a una función de 20 MHz / generador de forma de onda arbitraria a través de un amplificador de potencia.
- El transductor se coloca en un recipiente de plástico lleno de agua, dirigida directamente a un hidrófono, que ha sido conectado a un osciloscopio de 500 MHz a través de un amplificador de carga.
- Forma de onda, frecuencia, amplitud, ciclo de explosión, y amplificación de potencia pueden ser modificadas para obtener el ciclo de trabajo adecuado y el índice de mecánica óptima a cavitar las microburbujas. Para este experimento, se ha calibrado el sistema a un índice mecánico equivalente a aproximadamente, de 1,3 a 1 MHz.
4. Entrega de microburbujas y UTMD
- Antes de la entrega de microburbujas y UTMD, los ratones C57BL / 6 fueron anestesiados con ketamina y xilazina 100mg/kg 5mg/kg a través de una inyección IP.
- La entrega de microburbujas se administra por vía intravenosa a través de una inyección directa en el ventrículo izquierdo del corazón a través de cateterismo o vena de la cola. Para la inyección cardíaca directa, un volumen de hasta 100 l de ADN del plásmido cargado solución de microburbujas se inyecta a través de una aguja de calibre 30 insertada en el espacio intercostal 4 ª anterior bajo visualización ultrasónica en el ventrículo izquierdo del corazón.
- El bolo de solución de microburbujas resultantes de la inyección interventricular izquierda se visualiza usando Visual Sonics 38 MHz de alta frecuencia de un transductor de ultrasonido colocado en una posición fija en el tórax del ratón en una vista de eje largo con VisualSonics 'Vevo 2100 Sistema de Imagen. Todas las jeringas y las agujas son estériles, asegurar el ambiente más estéril posible que estas inyecciones.
- Inmediatamente después de la inyección, la destrucción de microburbujas se lleva a cabo de ~ 5 minutos con un segundo, de menor tamaño de baja frecuencia 1.0 MHz transductor sostiene directamente sobre el órgano deseado, apuntando a la destrucción de esta región. En este ejemplo, el ultrasonido se administró en el hígado con una frecuencia de repetición de pulso de 1,0 MHz, con un índice mecánico equivalente a aproximadamente 1.3 a 1.5, y el período de repetición del pulso de 100 ms por cada 20 ciclos. Por otra parte, el pulso puede ser cerrada en el ECG del ratón (no se muestra en este experimento) con una ráfaga de 3 fotogramas de la ecografía, cada 4-6 ciclos cardíacos. Se obtiene una mayor eficiencia de la transfección con los protocolos que permiten que el lecho capilar para volver a llenar de burbujas entre los estallidos de los ultrasonidos.
5. Envío Método alternativo
Hemos elegido para poner de relieve la inyección interventricular debido a la complejidad del procedimiento, pero en muchos casos, como la infusión prolongada de microburbujas, una vena de la cola eninyección es el método preferido. Para el método de la cola de la vena de la entrega de microburbujas, el ratón se anestesia la misma manera. Una jeringa que contiene el plásmido ADN-vinculados microburbujas está conectado a un catéter de la vena la aguja de calibre 27 / cola. El catéter de vena de la cola se inserta en el tercio distal de cualquiera de las venas lateral derecha o la izquierda que a lo largo de la cola del ratón. La jeringa que contiene las microburbujas se coloca en una bomba de infusión que administra automáticamente un volumen uniforme preestablecido de solución en un periodo de tiempo preestablecido. Por lo general infundir 200-300μl a una tasa de 3ml/hour.
El uso de animales
Todos los animales fueron manejados de acuerdo con la práctica correcta de los animales según lo definido por las autoridades nacionales y / o los organismos locales de protección de los animales, y todos los animales de trabajo fue aprobado por la comisión competente (Universidad de Hawaii Cuidado de Animales institucional y el empleo, el número de autorización 07-100 -3). Anestesia adecuada (ketamina / zylazine) fue utilizado y los analgésicos (bupivicaína y buprenorfina) estaban disponibles, aunque no es necesario.
6. Los resultados representativos:
La efectividad de la entrega de ADN mediada por plásmidos UTMD se puede evaluar a través de una variedad de métodos, dependiendo de los genes codificados en la construcción, tales como, pero no limitado a, la luciferasa de imágenes in vivo, B-gal tinción ex vivo, y / o inmunohistología. En particular, en imágenes de bioluminiscencia in vivo permite monitorear la presencia y duración de la expresión génica en ratones serie transfectadas con un plásmido que codifica un gen bioluminiscente (luciferasa). El Xenogen En Vivo Imaging System (IVIS) (Caliper Life Sciences, Hopkinton, MA) se utiliza para obtener imágenes de bioluminiscencia. Las imágenes se suelen considerar el conjunto de los ratones del primer día después de la transfección mediada UTMD y se repite cada tres o cuatro días hasta que la expresión del gen bioluminiscente ya no es perceptible a simple vista a través del sistema (Figura 1). Para preparar los ratones para obtener imágenes de bioluminiscencia, los primeros ratones una inyección IP de la luciferasa de la sonda D-luciferina (Caliper Life Sciences) y luego son anestesiados o 3 minutos más tarde. Biodistribución del sustrato D-luciferina se dejó transcurrir durante unos 10 minutos antes de que el animal se coloca en la cámara de IVIS de imágenes y un escáner de cuerpo completo la imagen tomada. Durante la adquisición, los fotones emitidos por la luciferasa de luciérnaga / D-luciferina reacción fotoquímica se miden. La Figura 1 también ilustra similares imágenes IVIS bioluminiscente del hígado después de UTMD, y la Figura 2 es una de epifluorescencia (100X) la imagen del hígado transfectadas utilizando un anticuerpo primario anti-luciferasa (Sigma-Aldrich) y AlexFluor-568 anticuerpo secundario conjugado (Invitrogen) . Es claro ver que la transfección mediada por el hígado UTMD ha afectado no sólo a las células endoteliales, pero el hepatocyes así como.
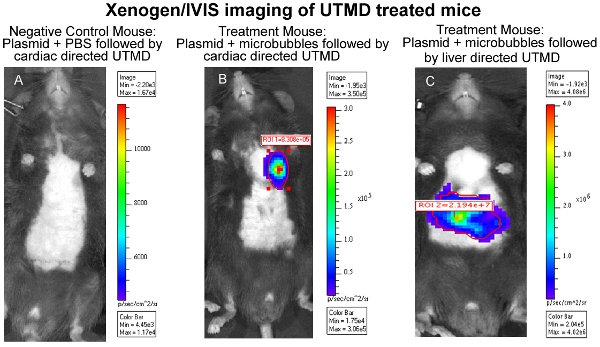
Figura 1 Xenogen / IVIS imagen cardiaca de los ratones tratados UTMD (A) del ratón control negativo:.. + Plásmido PBS seguido cardiaca dirigido UTMD, (B) Tratamiento del ratón: + plásmido microburbujas seguido cardiaca dirigido UTMD, y (C) El tratamiento del ratón : microburbujas plásmido + seguido por el hígado dirigido UTMD.
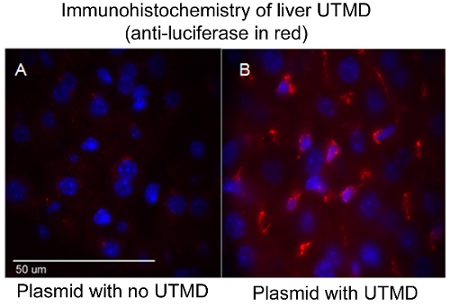
Figura 2. Inmunohistoquímica de hígado UTMD (anti-luciferasa en rojo). (A) plásmido sin UTMD, y (B) con el plásmido UTMD. Imagen confocal (100X), los núcleos son de color azul manchado DAPI.
Discusión
UTMD representa un nuevo enfoque para la entrega de genes. Como una plataforma tecnológica que se puede combinar con cualquiera de las muchas posibles estrategias de terapia génica, para ofrecer una gran variedad de moléculas bioactivas en un alto grado de especificidad de tejido que se desea. La principal limitación biológica de la técnica es la baja eficiencia de transfección. Otra consideración importante es la accesibilidad de los órganos diana de la ecografía, que puede ser notablemente disminuido por int...
Divulgaciones
Agradecimientos
Otorguen ayuda ha incluido NHLBI HL080532, NHLBI HL073449, CNRR RR16453, y una subvención nacional de la AHA en la concesión de ayuda (a RVS). Un especial agradecimiento se extiende al diseño de cursos a distancia y Consultoría (DCDC) del grupo, dcdcgroup.org, por su ayuda en la producción de video y el Departamento de Educación de EE.UU. Donación No. P336C050047 que fundó la DCDC.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / equipo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| 1,2-dipalmitoil-sn-glicero-3-fosfatidilcolina | Sigma-Aldrich | P-5911 | componente de la cáscara de lípidos de microburbujas |
| 1,2-dipalmitoil-sn-glicero-3-fosfatidiletanolamina | Sigma-Aldrich | P-3275 | componente de la cáscara de lípidos de microburbujas |
| glucosa | Sigma-Aldrich | G5400 | cree que estabiliza las microburbujas |
| tampón fosfato salino | Sigma-Aldrich | P5368 | |
| glicerol | Sigma-Aldrich | G5516 | cree que para evitar que las microburbujas de coalescencia |
| Octafluoropropano gas | Airgas | N / A | gas inerte utilizado en aplicaciones clínicas |
| VialMix amalgamador dental | Bristol-Myers Squibb | N / A | |
| 1 MHz, transductor de 13mm, fuera de foco | Olimpo | A303S-SU | |
| 20 MHz Función / Generador de forma de onda arbitraria | Agilent | 33220A | |
| Amplificador de Potencia | Krohn-Hite Co. | Modelo 7500 | |
| Hidrófono | Bruel y Kjaer | Tipo 1803 | |
| Amplificador de carga | Bruel y Kjaer | Tipo 2634 | |
| 500 MHz Osciloscopio | LeCroy | 9354L | |
| VisualSonics 'Vevo 2100 del sistema de imágenes con el transductor de 34 MHz | VisualSonics | 2100 | |
| 27G de una pulgada de catéteres vena de la cola | VisualSonics | N / A | |
| Genie Además bomba de infusión | Kent Científico | GENIE |
Referencias
- Bekeredjian, R., Chen, S., Frenkel, P. A., Grayburn, P. A., Shohet, R. V. Ultrasound-targeted microbubble destruction can repeatedly direct highly specific plasmid expression to the heart. Circulation. 108, 1022-1026 (2003).
- Bekeredjian, R., Katus, H. A., Kuecherer, H. F. Therapeutic use of ultrasound targeted microbubble destruction: a review of non-cardiac applications. Ultraschall Med. 27, 134-140 (2006).
- Chen, S. Regeneration of pancreatic islets in vivo by ultrasound-targeted gene therapy. Gene Ther. 17, 1411-1420 (2010).
- Miao, C. H. Ultrasound enhances gene delivery of human factor IX plasmid. Hum Gene Ther. 16, 893-905 (2005).
- Shimoda, M., Chen, S., Noguchi, H., Matsumoto, S., Grayburn, P. A. In vivo non-viral gene delivery of human vascular endothelial growth factor improves revascularisation and restoration of euglycaemia after human islet transplantation into mouse liver. Diabetologia. 53, 1669-1679 (2010).
- Shohet, R. V. Echocardiographic destruction of albumin microbubbles directs gene delivery to the myocardium. Circulation. 101, 2554-2556 (2000).
- Sirsi, S., Borden, M. Microbubble Compositions, Properties and Biomedical Applications. Bubble Sci Eng Technol. 1, 3-17 (2009).
- Li, H. L. Ultrasound-targeted microbubble destruction enhances AAV-mediated gene transfection in human RPE cells in vitro and rat retina in vivo. Gene Ther. 16, 1146-1153 (2009).
- Lindner, J. R. Microbubbles in medical imaging: current applications and future directions. Nat Rev Drug Discov. 3, 527-532 (2004).
- Newman, C. M., Bettinger, T. Gene therapy progress and prospects: ultrasound for gene transfer. Gene Ther. 14, 465-475 (2007).
- Vancraeynest, D. Myocardial injury induced by ultrasound-targeted microbubble destruction: evidence for the contribution of myocardial ischemia. Ultrasound Med Biol. 35, 672-679 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados