Method Article
Orientación neuronas del bulbo olfativo uso combinado En Vivo La electroporación y Gal4 basado reforzador líneas trampa de pez cebra
En este artículo
Resumen
La resolución temporal y espacial de las manipulaciones genéticas determina el espectro de los fenómenos biológicos que puedan perturbar. Aquí usamos temporal y espacialmente discretos In vivo, en combinación con las líneas transgénicas de pez cebra, para inducir la expresión de un transgén GFP específicamente en las neuronas del bulbo olfativo desarrollo.
Resumen
En la electroporación in vivo es un poderoso método para la entrega de los plásmidos de expresión de ADN, reactivos RNAi, y los oligonucleótidos antisentido morfolino a regiones específicas de los embriones en desarrollo, incluidos los de C. elegans, pollo, Xenopus, pez cebra y el ratón 1. En el pez cebra, en la electroporación in vivo se ha demostrado que tiene una excelente resolución espacial y temporal de la prestación de estos reactivos 2-7. La resolución temporal de este método es importante porque permite la incorporación de estos reactivos en determinadas fases de desarrollo. Por otra parte, porque la expresión de vectores electroporated se produce dentro de 6 horas 7, este método es más oportuna que los enfoques transgénicos. Aunque la resolución espacial puede ser muy precisa cuando la orientación de una sola célula 2, 6, a menudo es preferible incorporar los reactivos en una población de células específicas dentro de un tejido o estructura. Al dirigirse a las células múltiples, en la electroporación in vivo es eficiente para la entrega a una región específica del embrión, sin embargo, especialmente en el sistema nervioso en desarrollo, es difícil dirigirse a tipos específicos de células únicamente a través de electroporación espacialmente discretas. Por otra parte, potenciador trampa de las líneas transgénicas ofrecen una excelente celular tipo específico de expresión de transgenes 8. A continuación se describe un enfoque que combina transgénicos Gal4 basado en líneas de trampa potenciador 8 con espacialmente discretos en vivo electroporación 7, 9 para dirigirse específicamente a las neuronas en desarrollo del bulbo olfatorio de pez cebra. El Et (zic4: Gal4TA4, UAS: mCherry) hzm5 (antes GA80_9) potenciador trampa línea 8 se ha descrito anteriormente, muestra la expresión transgénica de mediación dirigido por un pez cebra mCherry optimizado Gal4 (KalTA4) activador de la transcripción en múltiples regiones del cerebro en desarrollo, incluyendo parte posterior del cerebro, cerebelo, cerebro anterior y el bulbo olfatorio. Para hacer referencia a la expresión de GFP específicamente al bulbo olfativo, un plásmido con la secuencia de codificación de la GFP bajo el control de múltiples sitios de unión Gal4 (UAS) se electroporated en la parte anterior del cerebro anterior en 24-28 horas posteriores a la fecundación (HPF). Aunque este método incorpora el plásmido de ADN en múltiples regiones del cerebro anterior, la expresión de GFP es sólo inducida en las células transgénicamente expresar el factor de transcripción KalTA4. Por lo tanto, utilizando la línea de GA080_9 transgénicos, este enfoque condujo a la expresión de GFP exclusivamente en el bulbo olfatorio de desarrollo. Las células que expresan GFP dirigida a través de este enfoque mostró típico proyecciones axonales, como se ha descrito anteriormente para las células mitrales del bulbo olfativo 10. Este método también se podría utilizar para la ejecución selectiva de otros reactivos incluidos los plásmidos corto horquilla de expresión de ARN de interferencia, lo que proporciona un método para el análisis espacial y pérdida de función temporal discreto.
Protocolo
1. Embriones transgénicos
- Aquí estamos utilizando una línea transgénica de peces cebra creado a través de un método de captura transposón mediada potenciador 8. El inserto transgénico incluye dos secuencias de codificación: KalTA4, una versión optimizada de pez cebra del activador transcripcional Gal4, y la proteína fluorescente de color rojo, mCherry. El potenciador de los rendimientos de la trampa método de líneas de pez cebra transgénico que expresa este casete transgénico bajo el control de una secuencia endógena potenciador. Así, dependiendo de la identidad específica de la secuencia potenciadora, la expresión de ambos KalTA4 mCherry y se localiza en regiones específicas del cerebro en desarrollo. Para la Et (zic4: Gal4TA4, UAS: mCherry) hzm5 línea que estamos utilizando aquí, la expresión se localiza en varios lugares de la parte posterior del cerebro, cerebro anterior, y, de particular importancia aquí, el bulbo olfatorio, 8 (véase también la Fig. 1.) . Dado este patrón de expresión, y la localización de la cinta dentro del genoma, los transgenes se prevé que estará bajo el control del promotor zic4 8 (véase también http://www.helmholtz-muenchen.de/en/idg/groups/ neuroimagen / lines_distel / main .).
- Et adultos (zic4: Gal4TA4, UAS: mCherry) hzm5 peces heterocigóticos para la inserción de transgénicos son típicamente acoplado con WT (AB) de pescado, lo que aproximadamente el 50% descendientes transgénicos. (Para un mayor porcentaje de descendencia transgénica, dos heterocigotos puede ser acoplado.)
- Con el fin de bloquear la formación de pigmento y facilitar la proyección de imagen fluorescente, el tratamiento de embriones transgénicos con 100 mM N-feniltiourea (PTU) a partir de las 08.06 HPF.
2. Embriones de montaje
- En HPF 24-28, la transferencia de embriones al agua huevo sin PTU. Identificar los embriones transgénicos por la expresión de mCherry utilizando un microscopio de fluorescencia. Quitar la membrana coriónica a partir de embriones transgénicos utilizando unas pinzas finas. Transferencia de embriones libres de sus corion a una placa de Petri que contiene el tampón de electroporación, más el 0,02% tricaína [buffer de electroporación: 180 mM NaCl, 5 mM KCl, 1,8 mM CaCl 2, 5 mM HEPES, pH 7.2] 4. Deje pasar 2 minutos para que el anestésico entre en vigor antes de proceder a la etapa de montaje.
- Prepare una solución al 0.5% de bajo punto de fusión de agarosa en tampón de electroporación más tricaína en el microondas la solución, y luego colocar la solución en una incubadora de 34 a 37 ° C. Una vez que la temperatura de la solución de agarosa se haya equilibrado, se coloca una gota de gran tamaño (~ 500 l) de la solución de agarosa al centro de 60 mm placa de Petri. Añadir 6-8 embriones anestesiado a esta caída de agarosa.
- Con unas pinzas finas (o bien los extremos de corte de puntas de pipeta microloader), la posición de los embriones de forma que todos ellos están orientados en la misma dirección y alineados en una fila vertical. Para solidificar la agarosa, y atrapar a los embriones en su lugar, colocar el plato en una gran placa de Petri con 2.3 mm de hielo.
- Una vez que la agarosa se ha solidificado, inundar el plato con la electroporación de amortiguación más tricaína, asegurando que la solución cubre por completo la caída de agarosa solidificada.
3. Micro-inyección de la expresión del ADN plásmido
- Prepare la expresión GFP plásmido utilizando un kit de aislamiento de plásmido midi o maxi-prep-(por ejemplo, Qiagen). Suspender el plásmido a una concentración final de 0,5 mg / l en agua estéril, más 0.03% de rojo fenol. Para el experimento bulbo olfatorio de selección descrito aquí, estamos usando un plásmido de expresión con la secuencia de codificación de EGFP bajo el control de múltiples sitios de unión Gal4 (14 tándem secuencias UAS y el promotor basal de pescado, E1b). El uso de este plásmido células, sólo transgénica que expresa el factor de transcripción KalTA4 será capaz de expresar las buenas prácticas agrarias, por lo que, mediando la expresión específica de las buenas prácticas agrarias.
Nota: aquí estamos utilizando rojo de fenol para la visualización de las inyecciones de ADN, que debe ser aplicable para la selección de otras regiones del cerebro en desarrollo, siempre y cuando la región se puede acceder desde los ventrículos. Para la orientación de otros tipos de células que requieren visualización fluorescente, Bodipy o colorantes Quantam punto podría ser utilizado para visualizar las inyecciones bajo iluminación fluorescente. - Pipetas de microinyección se pueden fabricar utilizando un extractor de pipeta horizontal o vertical. Los ajustes de calor y resistencia a la tracción, puede variar dependiendo del tipo de extractor, el tipo de elemento de calefacción, y el tipo de tubos capilares.
El uso de un Sutter P-30 extractor vertical, use un ajuste de calor de 980 y un sofá-force de 960 para producir mucho, pipetas afilado, agudo de paredes delgadas de vidrio de borosilicato con filamentos capilares [Instrumento Sutter # BF100-78-10]. Pipetas Microinjetion tiró con estos ajustes son cerrados y ser rotos antes de la inyección. - Utilice una punta de la pipeta microloader agregar 1.2 l de solución de ADN plásmido para la pipeta de inyección.
- Montaje yasegurar la pipeta cargada en el soporte de pipeta de inyección a presión del sistema.
- Ruptura de regreso por la pipeta cargada con unas pinzas finas hasta pulsos de presión de inflado produce la liberación de la solución de ADN de color rojo. Por otra parte, consejos pueden ser rotos por la rápida penetración una sumergida, doblado Kimwipe laboratorio.
Nota: debido a las pipetas de inyección están inicialmente cerrados y ser rotos de forma manual, el tamaño de la punta y el volumen de inyección son variables. Ideal pipetas de inyección debe requerir 3-5 pulsos de inyección para llenar completamente el ventrículo del cerebro anterior en desarrollo de 24 HPF embriones (100 pulsos de inyección ms a 40 psi). - Inyectar la solución de ADN plásmido en los ventrículos del cerebro en desarrollo, que el ADN se ve obligada junto a, y intercalados en la región del cerebro destinada a formar el bulbo olfatorio. El bulbo olfatorio se deriva de las células en la pared más anterior del ventrículo del cerebro anterior. De este modo, mediante la inserción de la pipeta de inyección en los ventrículos de forma que la pipeta está apuntando hacia la parte anterior del cerebro en desarrollo, las fuerzas de inyección a presión en el ADN y al lado del bulbo olfatorio posibles. Inyectar ADN hasta tinte rojo es claramente visible en el extremo anterior del ventrículo del cerebro anterior. Debido a que el ADN comienza a difundirse de inmediato, diluyendo el ADN, es importante continuar con el paso de la electroporación, tan pronto como sea posible después de la inyección (por ejemplo, a los 10 segundos).
4. Electroporación
- La electroporación se realiza mediante la auto-construidas a partir de electrodos electrodos de platino hierba subdérmico (Hierba Tecnología # E2). Los electrodos están conectados a una sonda de mano, y la distancia final entre los electrodos de platino debe ser de 1 mm (para más detalles sobre la construcción ver 9). Pulsos de onda cuadrada de electroporación se producen mediante la conexión de los electrodos a una hierba SD-9 estimulador (hierba Technology, modelo SD-9).
- Establecer el estimulador SD-9 para producir solo 5 pulsos electroporación ms a 70 voltios. Posición de los electrodos de forma que el electrodo positivo se coloca al lado del extremo anterior del embrión, mientras que el electrodo negativo es posterior a la cabeza del embrión. Iniciar manualmente ~ 7-8 pulsos electroporación utilizando el interruptor de modo único de la SD-9 estimulador, separando cada pulso de ~ 1 seg. Voltajes apropiados variarán en función de la edad de los embriones y la fuente de voltaje que se utiliza. Embriones más jóvenes requieren voltajes más bajos para evitar el daño del embrión, mientras que los mayores embriones requieren voltajes más altos para iniciar la electroporación 7.
- Permita que los embriones para recuperar por lo menos durante 10 minutos después de la electroporación antes de liberarlos de la agarosa.
- Con unas pinzas finas, sin que los embriones de la agarosa con cuidado trazando el contorno de los embriones y evitar el contacto real con los propios embriones.
- Una vez liberado, el retorno de los embriones de huevo con el agua (con PTU, si es necesario). Mantenerlos a 28 ° C hasta que se fotografió por la expresión de GFP.
5. Embriones de montaje de imágenes
- La transferencia de embriones a partir de agua de huevo con el agua más PTU huevo más 0,02% tricaína. Espere varios minutos para que el anestésico entre en vigor antes de proceder a la etapa de montaje.
- Prepare una solución al 0.5% de bajo punto de fusión de agarosa en el huevo de agua más tricaína en el microondas la solución, y luego colocar la solución en una incubadora de 34 a 37 ° C. Una vez que la temperatura de la solución de agarosa se haya equilibrado, se coloca una gota de gran tamaño (~ 300 l) de la solución de agarosa al centro de 35 mm placa de Petri. Añadir un embrión anestesiado a esta caída de agarosa.
- Con unas pinzas finas (o bien los extremos de corte de puntas de pipeta microloader), la posición de los embriones que están en posición vertical, por lo que es posible visualizar una vista dorsal del cerebro en desarrollo con un microscopio vertical (ámbitos invertido se requiere una geometría de embriones diferentes, y un plato diferente que permite la visualización desde abajo, ver 12). Solidificar la agarosa mediante la colocación de la antena sobre una gran placa de Petri con 2.3 mm de hielo. Reorientación con unas pinzas finas probable que sea necesario durante la solidificación para asegurarse de que el embrión no se caiga hacia un lado.
- Una vez que la agarosa se ha solidificado, inundar el plato con el huevo de agua más tricaína asegurar que la solución cubre por completo la caída de agarosa solidificada.
6. Los resultados representativos:
Aunque la expresión de GFP se puede observar como a las 6 horas después de la electroporación, aquí estamos mostrando imágenes de un embrión cuatro días después de la electroporación de tal manera que la estructura de las neuritas de las células afectadas ha desarrollado lo suficiente. El Et (zic4: Gal4TA4, UAS: mCherry) hzm5 transgénicos línea de trampas potenciador muestra la expresión constitutiva de mCherry (y KalTA4) en la parte posterior del cerebro, el cerebelo, cerebro anterior, y el bulbo olfatorio en los embriones de 5 días después de la fertilización (Fig. 1A y 1C). Los embriones que han tenido una expresión de UAS-GFP plásmido incorporado por electroporación objetivo (como se describió anteriormente), la expresión de mostrar las buenas prácticas agrarias que se limita a las células del bulbo olfatorio en desarrollo (Fig. 1B, 1D y 1E). Sólo las células transgénica que expresa el factor de transcripción KalTA4 son capaces de activar la expresión de este plásmido UAS-GFP. La incorporación de este plásmido en la no-transgénicos embriones no conduce a ninguna expresión de GFP detectable. Por lo tanto, es la acción combinada de la electroporación objetivo de UAS-GFP y expresión localizada transgénicos del conductor KalTA4 que conduce a la expresión exclusiva de la GFP en las células del bulbo olfatorio en desarrollo. La GFP-células que expresan el show típico proyecciones axonales de las células de bulbo olfatorio mitral (Fig. 1B y 1D) 10. Con el fin de visualizar las proyecciones del axón, las imágenes en la figura 1B y 1D tenía que estar expuesto a altos niveles de tal manera que la región de los cuerpos de las células eran muy sobreexpuesta. Un menor nivel de exposición (Fig. 1E) muestra que los cuerpos celulares que expresan GFP son, en efecto localizado en el bulbo olfatorio (véase la Fig. 1C y 1E;. Línea gris marca la frontera del bulbo olfativo).
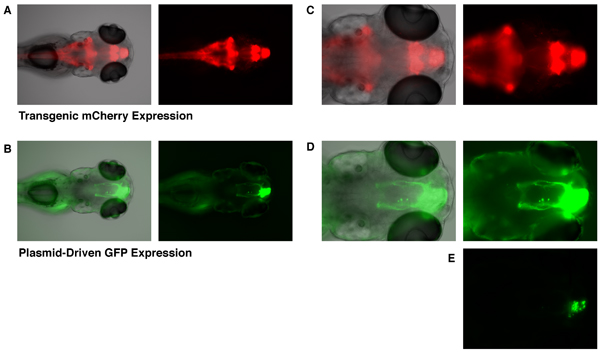
Figura 1. Dirigida expresión de GFP en el bulbo olfatorio de un embrión de pez cebra DPF 5. El Et (zic4: Gal4TA4, UAS: mCherry) hzm5 transgénicos línea de trampas potenciador, muestra la expresión constitutiva de mCherry en la parte posterior del cerebro, el cerebelo, cerebro anterior, y el bulbo olfativo (A y C, mCherry fluorescencia en rojo). Esta expresión de mCherry está mediada por transgénicos Gal4 expresión. Los embriones que han sido electroporated con un vector de expresión de UAS-GFP a las 28 HPF, mostrar la expresión dirigida GFP en el bulbo olfatorio a los 5 días posteriores a la fecundación (B, D y E, la fluorescencia de GFP se muestra en verde. Embrión mismo que en A y C). Una imagen de la exposición más baja en la parte inferior (E) muestra que la expresión de GFP se limita a los cuerpos de las células del bulbo olfatorio. La línea gris indica la frontera del bulbo olfatorio. Campo claro (en escala de grises), la fluorescencia verde (verde), y el rojo imágenes de fluorescencia (rojo) eran tener con un microscopio de fluorescencia Olympus BX60.
Discusión
Aquí hemos descrito un método de electroporación in vivo en el pez cebra, que utiliza un potenciador trampa Gal4 línea transgénica para dirigir la expresión del transgén electroporated a una población específica de células en el bulbo olfatorio de desarrollo. Este enfoque combina la excelente resolución temporal de la electroporación in vivo en el 7 con la expresión de células de tipo específico mediado por potenciador trampa de las líneas transgénicas 8. Aunque aquí hemos descrito los ataques del bulbo olfatorio, en la electroporación in vivo puede ser utilizada para combatir otras regiones del sistema nervioso en desarrollo 7.2, y potenciador de las líneas de trampas están disponibles con expresión específica de Gal4 en muchos tipos diferentes de células o tejidos específicos 8, 11. Por supuesto, esta técnica de electroporación también debe ser adecuado para otros enfoques combinatioral genéticos, como la serie LEXA Tet o sistemas de 13, 14, 15. Una gran ventaja de la electroporación es que no hay necesidad de hacer otras líneas transgénicas, ya que una adecuada Gal4-line está disponible. Esto permite ahorrar seis meses.
En la electroporación in vivo permite la incorporación de los oligonucleótidos en las neuronas y de sus precursores en cualquier etapa específica del desarrollo del sistema nervioso es de interés del 7. Esta resolución temporal es particularmente ventajoso para el análisis de la pérdida de la función, ya que puede evitar los problemas con los genes de orientación que tienen funciones esenciales en las primeras etapas de desarrollo. El método que describimos aquí también se puede utilizar para incorporar la pérdida de la función de los reactivos incluidos oligonucleótidos RNAi o construcciones y morpholino oligonucleótidos antisentido 4, 7. Plásmido impulsado por reactivos como dominante negativo de plásmidos de expresión de proteínas o de corto horquilla plásmidos RNAi también se puede colocar bajo control de un Gal4 UAS, teniendo en cuenta el tipo específico de célula exacta expresión hemos demostrado aquí para la expresión de GFP.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado a través de una NIH R15 AREA otorgar a John Horne (NIMH, R15MH083221).
Materiales
Reactivos:
- Agarosa de bajo punto de fusión (Sigma, A9414)
- Kit de plásmido midi o maxi-prep-(por ejemplo, Qiagen, # 12643]
- Rojo fenol (Sigma, P3532)
Equipos:
- Capilar de vidrio de filamento; ID = 0,78 mm; OD = 1,0 mm (Sutter Instruments, # BF100-78-10)
- Hierba SD-9 estimulador (hierba Technology, modelo SD-9)
- Electrodos de platino hierba subdérmico, de aguja recta (Tecnología de la hierba, # E2)
- Micro-cargador de puntas de pipeta (Eppendorf, # X22703R)
- Pipeta extractor (por ejemplo, Sutter, modelo P-30)
- Pipeta extractor (por ejemplo, Sutter, modelo P-30)
Referencias
- Swartz, M., Eberhart, J., Mastick, G., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev Biol. 233, 13-21 (2001).
- Bhatt, D. H., Otto, S. J., Depoister, B., Fetcho, J. R. Cyclic AMP-induced repair of zebrafish spinal circuits. Science. 305, 254-258 (2004).
- Teh, C., Parinov, S., Korzh, V. New ways to admire zebrafish: progress in functional genomics research methodology. Biotechniques. 38, 897-906 (2005).
- Cerda, G. A., Thomas, J. E., Allende, M. L., Karlstrom, R. O., Palma, V. Electroporation of DNA, RNA, and morpholinos into zebrafish embryos. Methods. 39, 207-211 (2006).
- Hendricks, M., Jesuthasan, S. Electroporation-based methods for in vivo, whole mount and primary culture analysis of zebrafish brain development. Neural Development. 15, 2-6 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Kera, S. A., Agerwala, S. M., Horne, J. H. The temporal resolution of in vivo electroporation in zebrafish: a method for time-resolved loss-of-function. Zebrafish. 7, 97-108 (2010).
- Distel, M., Wullimann, M. F., Köster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Proc Natl Acad Sci U S A. 106, 13365-13370 (2009).
- Hoegler, K. J., Horne, J. H. Targeting the zebrafish optic tectum using in vivo electroporation. Cold Spring Harb. Protoc. , (2010).
- Nobuhiko, M., Kozo, M., Tatsuya, T., Shin-ichi, H., Hitoshi, O., Yoshihiro, Y. From the olfactory bulb to higher brain centers: genetic visualization of secondary olfactory pathways in zebrafish. J. Neurosci. 29, 4756-4766 (2009).
- Davison, J. M., Akitake, C. M., Goll, M. G., Rhee, J. M., Gosse, N., Baier, H., Halpern, M. E., Leach, S. D., Parsons, M. J. Transactivation from Gal4-VP16 transgenic insertions for tissue-specific cell labeling and ablation in zebrafish. Developmental Biology. , 304-811 (2007).
- Distel, M., Kö, s. t. e. r., W, R. in vivo time-lapse imaging of zebrafish embryonic development. CSH Protocols. , (2007).
- Emelyanov, A., Parinov, S. Mifepristone-inducible LexPR system to drive and control gene expression transgenic zebrafish. Developmental Biology. 320, 113-121 (2008).
- Knopf, F., Schnabel, K., Haase, C., Pfeifer, K., Anastassiasdis, K., Weidinger, G. Dually inducible TetON systems for tissue-specific conditional gene expression in zebrafish. PNAS. , 107-10 (1993).
- Zhu, P., Narita, Y., Bundschuh, S. T., Fajardo, O., Schärer, Y. P., Chattopadhyaya, B., Bouldoires, E. A., Stepien, A. E., Deisseroth, K., Arber, S., Sprengel, R., Rijli, F. M., Friedrich, R. W. Optogenetic Dissection of Neuronal Circuits in Zebrafish using Viral Gene Transfer and the Tet System. Front Neural Circuits. 3, 21-21 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados