Method Article
Cibler les neurones Bulbe olfactif Utiliser combiné In Vivo L'électroporation et de Gal4-Based Enhancer Piège Lignes Zebrafish
Dans cet article
Résumé
La résolution temporelle et spatiale des manipulations génétiques qui détermine le spectre des phénomènes biologiques qui peuvent perturber. Ici, nous utilisons temporellement et spatialement discrets In vivo, combinée avec des lignées transgéniques du poisson zèbre, pour induire l'expression d'un transgène GFP spécifiquement dans les neurones du bulbe olfactif de développement.
Résumé
Dans l'électroporation in vivo est une méthode puissante pour fournir des plasmides d'expression de l'ADN, réactifs ARNi, et morpholino oligonucléotides anti-sens à des régions spécifiques des embryons en développement, y compris ceux de C. elegans, poussin, xénope, poisson zèbre et la souris 1. Dans le poisson zèbre, de l'électroporation in vivo a été montré pour avoir une excellente résolution spatiale et temporelle pour la livraison de ces réactifs 2-7. La résolution temporelle de cette méthode est importante car elle permet l'incorporation de ces réactifs à des stades spécifiques du développement. Par ailleurs, parce que l'expression des vecteurs électroporées survient dans les 6 heures 7, cette méthode est plus rapide que les approches transgéniques. Alors que la résolution spatiale peut être extrêmement précis pour cibler une seule cellule 2, 6, il est souvent préférable d'incorporer des réactifs dans une population de cellules spécifiques dans un tissu ou une structure. Lorsque vous ciblez plusieurs cellules, à l'électroporation in vivo est efficace pour la livraison à une région spécifique de l'embryon, mais en particulier dans le système nerveux en développement, il est difficile de cibler des types cellulaires spécifiques uniquement par électroporation spatialement discrets. Alternativement, enhancer trap lignées transgéniques offrent un excellent type de cellules spécifiques d'expression des transgènes 8. Nous décrivons ici une approche qui combine transgéniques Gal4 basé lignes de trappe Enhancer 8 avec spatialement discrète in vivo électroporation 7, 9 à cibler spécifiquement le développement des neurones du bulbe olfactif de poisson zèbre. Le ET (zic4: Gal4TA4, SAMU: mCherry) hzm5 (anciennement GA80_9) ligne de trappe rehausseur décrit précédemment 8, affiche ciblées expression transgénique de la médiation par un zèbre mCherry optimisé Gal4 (KalTA4) activateur transcriptionnel dans plusieurs régions du cerveau en développement, y compris rhombencéphale, cervelet, le cerveau antérieur, et le bulbe olfactif. Pour cibler expression de la GFP spécifiquement vers le bulbe olfactif, un plasmide avec la séquence codante de la GFP sous le contrôle de plusieurs sites de liaison de Gal4 (SAMU) a été électroporés dans l'extrémité antérieure du cerveau antérieur aux heures de 24 à 28 après la fécondation (HPF). Bien que cette méthode intègre l'ADN plasmidique dans plusieurs régions du cerveau antérieur, expression de la GFP est seulement induite dans les cellules transgénique exprimant le facteur de transcription KalTA4. Ainsi, en utilisant la ligne GA080_9 transgéniques, cette approche a conduit à l'expression de GFP exclusivement dans le bulbe olfactif de développement. Cellules GFP ciblée exprimer à travers cette approche a montré typiques projections axonales, comme précédemment décrit pour les cellules mitrales du bulbe olfactif 10. Cette méthode pourrait également être utilisé pour l'administration ciblée d'autres réactifs, y compris à court épingle expression de l'ARN interférence plasmides, qui fournirait une méthode pour spatialement et temporellement discrète perte de fonction d'analyse.
Protocole
1. Embryons transgéniques
- Ici, nous utilisons une lignée transgénique du poisson-zèbre créée grâce à une méthode transposon médiée piège Enhancer 8. L'insert transgénique comprend deux séquences codantes: KalTA4, une version optimisée de poisson zèbre de l'activateur transcriptionnel Gal4, et la protéine fluorescente rouge, mCherry. Le rehausseur de piège méthode donne des lignes de poisson zèbre transgénique qui expriment cette cassette transgénique sous contrôle d'une séquence endogène Enhancer. Ainsi, selon l'identité de la séquence amplificateur spécifique, l'expression des deux KalTA4 et mCherry est localisée à des régions spécifiques du cerveau en développement. Pour les E. (zic4: Gal4TA4, SAMU: mCherry) hzm5 ligne que nous utilisons ici, l'expression est localisée à plusieurs endroits dans le cerveau postérieur, prosencéphale, et, d'une importance particulière ici, le bulbe olfactif 8 (voir également la figure 1.) . Compte tenu de ce mode d'expression, et la localisation de la cassette dans le génome, les transgènes sont prévus pour être sous le contrôle du promoteur zic4 8 (voir aussi http://www.helmholtz-muenchen.de/en/idg/groups/ neuroimagerie / lines_distel / main .).
- Adulte Et (zic4: Gal4TA4, SAMU: mCherry) hzm5 poissons hétérozygotes pour l'insert transgénique sont généralement accouplées avec WT (AB) de poissons, conduisant à environ 50% descendants transgéniques. (Pour un plus grand pourcentage de la progéniture transgénique, deux hétérozygotes peuvent être accouplés.)
- Afin de bloquer la formation de pigments et de faciliter l'imagerie de fluorescence, traiter des embryons transgéniques avec 100 uM de N-phénylthiourée (PTU) commence à 6-8 HPF.
2. Embryons de montage
- Au HPF 24-28, transfert d'embryons à l'eau oeuf sans PTU. Identifier les embryons transgéniques par l'expression de mCherry utilisant un microscope à fluorescence. Retirer la membrane chorionique à partir d'embryons transgéniques à l'aide de pinces fines. Transfert embryons libérés de leur chorion à une boîte de Petri contenant un tampon d'électroporation, plus 0,02% tricaïne [tampon d'électroporation: 180 mM NaCl, 5 mM de KCl, 1,8 mM CaCl 2, 5 mM d'HEPES, pH 7,2] 4. Laisser 2 minutes pour l'anesthésie pour prendre effet avant de passer à l'étape de montage.
- Préparer une solution de 0,5% de faible point de fusion d'agarose en tampon plus tricaïne électroporation par micro-ondes de la solution, puis en plaçant la solution dans un incubateur 34-37 ° C. Une fois la température de la solution d'agarose a équilibré, déposer une goutte de grande taille (~ 500 pi) de la solution d'agarose au centre d'un plat de Pétri de 60 mm. Ajouter 6-8 embryons anesthésiés à cette goutte d'agarose.
- En utilisant une pince fine (ou les extrémités fines de coupe embouts de pipettes microloader), la position de l'embryon de telle sorte qu'ils sont tous confrontés dans la même direction et alignés dans une rangée verticale. Pour solidifier l'agarose, et piéger les embryons en position, placez le plat sur un grand plat de Pétri avec 2-3 mm de glace.
- Une fois que l'agarose est solidifié, inonder le plat avec l'électroporation tampon plus tricaïne, assurant que la solution couvre complètement la baisse solidifié agarose.
3. Micro-injection d'ADN plasmidique d'expression
- Préparer l'expression de la GFP plasmide en utilisant un kit d'isolation Midi-ou maxi-prep plasmide (par exemple, Qiagen). Suspendre le plasmide à une concentration finale de 0,5 ug / ul dans l'eau stérile, plus 0,03% du rouge de phénol. Pour l'expérience bulbe olfactif ciblant décrit ici, nous utilisons un plasmide d'expression avec la séquence codante du EGFP sous le contrôle de plusieurs sites de liaison de Gal4 (14 tandem séquences UAS et le promoteur du poisson basale, E1B). L'utilisation de ce plasmide, seules les cellules transgénique exprimant le facteur de transcription KalTA4 sera capable d'exprimer la GFP, ainsi, la médiation expression ciblée de la GFP.
Remarque: nous sommes ici en utilisant le rouge de phénol pour la visualisation des injections d'ADN, qui devraient être applicables pour cibler d'autres régions du cerveau en développement, aussi longtemps que la région peut être consulté à partir des ventricules. Pour le ciblage des autres types de cellules qui nécessitent une visualisation fluorescente, Bodipy ou Quantam colorants Dot pourrait potentiellement être utilisé pour visualiser les injections sous un éclairage fluorescent. - Pipettes microinjection peut être fabriqué en utilisant soit un extracteur pipette horizontale ou verticale. Réglages de chaleur et tirez-la force variera selon le type d'extracteur, le type de l'élément chauffant, et le type de tubes capillaires en verre.
L'utilisation d'un Sutter P-30 Extracteur vertical, utiliser un réglage de chaleur de 980 et une force de traction de 960 à produire de long, effilé, pipettes forte à paroi mince et capillaire en verre borosilicate avec des filaments [instrument Sutter # BF100-78-10]. Pipettes Microinjetion tiré avec ces paramètres sont scellés et doit être brisé de retour avant l'injection. - Utiliser un embout de pipette microloader d'ajouter 1-2 pl d'ADN plasmidique solution à la pipette d'injection.
- Mount etsécuriser la pipette chargée dans le support de la pression d'injection du système pipette.
- Briser le dos de la pipette chargé avec une pince fine jusqu'à produire des impulsions de pression version gonflée de la solution de l'ADN rouge. Alternativement, des conseils peut être rompu par l'arrière rapidement pénétrer un submergées, Kimwipe plié en laboratoire.
Remarque: en raison des pipettes d'injection sont initialement scellée et doit être manuellement cassée le dos, la taille pointe et le volume d'injection sont variables. Pipettes d'injection Idéal devraient exiger 3-5 impulsions d'injection pour remplir complètement le ventricule du cerveau antérieur de développement des embryons HPF 24 (100 impulsions d'injection ms à 40 psi). - Injecter la solution d'ADN plasmidique dans les ventricules du cerveau en développement tels que l'ADN est contraint à côté, et intercalés dans la région du cerveau destinée à former le bulbe olfactif. Le bulbe olfactif est dérivé de cellules de la paroi la plus antérieure du ventricule du cerveau antérieur. Ainsi, en insérant la pipette d'injection dans les ventricules tels que la pipette est dirigé vers l'extrémité antérieure du cerveau en développement, l'injection sous pression des forces de l'ADN dans et à proximité de l'ampoule olfactive potentiels. Injecter de l'ADN jusqu'au colorant rouge est clairement visible à l'extrémité antérieure du ventricule du cerveau antérieur. Parce que l'ADN commence à diffuser immédiatement, diluer l'ADN, il est important de procéder à l'étape électroporation dès que possible après l'injection (par exemple, dans les 10 sec).
4. L'électroporation
- L'électroporation est réalisée à l'aide d'auto-construit électrodes en électrodes de platine Herbe sous-cutané (Grass Technologie # E2). Les électrodes sont attachées à une sonde à main, et la distance finale entre les électrodes de platine devrait être de 1 mm (pour plus de détails sur la construction voir 9). Impulsions électroporation Square-ondes sont produites par reliant les électrodes à une herbe SD-9 Stimulator (Grass technologie, le modèle SD-9).
- Réglez le stimulateur SD-9 pour produire unique, 5 impulsions électroporation ms à 70 volts. Position des électrodes de telle sorte que l'électrode positive est placée à côté de l'extrémité antérieure de l'embryon, tandis que l'électrode négative est postérieure à la tête de l'embryon. Lancer manuellement ~ 7-8 impulsions électroporation en utilisant le sélecteur de mode unique de la SD-9 stimulateur, séparant chaque impulsion par ~ 1 sec. Tensions appropriées varieront selon l'âge des embryons et la source de tension utilisée. Les plus jeunes embryons nécessitent des tensions inférieures pour éviter d'endommager l'embryon, alors âgées embryons nécessitent des tensions plus élevées pour initier électroporation 7.
- Autoriser les embryons de récupérer au moins 10 min après l'électroporation avant de les libérer de l'agarose.
- En utilisant des pinces fines, sans les embryons de l'agarose par traçage délicatement le contour de l'embryon, tout en évitant le contact réel avec les embryons eux-mêmes.
- Une fois libéré, le retour des embryons d'œufs à l'eau (avec PTU si nécessaire). Gardez-les à 28 ° C jusqu'à ce qu'ils soient à imager des expression de la GFP.
5. Embryons de montage pour l'imagerie
- Transfert des embryons à partir d'eau d'œuf, plus PTU à l'eau d'œuf, plus 0,02% tricaïne. Attendez quelques minutes pour l'anesthésie pour prendre effet avant de passer à l'étape de montage.
- Préparer une solution de 0,5% de faible point de fusion d'agarose dans l'œuf par l'eau plus tricaïne micro-ondes de la solution, puis en plaçant la solution dans un incubateur 34-37 ° C. Une fois la température de la solution d'agarose a équilibré, déposer une goutte de grande taille (~ 300 pi) de la solution d'agarose au centre d'un plat de Pétri de 35 mm. Ajouter un embryon anesthésiés à cette goutte d'agarose.
- En utilisant une pince fine (ou les extrémités fines de coupe embouts de pipettes microloader), la position de l'embryon tels qu'ils sont debout, ce qui permet de visualiser une vue dorsale du cerveau en développement avec un microscope droit (oscilloscopes inversé, il faudra une géométrie différente d'embryon, et un plat différent permettant la visualisation d'en bas; voir 12). Consolidez l'agarose en plaçant le plat sur un grand plat de Pétri avec 2-3 mm de glace. Re-orientation avec une pince fine sera probablement nécessaire lors de la solidification de s'assurer que l'embryon ne pas tomber sur le côté.
- Une fois que l'agarose est solidifié, des inondations le plat avec l'oeuf de l'eau, plus tricaïne veillant à ce que la solution couvre complètement la baisse solidifié agarose.
6. Les résultats représentatifs:
Bien expression de la GFP peut être observée dès 6 heures après l'électroporation, nous sommes ici de montrer des images à partir d'un embryon de 4 jours après l'électroporation tels que la structure des neurites des cellules ciblées a suffisamment développé. Le ET (zic4: Gal4TA4, SAMU: mCherry) hzm5 transgéniques ligne de trappe Enhancer affiche une expression constitutive de mCherry (et KalTA4) dans le cerveau postérieur, le cervelet, le cerveau antérieur, et du bulbe olfactif chez les embryons de 5 jours post-fécondation (fig. 1A et 1C). Les embryons qui ont eu une expression UAS-GFP plasmide incorporé par électroporation ciblées (telles que décrites ci-dessus), expression de la GFP montrent que est restreinte aux cellules du bulbe olfactif de développement (Fig. 1B, 1D, et 1E). Seules les cellules transgénique exprimant le facteur de transcription KalTA4 sont capables d'activer l'expression de ce plasmide UAS-GFP. L'incorporation de ce plasmide dans des embryons non transgéniques ne conduit pas à une expression de la GFP détectable. Ainsi, il est l'action combinée de l'électroporation ciblée de UAS-GFP et localisée expression transgénique du pilote KalTA4 qui mène à l'expression exclusive de la GFP dans les cellules du bulbe olfactif de développement. Les cellules exprimant la GFP montrent typiquement projections axonales des cellules mitrales du bulbe olfactif (Fig. 1B et 1D) 10. Afin de visualiser les projections axonales, les images dans la figure 1B et 1D ont dû être exposés à des niveaux élevés de telle sorte que la région des corps cellulaires ont été bien plus exposés. Un faible niveau d'exposition (Fig. 1E) montre que les corps cellulaires exprimant la GFP sont en effet localisées vers le bulbe olfactif (comparer Fig 1C et 1E;. Ligne grise marque la frontière du bulbe olfactif).
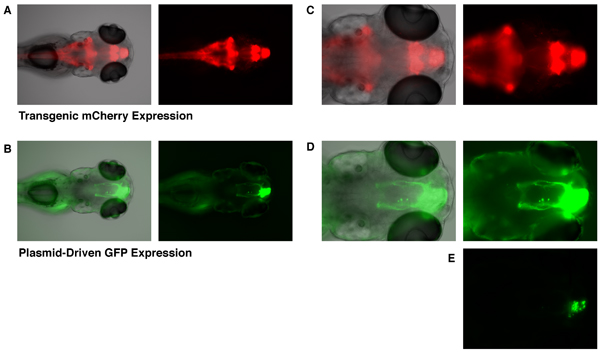
Figure 1. Ciblées expression de la GFP dans le bulbe olfactif d'un embryon de poisson zèbre 5 DPF. Le ET (zic4: Gal4TA4, SAMU: mCherry) hzm5 transgéniques ligne de trappe enhancer, affiche une expression constitutive de mCherry dans le cerveau postérieur, le cervelet, le cerveau antérieur, et le bulbe olfactif (A et C, la fluorescence mCherry montré en rouge). Cette expression de mCherry est médiée par transgénique Gal4-expression. Les embryons qui ont été électroporation avec un vecteur d'expression UAS-GFP à 28 HPF, affichage expression de la GFP ciblée dans le bulbe olfactif à 5 jours post-fécondation (B, D et E, fluorescence de la GFP en vert. Embryon même que dans une et C). Une image plus faible exposition au fond (E) montre que l'expression de GFP est limitée à corps cellulaires du bulbe olfactif. La ligne grise indique la frontière du bulbe olfactif. Fond clair (échelle de gris), la fluorescence verte (vert), et la fluorescence rouge (rouge) ont été tous prendre des images avec un microscope Olympus BX60 fluorescence.
Discussion
Ici, nous avons décrit une méthode d'électroporation in vivo chez le poisson zèbre, qui utilise un enhancer trap Gal4 lignée transgénique pour cibler l'expression du transgène électroporées à une population spécifique de cellules dans le bulbe olfactif de développement. Cette approche combine l'excellente résolution temporelle de l'électroporation in vivo 7 avec l'expression spécifique au type cellulaire médiée par des lignes enhancer transgéniques piège 8. Bien qu'ici nous avons décrit le ciblage du bulbe olfactif, dans l'électroporation in vivo peuvent être utilisées pour cibler d'autres régions du système nerveux en développement 2-7, et enhancer lignes de piégeage sont disponibles avec l'expression ciblée de Gal4 dans de nombreux types différents de cellules ou des tissus spécifiques 8, 11. Bien sûr, cette technique d'électroporation devrait également être adapté à d'autres approches génétiques combinatioral comme le LexA ou Tet systèmes 13, 14, 15. Un avantage majeur de l'électroporation est qu'il n'ya pas besoin de faire d'autres lignées transgéniques étant donné qu'un adaptée Gal4-ligne est disponible. Cela permet d'économiser six mois.
Dans l'électroporation in vivo permet l'incorporation d'oligonucléotides en neurones et de leurs précurseurs à n'importe quel stade précis du développement du système nerveux est d'intérêt 7. Cette résolution temporelle est particulièrement avantageux pour la perte de fonction de l'analyse, car elle permet de contourner les problèmes avec des gènes de ciblage qui ont des fonctions essentielles à des stades précoces de développement. La méthode que nous décrivons ici peut également être utilisé pour intégrer la perte de fonction des réactifs, y compris des oligonucléotides ARNi ou constructions et morpholino oligonucléotides anti-sens 4, 7. Plasmidique axée réactifs tels que dominante négative des plasmides d'expression de protéines ou de court-épingle plasmides ARNi peut aussi être placé sous le contrôle d'un Gal4 SAMU, permettant pour le type spécifique de cellules précises d'expression que nous avons présentés ici pour l'expression de la GFP.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été financé par une subvention du NIH R15 AREA pour John Horne (NIMH; R15MH083221).
matériels
Réactifs:
- Agarose, à faible point de fusion (Sigma, A9414)
- Plasmidique kit Midi-ou maxi-prep (par exemple, Qiagen, # 12643]
- Rouge de phénol (Sigma, P3532)
Equipement:
- Capillaire en verre avec des filaments; ID = 0,78 mm; DO = 1,0 mm (Sutter Instruments, # BF100-78-10)
- Herbe SD-9 Stimulator (Grass technologie, le modèle SD-9)
- Électrodes de platine Herbe sous-cutanés, aiguille droite (la technologie Grass, # E2)
- Micro-chargeur pipette (Eppendorf, # X22703R)
- Pipeter extracteur (par exemple, Sutter, modèle P-30)
- Pipeter extracteur (par exemple, Sutter, modèle P-30)
Références
- Swartz, M., Eberhart, J., Mastick, G., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev Biol. 233, 13-21 (2001).
- Bhatt, D. H., Otto, S. J., Depoister, B., Fetcho, J. R. Cyclic AMP-induced repair of zebrafish spinal circuits. Science. 305, 254-258 (2004).
- Teh, C., Parinov, S., Korzh, V. New ways to admire zebrafish: progress in functional genomics research methodology. Biotechniques. 38, 897-906 (2005).
- Cerda, G. A., Thomas, J. E., Allende, M. L., Karlstrom, R. O., Palma, V. Electroporation of DNA, RNA, and morpholinos into zebrafish embryos. Methods. 39, 207-211 (2006).
- Hendricks, M., Jesuthasan, S. Electroporation-based methods for in vivo, whole mount and primary culture analysis of zebrafish brain development. Neural Development. 15, 2-6 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Kera, S. A., Agerwala, S. M., Horne, J. H. The temporal resolution of in vivo electroporation in zebrafish: a method for time-resolved loss-of-function. Zebrafish. 7, 97-108 (2010).
- Distel, M., Wullimann, M. F., Köster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Proc Natl Acad Sci U S A. 106, 13365-13370 (2009).
- Hoegler, K. J., Horne, J. H. Targeting the zebrafish optic tectum using in vivo electroporation. Cold Spring Harb. Protoc. , (2010).
- Nobuhiko, M., Kozo, M., Tatsuya, T., Shin-ichi, H., Hitoshi, O., Yoshihiro, Y. From the olfactory bulb to higher brain centers: genetic visualization of secondary olfactory pathways in zebrafish. J. Neurosci. 29, 4756-4766 (2009).
- Davison, J. M., Akitake, C. M., Goll, M. G., Rhee, J. M., Gosse, N., Baier, H., Halpern, M. E., Leach, S. D., Parsons, M. J. Transactivation from Gal4-VP16 transgenic insertions for tissue-specific cell labeling and ablation in zebrafish. Developmental Biology. , 304-811 (2007).
- Distel, M., Kö, s. t. e. r., W, R. in vivo time-lapse imaging of zebrafish embryonic development. CSH Protocols. , (2007).
- Emelyanov, A., Parinov, S. Mifepristone-inducible LexPR system to drive and control gene expression transgenic zebrafish. Developmental Biology. 320, 113-121 (2008).
- Knopf, F., Schnabel, K., Haase, C., Pfeifer, K., Anastassiasdis, K., Weidinger, G. Dually inducible TetON systems for tissue-specific conditional gene expression in zebrafish. PNAS. , 107-10 (1993).
- Zhu, P., Narita, Y., Bundschuh, S. T., Fajardo, O., Schärer, Y. P., Chattopadhyaya, B., Bouldoires, E. A., Stepien, A. E., Deisseroth, K., Arber, S., Sprengel, R., Rijli, F. M., Friedrich, R. W. Optogenetic Dissection of Neuronal Circuits in Zebrafish using Viral Gene Transfer and the Tet System. Front Neural Circuits. 3, 21-21 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon