Method Article
Targeting Riechhirn Neuronen mit kombinierten In Vivo Elektroporation und Gal4-Based Enhancer-Trap Zebrafischlinien
In diesem Artikel
Zusammenfassung
Die zeitliche und räumliche Auflösung von genetischen Manipulationen bestimmt das Spektrum der biologischen Phänomene, die sie stören. Hier haben wir zeitlich und räumlich diskreten Einsatz In vivo Elektroporation, mit transgenen Linien der Zebrafisch kombiniert, um die Expression eines GFP-Transgen spezifisch induzieren in Neuronen des sich entwickelnden Riechkolben.
Zusammenfassung
In-vivo-Elektroporation ist eine leistungsfähige Methode für die Bereitstellung von DNA-Expressionsplasmide, RNAi-Reagenzien und Morpholino Antisense-Oligonukleotiden auf bestimmte Regionen der sich entwickelnden Embryonen, auch die der C. elegans, chick, Xenopus, Zebrafisch und Maus 1. In Zebrafisch hat in vivo Elektroporation wurde gezeigt, dass gute räumliche und zeitliche Auflösung für die Lieferung dieser Reagenzien 2-7 haben. Die zeitliche Auflösung dieser Methode ist wichtig, weil sie für den Einbau dieser Reagenzien können in bestimmten Phasen in der Entwicklung. Darüber hinaus, weil Ausdruck von elektroporiert Vektoren erfolgt innerhalb von 6 Stunden 7 ist diese Methode aktueller denn transgene Ansätze. Während die räumliche Auflösung kann sehr präzise, wenn gezielt eine einzelne Zelle 2, 6, ist es oft besser, Reagenzien in eine bestimmte Zellpopulation innerhalb eines Gewebes oder Struktur zu integrieren. Bei der Ausrichtung mehrerer Zellen, in vivo Elektroporation für die Zustellung an eine bestimmte Region des Embryos eine effiziente, aber besonders in der Entwicklung des Nervensystems, ist es schwierig, spezifische Zelltypen allein durch räumlich diskreten Elektroporation Ziel. Alternativ bieten enhancer trap transgenen Linien ausgezeichnete Zelltyp-spezifische Expression der Transgene 8. Hier beschreiben wir einen Ansatz, dass transgene Gal4-basierten Enhancer-trap-Linien 8 kombiniert mit räumlich diskreten in vivo Elektroporation 7, 9, gezielt entwickeln Neuronen des Zebrafisch Riechkolben. Die Et (zic4: Gal4TA4, UAS: mCherry) hzm5 (ehemals GA80_9) enhancer trap line zuvor beschriebenen 8, zeigt gezielte transgene Expression mCherry vermittelt durch einen Zebrafisch optimierte Gal4 (KalTA4) Transkriptionsaktivator in mehreren Regionen des sich entwickelnden Gehirns einschließlich Hinterhirn, Kleinhirn, Vorderhirn und den Riechkolben. Um Ziel GFP-Expression spezifisch auf die Riechkolben, einem Plasmid mit der kodierenden Sequenz des GFP unter der Kontrolle mehrerer Gal4-Bindungsstellen (FH) wurde in das vordere Ende des Vorderhirns bei 24-28 Stunden nach der Befruchtung (HPF) elektroporiert. Obwohl diese Methode enthält Plasmid-DNA in mehreren Regionen des Vorderhirns, ist die GFP-Expression nur in Zellen transgen Ausdruck der KalTA4 Transkriptionsfaktor induziert. So mit dem GA080_9 transgene Linie führte dieser Ansatz zur GFP-Expression ausschließlich in den Entwicklungsländern Riechkolben. GFP-exprimierenden Zellen durch diesen Ansatz gezielt zeigten typische axonale Projektionen, wie zuvor für Mitralzellen der Riechkolben 10 beschrieben. Diese Methode könnte auch für die gezielte Verabreichung von anderen Reagenzien einschließlich kurz-Haarnadel RNA-Interferenz Expressionsplasmide, die ein Verfahren zur räumlich und zeitlich diskreten loss-of-function-Analyse würde verwendet werden.
Protokoll
1. Transgene Embryonen
- Hier sind wir mit einer transgenen Linie von Zebrafisch durch ein Transposon-vermittelte Enhancer-trap Methode 8 erstellt haben. Die transgenen einfügen umfasst zwei codierende Sequenzen: KalTA4, ein Zebrafisch-optimierte Version des Gal4 Transkriptionsaktivator, und die rot fluoreszierendes Protein, mCherry. Die Enhancer-trap Methode liefert Linien transgener Zebrafische, dass diese transgenen Kassette ausdrückliche unter Kontrolle eines endogenen Enhancer-Sequenz. So können je nach der Identität des spezifischen Enhancer-Sequenz ist die Expression der beiden KalTA4 und mCherry auf bestimmte Regionen des sich entwickelnden Gehirns lokalisiert. Für die Et (zic4: Gal4TA4, UAS: mCherry) hzm5 Linie, die wir hier benutzen, ist Ausdruck auf mehrere Standorte in der Hinterhirn, Vorderhirn, lokalisiert und, von besonderer Bedeutung, den Riechkolben 8 (siehe auch Abb. 1). . Angesichts dieses Muster der Expression und Lokalisation der Kassette in das Genom, sind die Transgene voraussichtlich unter der Kontrolle der zic4 Promoter 8 (siehe auch http://www.helmholtz-muenchen.de/en/idg/groups/ Neuroimaging / lines_distel / main .).
- Adult Et (zic4: Gal4TA4, UAS: mCherry) hzm5 Fische heterozygot für die transgenen einzufügen sind in der Regel mit WT (AB) Fisch gedeckt, was zu ca. 50% transgene Nachkommen. (Für einen höheren Anteil an transgenen Nachkommen können zwei Heterozygoten gepaart werden.)
- Um Block Pigmentbildung und erleichtern Fluoreszenz-Imaging, behandeln transgenen Embryonen mit 100 pM N-Phenylthioharnstoff (PTU) Anfang bei 6-8 hpf.
2. Montage Embryonen
- Bei 24-28 hpf, Transfer Embryonen Ei Wasser ohne PTU. Identifizieren transgenen Embryos durch die Expression von mCherry mit einem Fluoreszenzmikroskop. Entfernen Sie die Chorion-Membran aus transgenen Embryonen mit feinen Pinzetten. 4: Transfer Embryonen aus ihrem Chorion auf eine Petrischale mit Elektroporation Puffer plus 0,02% Tricaine [180 mM NaCl, 5 mM KCl, 1,8 mM CaCl 2, 5 mM HEPES, pH 7,2 Elektroporationspuffer] befreit. Lassen Sie 2 Minuten, bis die Betäubung wirksam, bevor Sie fortfahren, um die Montage Schritt zu tun.
- Bereiten Sie eine 0,5% ige Lösung mit niedrigem Schmelzpunkt Agarose in Elektroporation Puffer plus Tricaine durch microwaving die Lösung, und das Setzen der Lösung in ein 34-37 ° C Inkubator. Sobald die Temperatur der Agarose-Lösung wurde äquilibriert, statt einen großen Tropfen (~ 500 ul) der Agarose-Lösung in die Mitte einer 60 mm Petrischale. Fügen Sie 6-8 betäubt Embryonen dieser Tropfen Agarose.
- Mit feinen Pinzette (oder die feinen Enden geschnitten Microloader Pipettenspitzen), positionieren Sie den Embryonen, so dass sie alle in die gleiche Richtung ausgerichtet und in einer senkrechten Reihe. Zur Verfestigung der Agarose und Trap die Embryonen in der Lage, die Schale auf eine große Petrischale mit 2-3 mm aus Eis.
- Nach Erstarren der Agarose, Überschwemmung die Schale mit Elektroporation Puffer plus Tricaine, sicherzustellen, dass die Lösung vollständig bedeckt die erstarrte Agarose fallen.
3. Micro-Injektion von DNA-Expressionsplasmid
- Bereiten Sie die GFP Expressionsplasmid mit einem Midi-oder Maxi-Prep Plasmid Isolation Kit (zB Qiagen). Suspend das Plasmid in einer Endkonzentration von 0,5 ug / ul in sterilem Wasser plus 0,03% Phenolrot. Für den Riechkolben Targeting hier beschriebene Experiment, wir sind mit einem Expressionsplasmid mit der kodierenden Sequenz des EGFP unter der Kontrolle von mehreren Gal4-Bindungsstellen (14 Tandem-UAS-Sequenzen und die basale Fisch-Promotor, E1b). Mit diesem Plasmid nur Zellen transgen exprimieren den Transkriptionsfaktor KalTA4 können GFP auszudrücken; so vermitteln gezielt die Expression von GFP.
Hinweis: hier sind wir mit Phenolrot werden zur Visualisierung der DNA-Injektionen, die Anwendung für die Ausrichtung in anderen Regionen des sich entwickelnden Gehirns sollte, solange der Region können von den Kammern abgerufen werden. Für die Ausrichtung von anderen Zelltypen, die fluoreszierende Visualisierung benötigen, könnte Bodipy oder Quantam Dot Farbstoffe potenziell zur Injektion unter fluoreszierendem Licht zu visualisieren. - Mikroinjektion Pipetten können unter Verwendung entweder eine horizontale oder vertikale Pipette puller werden. Wärme-und Pull-Stärke-Einstellungen werden je nach Art des Abzuges, die Art der Heizkörper variieren, und die Art der Glaskapillaren.
Mit einem Sutter P-30 vertikale Abzieher, verwenden Sie eine Kochstufe von 980 und einen Pull-force von 960 bis lang, konisch, scharfe Pipetten aus dünnwandigen Kapillare Borosilikat Glas mit Fäden zu erzeugen [Sutter Instrument # BF100-78 bis 10]. Microinjetion Pipetten mit diesen Einstellungen gezogen werden versiegelt und muss vor der Injektion gebrochen werden. - Verwenden Sie einen Microloader Pipettenspitze auf 1-2 ul der DNA-Plasmid-Lösung zur Injektion Pipette hinzu.
- Berg-undSicherung der geladenen Pipette in die Einspritzanlage Pipettenhalter.
- Pause wieder den geladenen Pipette mit feinen Pinzetten bis Druckimpulse aufgeblasen Freigabe der roten DNA-Lösung zu produzieren. Alternativ können die Spitzen wieder durch schnelles Eindringen in ein untergetaucht, gefaltet Labor Kimwipe gebrochen werden.
Hinweis: Da die Injektion Pipetten zunächst versiegelt und müssen manuell gebrochen zurück, werden die Düsengröße und Injektionsvolumen variabel. Ideal Injektion Pipetten sollte verlangen, 3-5 Einspritzimpulse vollständig zu füllen den Entwicklungsländern Vorderhirn Ventrikel von 24 hpf Embryonen (100 ms Einspritzimpulse bei 40 psi). - Spritzen Sie die Plasmid-DNA-Lösung in die Ventrikel des sich entwickelnden Gehirns, so dass DNA grenzt an, Zwangs-und eingelagert in die Region des Gehirns bestimmt, der Riechkolben bilden. Der Riechkolben ist aus Zellen in die Vorderwand des Vorderhirns Ventrikel abgeleitet. So kann durch Einsetzen der Injektionspipette in die Ventrikel, so dass die Pipette wird auf dem vorderen Ende des sich entwickelnden Gehirns zeigt, zwingt Druck Injektion der DNA in und neben dem Interessenten Riechkolben. Inject DNA bis rote Farbstoff ist gut sichtbar am vorderen Ende des Vorderhirns Ventrikels. Da die DNA beginnt sofort diffuse, Verdünnen der DNA, ist es wichtig, die Elektroporation Schritt so schnell wie möglich nach der Injektion (zB innerhalb von 10 sec) vor.
4. Elektroporation
- Die Elektroporation erfolgt mit selbst konstruierten Elektroden aus Platin Grass subdermale Elektroden (Grass Technologie # E2) durchgeführt. Die Elektroden sind mit einem Hand-Sonde befestigt, und die endgültige Entfernung zwischen den Platin-Elektroden sollte 1 mm (für Details auf dem Bau zu sehen 9). Square-wave Elektroporation Impulse werden durch den Anschluss der Elektroden an einem Grass SD-9 Stimulator (Grass Technology, Modell SD-9) hergestellt.
- Setzen Sie die SD-9-Stimulator zur Einzel-, 5 ms Elektroporation Impulse bei 70 Volt zu erzeugen. Position der Elektroden, so dass die positive Elektrode positioniert ist neben dem vorderen Ende des Embryos, während die negative Elektrode ist hinter dem Embryo Kopf. Manuell einleiten ~ 7-8 Elektroporation Impulse mit der Single-Mode-Schalter der SD-9-Stimulator, Trennen jeder Puls von ~ 1 sek. Entsprechende Spannungen variieren je nach Alter des Embryos und der Spannungsquelle eingesetzt. Jüngere Embryonen erfordern niedrigere Spannungen Embryo Schäden zu vermeiden, während ältere Embryonen höhere Spannungen benötigen, um Elektroporation 7 einzuleiten.
- Lassen Sie die Embryonen für mindestens 10 min nach der Elektroporation vor ihrer Befreiung aus der Agarose zu erholen.
- Mit feinen Pinzetten, kostenlos die Embryonen aus der Agarose durch vorsichtiges die Umrisse der Embryonen unter Vermeidung tatsächlichen Kontakt mit den Embryonen selbst.
- Einmal befreit, kehren die Embryonen auf Eis Wasser (PTU falls erforderlich). Halten Sie diese bei 28 ° C, bis sie für die GFP-Expression abgebildet werden sollen.
5. Montage Embryonen für die Bildgebung
- Transfer-Embryonen aus Ei Wasser plus PTU zu Ei Wasser plus 0,02% Tricaine. Lassen Sie einige Minuten, bis die Betäubung wirksam, bevor Sie fortfahren, um die Montage Schritt zu tun.
- Bereiten Sie eine 0,5% ige Lösung mit niedrigem Schmelzpunkt Agarose in Ei Wasser plus Tricaine durch microwaving die Lösung, und das Setzen der Lösung in ein 34-37 ° C Inkubator. Sobald die Temperatur der Agarose-Lösung wurde äquilibriert, statt einen großen Tropfen (~ 300 ul) der Agarose-Lösung in die Mitte einer 35 mm Petrischale. Fügen Sie einen narkotisierten Embryo zu dieser Tropfen Agarose.
- Mit feinen Pinzette (oder die feinen Enden geschnitten Microloader Pipettenspitzen), positionieren Sie den Embryonen, so dass sie aufrecht stehen, so dass es möglich, eine dorsale Ansicht des sich entwickelnden Gehirns mit einem aufrechten Mikroskop (inverted Bereiche wird eine andere Embryo Geometrie erfordern visualisieren, und ein anderes Gericht erlaubt Visualisierung von unten, siehe 12). Verfestigen sich die Agarose, indem Sie die Schale auf einer großen Petrischale mit 2-3 mm aus Eis. Re-Orientierung mit feinen Pinzetten wird wahrscheinlich während der Erstarrung benötigt werden, um sicherzustellen, dass der Embryo nicht fällt auf die Seite.
- Nach Erstarren der Agarose, Überschwemmung die Schale mit Ei Wasser plus Tricaine sicherzustellen, dass die Lösung vollständig bedeckt die erstarrte Agarose fallen.
6. Repräsentative Ergebnisse:
Obwohl die GFP-Expression bereits nach 6 Stunden nach der Elektroporation beobachtet werden kann, hier zeigen wir Bilder aus einem Embryo 4 Tage nach der Elektroporation, so dass die Neuriten Struktur der Zielzellen ausreichend entwickelt hat. Die Et (zic4: Gal4TA4, UAS: mCherry) hzm5 transgenen enhancer trap Linie zeigt die konstitutive Expression mCherry (und KalTA4) im Hinterhirn, Kleinhirn, Vorderhirn und Riechkolben in Embryonen 5 Tage nach der Befruchtung (Abb. 1A und 1C). Embryonen, die hatte einen UAS-GFP Expressionsplasmid durch gezielte Elektroporation (wie oben beschrieben), zeigen die GFP-Expression, die Zellen des sich entwickelnden Riechkolben (Abb. 1B, 1D und 1E) beschränkt ist eingebaut haben. Nur Zellen transgen-exprimierenden die KalTA4 Transkriptionsfaktor sind in der Lage, die Expression von diesem UAS-GFP-Plasmid zu aktivieren. Der Einbau von diesem Plasmid in nicht-transgenen Embryonen zu keiner nachweisbaren GFP-Expression führen. So ist es die kombinierte Wirkung von gezielten Elektroporation von UAS-GFP und lokalisierte transgene Expression der KalTA4 Treiber, der auf exklusive Expression von GFP führt in Zellen des sich entwickelnden Riechkolben. Die GFP-exprimierenden Zellen zeigen typische axonale Projektionen der Riechkolben Mitralzellen (Abb. 1B und 1D) 10. Um Axon Projektionen visualisieren, hatte Bilder in Abbildung 1B und 1D auf hohem Niveau, so dass die Region von Zellkörpern gut waren überbelichtet ausgesetzt werden. Ein niedrigerer Exposition (Abb. 1E) zeigt, dass Zellkörper, die GFP in der Tat sind die Riechkolben (vgl. Abb. 1C und 1E.; Graue Linie markiert die Grenze der Riechkolben) lokalisiert.
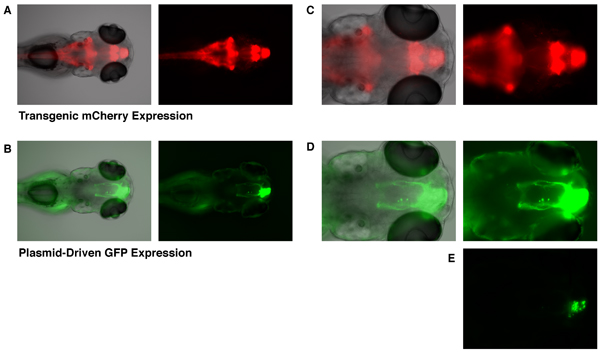
Abbildung 1. Targeted GFP-Expression in den Riechkolben eines 5 dpf Zebrafischembryo. Die Et (zic4: Gal4TA4, UAS: mCherry) hzm5 transgenen enhancer trap Linie, zeigt die konstitutive Expression mCherry im Hinterhirn, Kleinhirn, Vorderhirn und Riechkolben (A und C, mCherry Fluoreszenz in rot dargestellt). Dieser Ausdruck mCherry ist durch transgene Gal4-Expression vermittelt. Embryonen, die mit einem UAS-GFP-Expressionsvektor wurden bei 28 hpf elektroporiert, um zielgerichtet die GFP-Expression in den Riechkolben an 5 Tagen nach der Befruchtung (B, D und E, GFP-Fluoreszenz in grün dargestellt. Gleiche Embryo als in A und C). Eine geringere Belastung Bild unten (E) zeigt, dass die GFP-Expression zu Zellkörper der Riechkolben ist begrenzt. Die graue Linie zeigt die Grenze der Riechkolben. Hellfeld (Graustufen), Grün-Fluoreszenz (grün) und rote Fluoreszenz (rot) Bilder wurden alle mit einer Olympus BX60 Fluoreszenzmikroskop zu nehmen.
Diskussion
Hier haben wir eine in vivo Elektroporation beschriebenen Methode in Zebrafisch, dass ein Enhancer-trap Gal4 transgene Linie um die Expression des Transgens elektroporiert zu einer bestimmten Population von Zellen, in den Entwicklungsländern Riechkolben Ziel nutzt. Dieser Ansatz kombiniert die hervorragende zeitliche Auflösung der in vivo Elektroporation 7 mit dem Zelltyp-spezifische Expression von Enhancer-trap transgenen Linien 8 vermittelt. Obwohl hier haben wir die Ausrichtung der Riechkolben beschrieben, in vivo Elektroporation kann verwendet werden, um anderen Regionen der Entwicklung des Nervensystems 7.2 Ziel sein, und Enhancer-trap-Linien sind mit gezielten Ausdruck von Gal4 in vielen verschiedenen Zelltypen oder Gewebe zur Verfügung 8, 11. Natürlich sollten diese Elektroporation Technik auch für andere combinatioral genetische Ansätze wie die LexA oder Tet-Systeme 13, 14, 15. Ein großer Vorteil der Elektroporation ist, dass es keine zusätzlichen transgenen Linien gegeben, dass ein geeigneter Gal4-line verfügbar ist zu machen. Das spart sechs Monate.
In-vivo-Elektroporation ermöglicht die Aufnahme von Oligonukleotiden in Neuronen und deren Vorstufen auf welcher bestimmten Stadium des Nervensystems Entwicklung von Interesse 7. Diese zeitliche Auflösung ist besonders vorteilhaft für loss-of-function-Analyse, weil es Probleme mit Targeting-Gene, die wichtige Funktionen haben in früheren Entwicklungsstadien umgehen kann. Die Methode, die wir hier beschreiben, können auch verwendet werden, um loss-of-function-Reagenzien einschließlich RNAi-Oligonukleotiden oder Konstrukte und Morpholino Antisense-Oligonukleotide, 4, 7 enthalten sein. Plasmid-driven Reagenzien wie dominant-negative Protein-Expression von Plasmiden oder kurze Haarnadel-RNA-Plasmide können auch unter der Kontrolle eines Gal4 UAS platziert werden, so dass für die genaue Zelltyp-spezifische Expression haben wir hier für die Expression von GFP dargestellt.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde durch ein NIH R15 AREA gewähren John Horne (; R15MH083221 NIMH) finanziert.
Materialien
Reagenzien:
- Agarose, niedrige Schmelzpunkt (Sigma, A9414)
- Plasmid Midi-oder Maxi-Prep-Kit (zB Qiagen, # 12643]
- Phenolrot (Sigma, P3532)
Ausstattung:
- Kapillar-Glas mit Filament, ID = 0,78 mm; OD = 1,0 mm (Sutter Instruments, # BF100-78 bis 10)
- Grass SD-9 Stimulator (Grass Technology, Modell SD-9)
- Grass Platin subdermale Elektroden, gerade Nadel (Grass Technology, # E2)
- Micro-loader Pipettenspitzen (Eppendorf, # X22703R)
- Pipette Abzieher (z. B. Sutter, Modell P-30)
- Pipette Abzieher (z. B. Sutter, Modell P-30)
Referenzen
- Swartz, M., Eberhart, J., Mastick, G., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev Biol. 233, 13-21 (2001).
- Bhatt, D. H., Otto, S. J., Depoister, B., Fetcho, J. R. Cyclic AMP-induced repair of zebrafish spinal circuits. Science. 305, 254-258 (2004).
- Teh, C., Parinov, S., Korzh, V. New ways to admire zebrafish: progress in functional genomics research methodology. Biotechniques. 38, 897-906 (2005).
- Cerda, G. A., Thomas, J. E., Allende, M. L., Karlstrom, R. O., Palma, V. Electroporation of DNA, RNA, and morpholinos into zebrafish embryos. Methods. 39, 207-211 (2006).
- Hendricks, M., Jesuthasan, S. Electroporation-based methods for in vivo, whole mount and primary culture analysis of zebrafish brain development. Neural Development. 15, 2-6 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Kera, S. A., Agerwala, S. M., Horne, J. H. The temporal resolution of in vivo electroporation in zebrafish: a method for time-resolved loss-of-function. Zebrafish. 7, 97-108 (2010).
- Distel, M., Wullimann, M. F., Köster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Proc Natl Acad Sci U S A. 106, 13365-13370 (2009).
- Hoegler, K. J., Horne, J. H. Targeting the zebrafish optic tectum using in vivo electroporation. Cold Spring Harb. Protoc. , (2010).
- Nobuhiko, M., Kozo, M., Tatsuya, T., Shin-ichi, H., Hitoshi, O., Yoshihiro, Y. From the olfactory bulb to higher brain centers: genetic visualization of secondary olfactory pathways in zebrafish. J. Neurosci. 29, 4756-4766 (2009).
- Davison, J. M., Akitake, C. M., Goll, M. G., Rhee, J. M., Gosse, N., Baier, H., Halpern, M. E., Leach, S. D., Parsons, M. J. Transactivation from Gal4-VP16 transgenic insertions for tissue-specific cell labeling and ablation in zebrafish. Developmental Biology. , 304-811 (2007).
- Distel, M., Kö, s. t. e. r., W, R. in vivo time-lapse imaging of zebrafish embryonic development. CSH Protocols. , (2007).
- Emelyanov, A., Parinov, S. Mifepristone-inducible LexPR system to drive and control gene expression transgenic zebrafish. Developmental Biology. 320, 113-121 (2008).
- Knopf, F., Schnabel, K., Haase, C., Pfeifer, K., Anastassiasdis, K., Weidinger, G. Dually inducible TetON systems for tissue-specific conditional gene expression in zebrafish. PNAS. , 107-10 (1993).
- Zhu, P., Narita, Y., Bundschuh, S. T., Fajardo, O., Schärer, Y. P., Chattopadhyaya, B., Bouldoires, E. A., Stepien, A. E., Deisseroth, K., Arber, S., Sprengel, R., Rijli, F. M., Friedrich, R. W. Optogenetic Dissection of Neuronal Circuits in Zebrafish using Viral Gene Transfer and the Tet System. Front Neural Circuits. 3, 21-21 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten