Method Article
Del ratón en el útero de electroporación: Transefection controlada Gene espacio-temporal
En este artículo
Resumen
Un método de transferencia de genes en el cerebro del ratón en desarrollo se describe mediante el uso de un método único quirúrgica y la forma especial de los electrodos. Esta técnica única permite la transfección de ADN de plásmido temporal y espacialmente, lo que ayudará a muchos neurocientíficos en el estudio de desarrollo del cerebro.
Resumen
A fin de comprender la función de los genes expresados en la región específica del cerebro en desarrollo, incluyendo las moléculas de señalización y las moléculas axón orientación, la transferencia de genes locales o knock-out es obligatorio. La orientación de genes knock-in o knock-out en las regiones locales es posible llevar a cabo con la combinación con una línea específica CRE, que es laborioso, costoso y consume mucho tiempo. Por lo tanto, un método de transfección simple, una técnica en el útero de la electroporación, que se puede realizar con poco tiempo, será muy útil para probar la posible función de los genes candidatos antes de la generación de 1,2 animales transgénicos. Además de esto, en el útero de la electroporación se enfoca en áreas del cerebro donde no existe línea específica CRE, y limitará la letalidad embrionaria 3,4. A continuación, presentamos un método de electroporación en el útero la combinación de dos tipos diferentes de electrodos para la transferencia génica simple y conveniente en las zonas objetivo de desarrollo del cerebro. En primer lugar, la celebración de un método único de embriones mediante un cable de fibra óptica de luz fría hará que los embriones pequeños (a partir de E9.5) visible de inyección dirigida solución de ADN en los ventrículos y el tipo de aguja electrodos de inserción para el área del cerebro dirigido 5,6. El patrón del cerebro tales como el área cortical se producen en la etapa embrionaria, por lo tanto, estos principios de la electroporación de E9.5 hacer una gran contribución para comprender los patrones de eventos toda la zona. En segundo lugar, la forma precisa de un capilar previene el daño del útero, haciendo agujeros mediante la inserción de los capilares. Además, la forma precisa de los electrodos de aguja se crean con el tungsteno y el alambre de platino y afilado con papel de lija y aislados con esmalte de uñas 7, un método que se describe en detalle en este protocolo. Esta técnica única permite la transfección de ADN plásmido en las áreas restringidas del cerebro y permitirá a los embriones pequeños para ser electroporación. Esto ayudará a, abra una ventana nueva para muchos científicos que están trabajando en la diferenciación celular, la migración celular, para guía de axones en fase embrionaria muy temprana. Además, esta técnica permitirá a los científicos para transfectar ADN plásmido en las partes profundas del cerebro en desarrollo, como el tálamo y el hipotálamo, donde muchos no específicos de la región las líneas de CRE existen para ganancia de función (GOF) o pérdida de la función (LOF), analiza.
Protocolo
1. Preparación de la solución capilar y de ADN para la inyección
- Purificar el ADN plásmido con un Maxi-prep o método equivalente, y hacer una concentración final de 2.3 mg / l. Alícuota de 100 ug de ADN, añadir 10μl de tinte verde rápido (1% de acciones) y TE (10 mM Tris base, 1 mM EDTA, pH 8.0) y ajustar un volumen de 100 l para la concentración final de ADN para la mezcla de la inyección de 1 g / l. La concentración de ADN del plásmido se puede cambiar depende del tamaño de un plásmido, y también su eficiencia de transfección, que debe ser evaluado individualmente.
- Haga girar la solución de ADN durante 5 minutos a 14.000 rpm a temperatura ambiente y recoger el líquido sobrenadante para eliminar cualquier residuo.
- Tirar de un capilar de vidrio de tubos de vidrio tubea capilar mediante un extractor de micropipeta. Pellizcar la punta con una pinza para que la punta tiene un diámetro de 20-30 micras. De 800 m-1 mm de la punta y comprobar el diámetro exterior es inferior a 60 micras (Fig. 1A).
- Conecte el capilar para el micromanipulador, y rellenar con aceite mineral. Para llenar el capilar con la solución de ADN, sumergir la punta en la solución y aspirar la solución de ADN.
2. Palo electrodos de platino
Aquí usamos electrodos revestidos de platino (Nepe gen, CUY611P2-1) para electroporar en la región superficial del cerebro, tales como la corteza (Fig. 1F).
3. Preparación de micro-electrodos
El uso de micro-electrodos en electroporated en partes profundas del cerebro (es decir, el tálamo y el hipotálamo) (Fig. 2B-E).
- Un extremo del tungsteno (para los electrodos negativos) y platino (para electrodos positivos) se enrolla en alambres dorados alfileres y se fija con parafilm. Inserte el cable a la madre de un hisopo de algodón y envolver los dos extremos con parafina (Fig. 1B).
- Uniformemente afilar la punta del alambre con papel de lija hasta que llega a 20-30 m de diámetro exterior y 60 m de 800 m-1 mm de la punta (Fig. 1C y D).
- Aplicar una fina capa de esmalte de uñas con el cable para el aislamiento. Después de que el esmalte se haya secado, use un hisopo de algodón empapado en acetona para quitar de la punta (unos 200 m de la punta). Nota importante: Con el fin de evitar daños en el útero del ratón, la parte de dentro de 800 m-1 mm de la punta no debe ser mayor de 70 micras de diámetro (Fig. 1E).
4. Preparación de la cirugía
- Anestesiar a un ratón embarazadas (E9.5-E15.5). Demostramos anestesia con grado farmacéutico pentobarbital sódico (Cuadro II, 50 microgramos por gramo de peso corporal, por vía intraperitoneal se inyectan y esperar 5 min). Alternativas al pentobarbital sódico como anestésico incluyen la inyección de ketamina / xilazina o anestésicos gas (gas es preferible para los procedimientos de corta duración). La inyección se debe hacer con atención para evitar que cualquiera de los órganos, de lo contrario será causa de daños en el útero o matar a los animales. Cuando la propiedad intelectual se lleva a cabo con éxito, la tasa de supervivencia es superior al 95%. Asimismo, la cirugía se puede realizar al aire libre en el medio ambiente. Antes de iniciado el funcionamiento, prueba de la falta de respuesta por parte del animal a pellizcar sus dedos para confirmar la anestesia.
- Afeitar el vello del abdomen con una cuchilla de afeitar y un 50% EtOH. Preparar la piel con la alternancia de matorrales de Betadine y alcohol (70%).
- Hacer una incisión en la línea media abdominal con tijeras finas y sacar todos los cuernos uterinos con cuidado en un 37 ° C precalentado tampón fosfato salino (PBS) una gasa humedecida de algodón, que se coloca alrededor de la herida. Mantener la humedad del útero con PBS todo el tiempo.
- Mantenga un cable flexible de fibra óptica entre los dedos índice y medio y lo coloca en el cuerno uterino. Cable limpio con EtOH al 70% antes de su uso. No microscopio o lupa es necesario para la visualización. Posición del útero entre el cable de luz de fibra óptica óptica y el pulgar, y apretar suavemente para empujar hacia arriba el embrión más cercano a la pared uterina.
5. La inyección de ADN y la electroporación
- Al embrión se coloca, inserte con cuidado capilar de vidrio en el ventrículo objetivo e inyectar aproximadamente 1 l de solución de ADN (Fig. 2A).
- Para la electroporación a la parte superficial de la brainIf usar con electrodos de platino palo para electoporation, colocar los electrodos fuera del útero y aplicar sugerido de onda cuadrada de impulsos de corriente de acuerdo a las instrucciones de fabricación (Tabla I). Si electroporación usingFor a una mayor parte del cerebro, la electroporación nmicro, electrodos Eedle tipo se utilizan. Iinsert un electrodo de tungsteno bien negativos en el ADN inyectado ventrículo y un electrodo de platino en el útero y la región de destino entre dos electrodos, a continuación, aplicar sugerido de onda cuadrada de impulsos de corriente (Tabla I) (Fig. 2B).
6. Después de la electroporación
- Vuelva a colocar el cuerno uterino en su origubicación con INAL y añadir 500 l de 37 ° C pre-calentado PBS.
- Suturar la capa interna de sutura quirúrgica y la capa externa cercano con una 9 mm clip de autoclipauto.
- Animales a cabo en un cojín de la calefacción durante 2 horas para permitir la recuperación de la anestesia. Analgésicos como el carprofeno o buprenorfina puede ser administrada para el dolor post-operatorio.
7. Los resultados representativos:
Algunos ejemplos de electroporación cortical de pCAG-EYFP construir con electrodos revestidos de platino en diferentes puntos de tiempo se muestra en la figura Figura 32. Los cerebros son electroporated en E13.5, E14.5 y E15.5, y se cosecha en el día postnatal (P) 6. AEl tinción ntibody de RORC muestra la posición de la capa 4 y la posición de las células transfectadas EYFP son reveladas por tinción de anticuerpos GFP, y ambas imágenes son superpuestas (Fig. 3 A y B). Etiquetados células corticales son capa de células corticales electroporación es claramente diferente en cada experimento (Fig. 32), lo que sugiere que dependen del tiempo de electroporación hace cortical capa específica de GOF / LOF posible.
La viabilidad de los embriones y la eficiencia de la transfección de células varía en función de la edad del embrión y la ubicación de la electroporación. Las muestras se muestran en la Tabla 1, sin embargo, las condiciones deben ser optimizados para cada electroporación dependiendo de la etapa y la parte del cerebro.
Electroporación en un tejido profundo, como el tálamo y el hipotálamo con el uso de electrodos revestidos de platino a menudo dan de baja eficiencia (Tabla 1). Este problema se puede resolver mediante el uso de micro-electrodos whichelectrodes, que llegará a las partes profundas del cerebro. Figura 3 4 ejemplo muestra de pCAG-EYFP electroporación en el diencéfalo en desarrollo. Solución de ADN plásmido se inyecta en el ventrículo 3 º en E11.5 y seguido por micro electroporación (Fig. 3C4C). El área está limitada por electroporación en el tálamo, donde la mayoría de los proyectos axones a la corteza (Fig. 3B4B). Proyección axonal al nivel 4 de la corteza también puede ser visualizado por EYFP, que fillesfills a toda la neurona. (Fig. 3A4A).
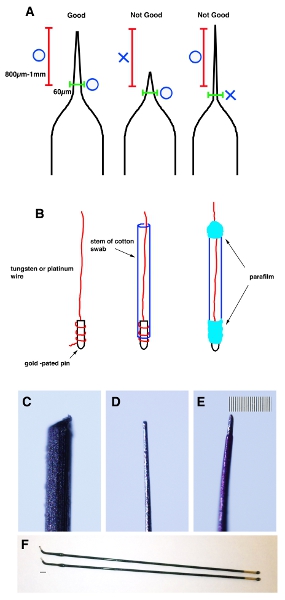
Figura 1. Esquema de dibujos animados que demuestran la forma correcta de los capilares. (A) Un tubo capilar de vidrio se tira con un extractor micropipeta para hacer cierta forma. Un consejo es fuera aplastado por unas pinzas para que sea 20-30 micras. De 800 m-1 mm de la punta (el soporte de color rojo) y asegúrese de que el diámetro exterior es inferior a 60 micras (soporte de color verde). (B) Un extremo del tungsteno o alambres de platino se enrolla sobre chapado en oro alfileres y se fija con parafilm. A continuación, utilice papel de lija para que su punta para convertirse en diámetros de 20 a 30 micras externa y 60 micras de 1 mm de la punta. (C) Imagen del alambre de tungsteno antes de darles forma. (D) de la imagen del alambre de tungsteno después de darles forma. (E) de la imagen del alambre de tungsteno después de aplicar la capa delgada de esmalte de uñas. Barra de escala en E es de 10 micras (más pequeño) de la CE. (F) Electrodos de platino (gen Nepa. CUY611P2-1). Barra de escala en la F es de 2 mm.
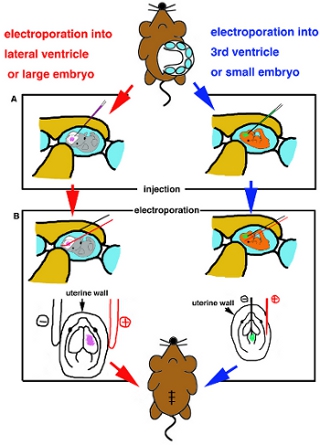
Figura 2. Caricatura esquema de procedimiento quirúrgico. (A) Diagrama de la inyección en el ventrículo lateral o embriones de gran tamaño (lado izquierdo) y en 3 º ventrículo o embriones pequeños (lado derecho). (B) Diagrama de electrporation por electrodo de platino palo (lado izquierdo) y por la aguja del electrodo tipo (lado derecho).
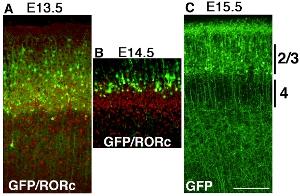
Figura 3. Desarrollo de ratón telencéfalo se electroporated con pCAG-EYFP en E13.5 (A), E14.5 (B) y E15.5 (C) y se cosecha a P6. Los cerebros fueron seccionados coronal y se tiñeron con anticuerpos GFP o un anticuerpo RORC por separado y las imágenes se funden. (A) Electroporación de pCAG-EYFP plásmido en E13.5 transfectar muchos de 4 capas de neuronas. que se superponen con una capa de 4 marcadores RORC. (B) Electroporación de pCAG-EYFP plásmido en las células E14.5 transfectar, que son más superficiales que la capa 4 neuronas. (C) E15.5 electroporación etiqueta de muchas neuronas superficial como la capa 2 / 3. Barra de escala 200 micras.
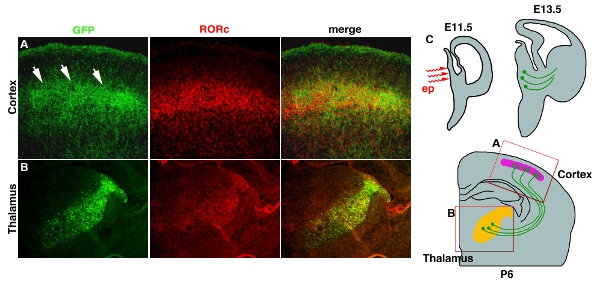
Figura 4. Transfección de EYFP en los axones tálamo-corticales (TCA). (A) terminal de TCA en la capa cortical 4 se pone de manifiesto mediante la tinción de anticuerpos GFP. Tinción RORC anticuerpos se utiliza para mostrar una posición de la capa 4. Ambas imágenes están tomadas de la misma sección y se fusionaron. (B) Posición de la electroporación en el tálamo también se muestra en la tinción de anticuerpos GFP y la tinción de RORC, cuya expresión está restringida en el tálamo 11. (C) Diagrama de dibujos animados para la electroporación y la proyección del tálamo TCA se muestran. Barra de escala 200 micras.
Discusión
En este protocolo, sólo se describen los beneficios de la técnica de la transfección pCAG-EYFP en la zona restringida de un pequeño cerebro de embriones utilizando diferentes electrodos en forma. Para la comparación de la eficiencia de transfección por el promotor diferente se ha descrito antes, lo que demuestra la especificidad de células tipo 1. Sin embargo, existen limitaciones para la técnica, tales como la transfección es transitorio y varía depende del plásmido, que no tiene ningún tipo de especificidad celular y es difícil controlar el número de células transfectadas. ThereforeHowever, la combinación de este protocolo con otras técnicas aún más las posibilidades de ofrecer diferentes métodos de manipulación. En primer lugar, la incorporación de promotor de células específicas en el ADN de plásmido permite la transfección de células de tipo específico, como neuronas, células gliales y astrocitos. En segundo lugar, ya que la transfección es transitorio, no es adecuado para los científicos que quieren analizar la función del gen en la vida posterior. Por lo tanto, la combinación con una transposasa para hacer el ADN plásmido integrarse en el genoma va a convertir en una transfección estable 8. Adopción que viene, de la tet-on o sistema tet-off será posible manipular el timing o tipo de células específicas de expresión génica en las células neuronales 8. Alternativamente, se puede combinar este protocolo con el tamoxifeno-inducible Cre-ER (T) recombinasas 9 y ratones reportero de 10.
Esta amplia accesibilidad de los tejidos drásticamente cambian los diseños experimentales utilizados en la neurociencia.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por RIKEN Brain Science Institute (BSI), Programa de Ciencias Humanas Frontera (HFSP) (adjudicado a TS) y RIKEN Programa de Investigación Asociado Juvenil (JRA, adjudicado a MK) RIKEN Brain Science Institute (BSI), Programa de Ciencias Humanas Frontera (HFSP) (adjudicado a TS) y RIKEN de Investigación Programa Junior Associate (JRA, adjudicado a MK) financió este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| tungsteno diámetro del alambre desnudo 125 m | Sistemas AM | 797600 | |
| platino desnuda diámetro del alambre de 125 micras | Sistemas AM | 767000 | |
| Electrodos revestidos | Nepa gen | CUY610P4-1 | |
| capilar de vidrio del tubo | Stoelting | 50611 | |
| micromanipulador | KD Científico | KDS310 | |
| tijeras | Roboz | RS-5865 | |
| generador de impulsos | AM Sistemas | Modelo 2100 | |
| 9 mm autoclip | Roboz | RS-9260 | |
| chapado en oro alfileres | WPI | 5482 | |
| RORC anticuerpos | Perseo Proteómica | H3925 |
Referencias
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Kataoka, A., Shimogori, T. Fgf8 controls regional identity in the developing thalamus. Development. 135, 2873-2881 (2008).
- Imayoshi, I., Shimogori, T., Ohtsuka, T., Kageyama, R. Hes genes and neurogenin regulate non-neural versus neural fate specification in the dorsal telencephalic midline. Development. 135, 2531-2541 (2008).
- Shimogori, T., Banuchi, V., Ng, H. Y., Strauss, J. B., Grove, E. A. Embryonic signaling centers expressing BMP, WNT and FGF proteins interact to pattern the cerebral cortex. Development. 131, 5639-5647 (2004).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development Growth & Differentiation. 50, 499-506 (2008).
- Takahashi, Y., Watanabe, T., Nakagawa, S., Kawakami, K., Sato, Y. Avian Embryology. Methods in Cell Biology. Vol 87, 271-271 (2008).
- Feil, R. Ligand-activated site-specific recombination in mice. Proceedings of the National Academy of Sciences of the United States of America. 93, 10887-10890 (1996).
- Indra, A. K. Temporally-controlled site-specific mutagenesis in the basal layer of the epidermis: comparison of the recombinase activity of the tamoxifen-inducible Cre-ERT and Cre-ERT2 recombinases. Nucleic Acids Research. 27, 4324-4327 (1999).
- Nakagawa, Y., O'Leary, D. D. M. Dynamic patterned expression of orphan nuclear receptor genes ROR alpha and ROR beta in developing mouse forebrain. Developmental Neuroscience. 25, 234-244 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados