Method Article
Мышь В утробе матери Электропорация: Пространственно-временные Контролируемые трансфекции генов
В этой статье
Резюме
Метод переноса генов в развивающихся мозга мыши описывается с помощью уникальных хирургических методов и специальной формы электродов. Эта уникальная технология позволяет трансфекции ДНК плазмиды во времени и пространстве, которое поможет многим нейробиологи при изучении развития мозга.
Аннотация
Для того чтобы понять функции генов выражается в конкретном регионе развивающегося мозга, в том числе сигнальных молекул и молекул аксон руководство, местные передачи гена или нокаут не требуется. Гена ориентации нокаут или нокаут в локальных областях можно выполнять с сочетании с конкретной линии CRE, который является трудоемким, дорогостоящим и трудоемким. Таким образом, простой метод трансфекции, внутриутробно электропорации техника, которая может быть выполнена с коротким временем, будет удобно для проверки возможной функции генов-кандидатов до поколение трансгенных 1,2 животных. В дополнение к этому, внутриутробно электропорации цели областях мозга, где нет определенной линии CRE существует, и будет ограничивать эмбриональной летальности 3,4. Здесь мы представляем метод внутриутробной электропорации объединения двух различных типов электродов для простого и удобного переноса генов в целевых районах развивающегося мозга. Во-первых, уникальная методика проведения эмбрионов использованием оптического волокна оптического кабеля свет будет делать небольшие эмбрионы (от E9.5) видимый для целевых раствор для инъекций ДНК в желудочки и иглу типа электродов вставки в целевой области мозга 5,6. Структурирование мозга, таких как области коры происходят на ранней эмбриональной стадии, таким образом, эти ранние электропорации от E9.5 сделать большой вклад для понимания всего события структурирование области. Во-вторых, точную форму капиллярной предотвращает повреждение матки, делая отверстия путем включения капилляра. Кроме того, точную форму игольчатых электродов создаются с вольфрамом и платиновой проволоки и заостренным использованием наждачной бумагой и изолированные лаком для ногтей 7, метод, который описан в деталях в этом протоколе. Эта уникальная технология позволяет трансфекции ДНК плазмиды в запретные зоны головного мозга и позволят малым эмбрионов для электропорации. Это поможет, откройте новое окно для многих ученых, которые работают на клеточной дифференцировки, миграции клеток, аксонов руководство в очень ранней эмбриональной стадии. Более того, этот метод позволит ученым для трансфекции ДНК плазмиды в глубоких частях развивающегося мозга, таких как таламус и гипоталамус, где не так много по конкретным регионам CRE линии существуют для усиления функции (GOF) или потеря функции (LOF) анализы.
протокол
1. Подготовка капиллярного и ДНК раствора для инъекций
- Purify плазмидной ДНК с Maxi-приготовительные или эквивалентного метода, и сделать конечной концентрации 2-3 мкг / мкл. Алиготе 100 мкг ДНК, добавить 10 мкл быстрого зеленого красителя (1% акций) и TE (10 мМ Трис базы, 1мМ раствором ЭДТА, рН 8,0) и регулировать громкость до 100 мкл, чтобы конечная концентрация ДНК для инъекций смеси до 1 мкг / мкл. Концентрация плазмидной ДНК может быть изменена в зависимости от размера плазмиды, а также ее эффективность трансфекции, которая нуждается в проверке в индивидуальном порядке.
- Спиновые раствора ДНК в течение 5 минут при 14000 оборотов при комнатной температуре и собирают супернатант, чтобы удалить остатки.
- Вытяните стеклянный капилляр стеклянная tubea капилляров использованием съемника микропипетки. Повышение от кончика щипцами, чтобы наконечник имеет диаметр 20-30 мкм. Мера 800 мкм-1 мм от кончика и проверить наружным диаметром менее 60 мкм (рис. 1А).
- Подключение к капиллярной микроманипулятора, и заполнить с минеральным маслом. Для заполнения капилляра с ДНК решение, погрузите наконечник в растворе и всасывать раствор ДНК.
2. Придерживайтесь платиновыми электродами
Здесь мы использовали палки платиновыми электродами (Nepe гена, CUY611P2-1) к electroporate на поверхностную область мозга, таких как кора головного мозга (рис. 1е).
3. Подготовка микро-электродов
Использование микро-электроды для электропорации в глубокие отделы мозга (например, таламуса и гипоталамуса) (рис. 2, б-E).
- Один конец вольфрама (для отрицательных электродов) и платины (для положительных электродов) провода наматывается на позолоченных контактов и фиксируется парафильмом. Вставьте провод в стебель ватный тампон и оберните оба конца с парафильмом (рис. 1В).
- Равномерно заострить кончик провода с наждачной бумагой, пока не достигнет 20-30 мкм и внешним диаметром 60 мкм от 800 мкм-1 мм жала (рис. 1С и D).
- Нанесите тонкий слой лака для ногтей, чтобы провода для изоляции. После лак высохнет, используйте ацетон пропитанной ватный тампон, чтобы удалить его из наконечника (около 200 мкм от вершины). Важное примечание: Для того, чтобы предотвратить повреждение матки мыши, часть в пределах 800 мкм-1 мм жала должна быть не более 70 мкм в диаметре (рис. 1E).
4. Подготовка операции
- Обезболить беременной мыши (E9.5-E15.5). Мы демонстрируем обезболивания с фармацевтического класса натрия фенобарбитала (табл. II, 50 мкг на грамм массы тела, вводят внутрибрюшинно и подождать в течение 5 мин). Альтернативы натрия фенобарбитала в качестве анестезирующего средства включают кетамин / Ксилазин инъекции анестетиков или газа (газ является предпочтительным для коротких процедур продолжительности). Инъекции должно быть сделано с вниманием, чтобы избежать любых органов, в противном случае это вызовет повреждения матки или убить животное. В случае успеха IP не будет сделано, выживаемость составляет более 95%. Кроме того, операция может быть выполнена в открытой среде. До начала операции, тест на отсутствие реакции животного на ущемление своих ног, чтобы подтвердить анестезии.
- Бритье волос с использованием живот лезвием и 50% этанола. Обработайте кожу скрабы с чередующимися по бетадин и алкоголь (70%).
- Сделайте разрез в брюшной средней линии с тонкой ножницы и вытащить все рогов матки внимательно на 37 ° C подогретого фосфатным буферным раствором (PBS) увлажненных хлопка марли, которая размещена вокруг раны. Держите матки с влажным PBS все время.
- Держите гибкий волоконно-оптический кабель между указательным и средним пальцами и поместите ее под рога матки. Чистая кабель с 70% этанолом до начала использования. Нет микроскопа или лупы требуется для визуализации. Положение матки между оптического волокна света оптического кабеля и большой палец, и сожмите мягко подтолкнуть вверх эмбриона ближе к стенке матки.
5. Введение ДНК и электропорация
- Когда эмбрион позиционируется, вставьте стеклянный капилляр тщательно в целевые желудочка и ввести около 1 мкл раствора ДНК (рис. 2).
- Для электропорации для поверхностной части brainIf использования с палкой платиновых электродов для electoporation, место электроды вне матки и применять предложили прямоугольные импульсы тока в соответствии с инструкцией завода-изготовителя (см. таблицу). Если usingFor электропорации в более глубокие части мозга, nmicro электропорация, eedle электроды типа используются. Iinsert тонкой вольфрамовой отрицательного электрода в ДНК вводят желудочка и платинового электрода в полость матки и области места целевой между двумя электродами, а затем применить предложили прямоугольные импульсы тока (табл. I) (рис. 2б).
6. Сообщение электропорации
- Место матки назад рога в оригиналеИнал месте с и добавить 500 мкл 37 ° C подогретого PBS.
- Шовный внутренний слой с хирургическим швом и закрыть наружный слой с 9 мм клипа autoclipauto.
- Место животных на грелку на 2 часа, чтобы восстановление после наркоза. Обезболивающие препараты, такие как carprofen или бупренорфина могут быть введены для послеоперационной боли.
7. Представитель результаты:
Некоторые примеры корковых электропорации pCAG-EYFP построить с помощью электродов палку платины в различные моменты времени показаны на рисунке Рисунок 32. Мозг электропорации на E13.5, E14.5 и E15.5, а собирают в послеродовой день (Р) 6. AThe ntibody окрашивание RORC показывает положение слоя 4 и положение EYFP трансфекции клетки выявляются путем окрашивания антител GFP, и оба изображения являются супер, введенных (рис. 3А, Б). Маркированный корковые клетки слой клеток коры электропорации, безусловно, отличается в каждом эксперименте (рис. 32), что свидетельствует о зависящих от времени делает электропорации коркового слоя конкретных GOF / LOF возможно.
Жизнеспособность эмбрионов и эффективность клеточной трансфекции варьируется в зависимости от возраста эмбриона и расположение электропорации. Образцы, перечислены в таблице 1, однако, условия должны быть оптимизированы для каждого электропорации в зависимости от стадии и часть мозга.
Электропорация в глубоких тканей, таких как таламуса и гипоталамуса с помощью электродов палку платины часто дают низкую эффективность (табл. 1). Эта проблема может быть решена с помощью микро-электродов whichelectrodes, которая дойдет до глубоких частях мозга. Рисунок 3 4 показывает пример pCAG-EYFP электропорации в развивающихся промежуточного мозга. Плазмиды решение ДНК вводится в 3-й желудочек на E11.5 и следуют микро электропорации (рис. 3C4C). Электропорации область ограничена в таламус, где большая часть проекта аксоны в кору головного мозга (рис. 3B4B). Axon проекции на слой 4 из коры также может быть визуализированы EYFP, который fillesfills копию всего нейрона. (Рис. 3A4A).
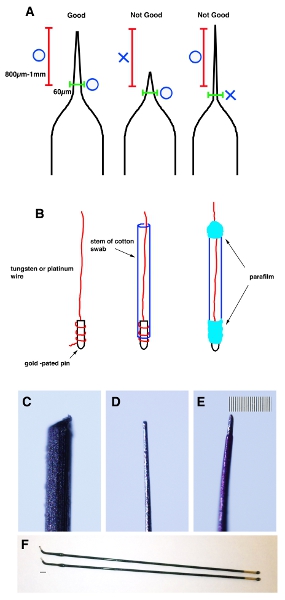
Рисунок 1. Мультфильм схема демонстрирует правильную форму капилляра. () Стеклянный капилляр тянут использованием съемника микропипетки, чтобы сделать определенную форму. Наконечник от ущипнул от щипцов, чтобы сделать его 20-30 мкм. Мера 800 мкм-1 мм от кончика (красная скобка) и убедитесь, что внешний диаметр менее 60 мкм (зеленый кронштейн). (B) Один конец вольфрама или платины провода наматывается на позолоченных контактов и фиксируется парафильмом. Затем с помощью наждачной бумагой, чтобы сделать их кончик, чтобы стать 20-30 мкм наружным диаметром до 60 мкм от 1 мм от кончика. (C) Изображение вольфрамовой проволоки до формирования. (D) Изображение вольфрамовой проволоки после формирования. (Е) Изображение вольфрамовой проволоки после нанесения тонким слоем лака для ногтей. Шкала бар в E составляет 10 мкм (небольшом масштабе) для CE. (F) Stick платиновыми электродами (Непско гена. CUY611P2-1). Шкала бар в F 2 мм.
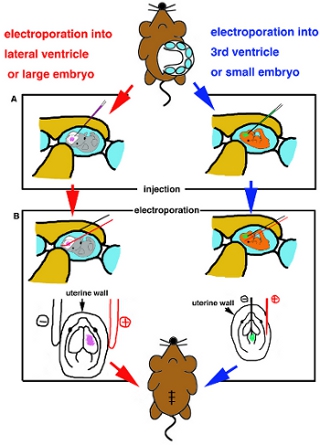
Рисунок 2. Мультфильм схемы хирургической процедуры. (А) Схема инъекции в боковой желудочек или большой эмбрионов (слева) и на 3-й желудочек или небольшие эмбрионы (правая сторона). (B) Схема electrporation платиновой штучным электродом (слева) и иглой типа электрода (правая сторона).
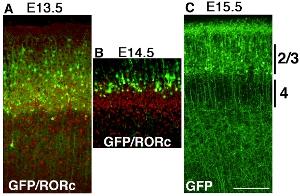
Рисунок 3. Разработка конечного мозга мыши был электропорации с pCAG-EYFP на E13.5 (А), E14.5 (Б) и E15.5 (С) и собирают в P6. Мозги были секционного корональных и окрашенных GFP антител или антител RORC отдельно и образы сливаются. (А) электропорации pCAG-EYFP плазмиды в E13.5 трансфекции многих слой 4 нейронов. которые пересекаются с уровня 4 маркеров RORC. (B) электропорации pCAG-EYFP плазмиды в E14.5 трансфекции клеток, которые являются более поверхностными, чем слой 4 нейронов. (C) E15.5 электропорации этикетке многие поверхностные нейронов, таких как слой 2 / 3. Шкала бар 200 мкм.
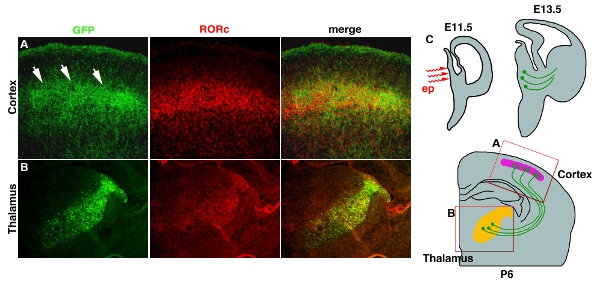
Рисунок 4. Трансфекция EYFP в таламо-кортикальной аксонов (TCA). (А) TCA вокзал коркового слоя 4 раскрывается путем окрашивания антител GFP. RORC антител окрашивания используется, чтобы показать положение слоя 4. Оба изображения взяты из той же раздел и объединены. (B) Статус электропорации в таламус также свидетельствует GFP использованием меченых антител и RORC окрашивание, которое выражение ограничено в таламус 11. (C) Мультфильм схема для таламуса электропорации и TCA проекции показано на рисунке. Шкала бар 200 мкм.
Обсуждение
В этом протоколе, мы только описал преимущества техники pCAG-EYFP трансфекции в зоне ограниченного небольшим эмбрионального мозга с помощью электродов различной формы. Для сравнения эффективности трансфекции различных промоутер описано ранее, что свидетельствует о типе клеток специфика 1. Однако Есть ограничения для техники, такие как трансфекции только преходящими и варьируется в зависимости от плазмиды, он не имеет любую ячейку специфику, и трудно контролировать количество трансфекции клеток. ThereforeHowever, совмещая этот протокол с другими методами будет и далее предоставлять возможности для различных методов манипуляций. Во-первых, включение конкретной ячейке промоутер в плазмидной ДНК позволит камерного типа конкретных трансфекции, такие как нейроны, глиальные клетки и астроциты. Во-вторых, после трансфекции является временным, оно не подходит для ученых, которые хотят, чтобы проанализировать функции генов в дальнейшей жизни. Таким образом, вместе с транспозазы сделать ДНК плазмиды интегрироваться в геном будет конвертировать ее в стабильной трансфекции 8. Далее, принятие тет-на или тет-офф Система позволит манипулировать времени или типа клеток конкретных экспрессии генов в нервные клетки 8. Кроме того, можно объединить этот протокол с тамоксифеном-индуцируемых Cre-ER (T) рекомбиназ 9 и репортер мышей 10.
Эта широкая доступность тканей коренным образом изменится экспериментальные образцы, используемые в неврологии.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансировалась RIKEN мозга Science Institute (BSI), Human Программа научно-границы (HFSP) (присуждена ТС) и RIKEN младший научный сотрудник программы (ЮРА, присуждена MK) RIKEN мозга Science Institute (BSI), Human Программа научно-Пограничный (HFSP) (присуждена ТС) и RIKEN младший научный сотрудник программы (ЮРА, присуждена М. К.), финансируемых эту работу.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| голые диаметр вольфрамовой проволоки 125 мкм | AM системы | 797600 | |
| голые диаметр проволоки платины 125 мкм | AM системы | 767000 | |
| Электроды | Непско гена | CUY610P4-1 | |
| стеклянная капиллярная трубка | Stoelting | 50611 | |
| микроманипулятор | К. Д. Научные | KDS310 | |
| ножницы | ROBOZ | RS-5865 | |
| импульсный генератор | Системы AM | Модель 2100 | |
| 9 мм autoclip | ROBOZ | RS-9260 | |
| позолоченные контакты | WPI | 5482 | |
| RORC антител | Персей протеомики | H3925 |
Ссылки
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Kataoka, A., Shimogori, T. Fgf8 controls regional identity in the developing thalamus. Development. 135, 2873-2881 (2008).
- Imayoshi, I., Shimogori, T., Ohtsuka, T., Kageyama, R. Hes genes and neurogenin regulate non-neural versus neural fate specification in the dorsal telencephalic midline. Development. 135, 2531-2541 (2008).
- Shimogori, T., Banuchi, V., Ng, H. Y., Strauss, J. B., Grove, E. A. Embryonic signaling centers expressing BMP, WNT and FGF proteins interact to pattern the cerebral cortex. Development. 131, 5639-5647 (2004).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development Growth & Differentiation. 50, 499-506 (2008).
- Takahashi, Y., Watanabe, T., Nakagawa, S., Kawakami, K., Sato, Y. Avian Embryology. Methods in Cell Biology. Vol 87, 2nd Edition, Elsevier Academic Press Inc. 271-271 (2008).
- Feil, R. Ligand-activated site-specific recombination in mice. Proceedings of the National Academy of Sciences of the United States of America. 93, 10887-10890 (1996).
- Indra, A. K. Temporally-controlled site-specific mutagenesis in the basal layer of the epidermis: comparison of the recombinase activity of the tamoxifen-inducible Cre-ERT and Cre-ERT2 recombinases. Nucleic Acids Research. 27, 4324-4327 (1999).
- Nakagawa, Y., O'Leary, D. D. M. Dynamic patterned expression of orphan nuclear receptor genes ROR alpha and ROR beta in developing mouse forebrain. Developmental Neuroscience. 25, 234-244 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены