Method Article
Maus in Utero Elektroporation: Kontrollierte Spatiotemporal Gene Transefection
In diesem Artikel
Zusammenfassung
Ein Gentransfer-Methode in den Entwicklungsländern Gehirn der Maus ist mit einer einzigartigen chirurgischen Verfahren und spezielle Form der Elektroden beschrieben. Diese einzigartige Technik erlaubt die Transfektion von Plasmid-DNA zeitlich und räumlich, was viele Neurowissenschaftler in das Studium der Entwicklung des Gehirns wird die Beihilfe.
Zusammenfassung
Um zu verstehen, die Funktion von Genen in bestimmten Regionen des sich entwickelnden Gehirns, einschließlich Signalmolekülen und Axon Führung Moleküle, lokale Gentransfer oder Knock-out ist erforderlich, zum Ausdruck gebracht. Gene targeting knock-in oder Knock-out in die lokalen Regionen möglich ist, mit Kombination mit einer bestimmten CRE Linie, die mühsam, kostspielig ist, und zeitaufwändig durchzuführen. Daher wird eine einfache Transfektion Methode, eine in utero Elektroporation Technik, die mit kurzen Zeit durchgeführt werden kann, sehr nützlich sein, um die mögliche Funktion der Kandidatengene vor der Erzeugung von transgenen Tieren 1,2 zu testen. Zusätzlich zu dieser, in utero Elektroporation Ziele Bereichen des Gehirns, wo keine besonderen CRE Linie existiert und wird begrenzt embryonalen Letalität 3,4. Hier präsentieren wir eine Methode, in utero Elektroporation Kombination von zwei verschiedenen Arten von Elektroden für die einfache und bequeme Gentransfer in Zielgebieten des sich entwickelnden Gehirns. Zunächst wird eine einmalige Beteiligung Methode von Embryonen mit Hilfe eines optischen Lichtleiter-Kabel machen kleine Embryonen (von E9.5) sichtbar für die gezielte DNA-Lösung Injektion in Ventrikel und Nadel-Typ Elektroden Einsetzen der gezielten Hirnareal 5,6. Die Strukturierung des Gehirns wie kortikalen Bereich auftreten in einem frühen embryonalen Stadium, daher sind diese frühen Elektroporation von E9.5 einen großen Beitrag zur gesamten Bereich Strukturierung Ereignis zu verstehen. Zweitens verhindert die genaue Form einer Kapillare uterine Schäden, indem sie Löcher durch Einsetzen der Kapillare. Darüber hinaus sind die genaue Form der Nadelelektroden mit Wolfram-und Platin-Draht geschaffen und geschärft mit Schleifpapier und isoliert mit Lack 7, eine Methode, die im Detail in diesem Protokoll beschrieben ist. Diese einzigartige Technik erlaubt die Transfektion von Plasmid-DNA in eingeschränkten Bereichen des Gehirns und ermöglicht es kleinen Embryonen elektroporiert werden. Dies wird dazu beitragen, ein neues Fenster öffnen für viele Wissenschaftler, die auf die Zelldifferenzierung, Zellwanderung, Axon Anleitung arbeiten in einem sehr frühen embryonalen Stadium. Darüber hinaus wird diese Technik den Wissenschaftlern ermöglichen, Plasmid-DNA in tiefen Teilen des sich entwickelnden Gehirns wie Thalamus und Hypothalamus, wo nicht viele regionsspezifische CRE Linien existieren für gain of function (GOF) oder Funktionsverlust (LOF) Analysen zu transfizieren.
Protokoll
1. Vorbereitung der Kapillar-und DNA-Lösung zur Injektion
- Purify Plasmid-DNA mit einem Maxi-Prep oder gleichwertiges Verfahren, um zu einer endgültigen Konzentration von 2-3 ug / ul. Aliquot 100 ug DNA, fügen Sie 10 &mgr; l der schnellen grünen Farbstoff (1% Aktien) und TE (10 mM Tris Base, 1mM EDTA-Lösung, pH 8,0) und stellen ein Volumen von 100 ul die endgültige DNA-Konzentration zur Injektion Mix 1 g / machen ul. Die Konzentration von Plasmid-DNA verändert werden kann, hängt von der Größe des Plasmids, und auch ihre Transfektionseffizienz, die einzeln geprüft werden muss.
- Drehen Sie die DNA-Lösung für 5 Minuten bei 14.000 RPM bei Raumtemperatur und sammeln Überstand, um alle Rückstände zu entfernen.
- Ziehen Sie eine Glaskapillare tubea Glaskapillaren mit einer Mikropipette Abzieher. Pinch off der Spitze mit einer Pinzette, um die Spitze hat einen Durchmesser von 20-30 um. Messen Sie 800 um-1 mm von der Spitze und überprüfen Sie die Außendurchmesser von weniger als 60 pm (Abb. 1A).
- Schließen Sie die Kapillare zu den Mikromanipulator, und füllen Sie mit Mineralöl. Um die Kapillare mit der DNA-Lösung, tauchen die Spitze in die Lösung zu füllen und zu saugen bis die DNA-Lösung.
2. Stick-Platin-Elektroden
Hier haben wir Stick Platinelektroden (Nepe Gen, CUY611P2-1) in oberflächennahen Bereich des Gehirns, wie der Cortex (Abb. 1F) elektroporieren.
3. Vorbereitung von Mikroelektroden
Verwenden Sie Mikro-Elektroden in tiefen Teilen des Gehirns (dh, Thalamus und Hypothalamus) (Abb. 2B-E) elektroporiert.
- Ein Ende des Wolfram (für negative Elektroden) und Platin (für positive Elektroden) Drähte auf vergoldeten gewickelt und fixiert mit Parafilm. Führen Sie den Draht um den Stamm ein Wattestäbchen und wickeln Sie beide Enden mit Parafilm (Abb. 1B).
- Gleichmäßig schärfen die Spitze des Drahtes mit Sandpapier, bis sie 20-30 um Außendurchmesser und 60 pm von 800 um-1 mm von der Spitze (Abb. 1C und D) erreicht.
- Tragen Sie eine dünne Schicht Nagellack auf den Draht für die Isolierung. Nach der Nagellack getrocknet ist, verwenden Sie ein Aceton getränkten Wattestäbchen, um es von der Spitze (etwa 200 um von der Spitze) zu entfernen. Wichtiger Hinweis: Um Schäden an der Maus die Gebärmutter zu verhindern, ist der Anteil innerhalb von 800 um-1 mm von der Spitze sollte nicht mehr als 70 um im Durchmesser (Abb. 1E) werden.
4. Vorbereitung der Operation
- Anesthetize eine schwangere Maus (E9.5-E15.5). Wir zeigen, Betäubung mit pharmazeutischer Qualität Natrium-Pentobarbital (Tabelle II; 50 ug pro Gramm Körpergewicht, intraperitoneal injiziert, und warten Sie 5 min). Alternativen zum Natrium-Pentobarbital als Narkosemittel beinhalten Ketamin / Xylazin Injektion oder Gas Anästhetika (Gas ist bevorzugt kurzer Dauer Verfahren). Die Injektion mit Aufmerksamkeit sollte getan werden, um alle Organe zu vermeiden, sonst wird es dazu führen, dass die Gebärmutter schädigen oder töten Tier. Als erfolgreiche IP geschehen ist, ist die Überlebensrate mehr als 95%. Auch die Chirurgie kann in Open-Air-Umgebung durchgeführt werden. Bevor begann die Operation, Test für eine fehlende Reaktion durch das Tier zu kneifen ihre Fußspitze Betäubung bestätigen.
- Shave das Haar aus dem Bauch mit einer Rasierklinge und 50% EtOH. Bereiten Sie die Haut mit wechselnden scrubs von betadine und Alkohol (70%).
- Machen Sie einen Schnitt am Bauch-Mittellinie mit einer feinen Schere und ziehen Sie alle Uterushörner vorsichtig auf 37 ° C vorgewärmten Phosphat-gepufferter Salzlösung (PBS)-angefeuchtet Baumwollgaze, die um die Wunde gelegt wird. Halten Sie die Gebärmutter feucht mit PBS die ganze Zeit.
- Halten Sie eine flexible Glasfaser-Kabel zwischen dem Zeige-und Mittelfinger und legen Sie es unter dem Uterushorn. Saubere Kabel mit 70% EtOH vor dem Gebrauch. Kein Mikroskop oder Lupe ist für die Visualisierung benötigt. Position Gebärmutter zwischen den Glasfaser-Licht-Optik-Kabel und den Daumen, und drücken Sie sanft nach oben zu drücken den Embryo näher an der Gebärmutterwand.
5. Die Injektion von DNA und Elektroporation
- Als Embryo positioniert ist, legen Glas sorgfältig Kapillare in Ziel Herzkammer und spritzen ca. 1 ul DNA-Lösung (Abb. 2A).
- Für die Elektroporation auf oberflächliche Teil des brainIf Verwendung mit Stick Platin-Elektroden für electoporation, legen Sie die Elektroden außerhalb der Gebärmutter und gelten vorgeschlagen Rechtecksignale Stromimpulse nach Herstellung der Anweisung (Tabelle I). Wenn usingFor Elektroporation zu tieferen Teil des Gehirns, nmicro Elektroporation werden eedle Typ Elektroden verwendet. Iinsert einem feinen Wolfram negative Elektrode in die DNA injiziert Ventrikel und einer Platin-Elektrode in die Gebärmutter und Ort Zielregion zwischen zwei Elektroden, dann schlug Rechtecksignale Stromimpulse (Tabelle I) (Abb. 2B) gelten.
6. Beitrag Elektroporation
- Legen Sie die Uterushorn zurück in seine original Lage mit und fügen Sie 500 ul von 37 ° C vorgewärmten PBS.
- Suture die innere Schicht mit chirurgischem Nahtmaterial und schließen äußere Schicht mit einem 9 mm autoclipauto Clip.
- Legen Sie Tiere auf einem Heizkissen für 2 Stunden, damit aus der Narkose. Analgetika wie Carprofen oder Buprenorphin kann für postoperative Schmerzen verabreicht werden.
7. Repräsentative Ergebnisse:
Einige Beispiele der kortikalen Elektroporation von pCAG-EYFP konstruieren mit Stick Platinelektroden zu verschiedenen Zeitpunkten sind in Abbildung Abbildung 32 dargestellt. Brains sind E13.5, E14.5 und E15.5 elektroporiert und geerntet postnatalen Tag (P) 6. ADie ntibody Färbung RORC zeigt Lage der Schicht 4 und die Position der EYFP transfizierten Zellen durch GFP Antikörper-Färbung werden aufgedeckt, und die beiden Bilder sind super verhängt (Abb. 3A und B). Labeled kortikalen Zellen Schicht der kortikalen Zellen elektroporiert unterscheidet sich deutlich in jedem Experiment (Abb. 32), die zeitabhängige Elektroporation macht Corticalis-spezifische GOF / LOF möglich suggeriert.
Die Lebensfähigkeit von Embryonen und die Effizienz der Transfektion von Zellen variiert nach Alter des Embryos und die Lage der Elektroporation abhängig. Die Proben in Tabelle 1 aufgelistet sind, jedoch sollten die Bedingungen für jede Elektroporation je auf der Bühne und ein Teil des Gehirns optimiert werden.
Elektroporation in eine tiefe Gewebe wie Thalamus und Hypothalamus mit der Verwendung von Platin-Elektroden-Stick geben oft geringe Effizienz (Tabelle 1). Dieses Problem kann durch Verwendung von Mikro-Elektroden whichelectrodes, die tiefen Teile des Gehirns erreichen wird gelöst werden. Abbildung 3 4 zeigt beispielsweise der pCAG-EYFP Elektroporation in den Entwicklungsländern Zwischenhirn. Plasmid-DNA-Lösung wird in der 3. Ventrikel bei E11.5 injiziert, gefolgt von Mikro-Elektroporation (Abb. 3C4C). Die Elektroporation Bereich ist in den Thalamus beschränkt, wo die meisten Axone zum Kortex (Abb. 3B4B). Axon-Projektion der Schicht 4 des Kortex kann auch visualisiert EYFP, die bis fillesfills das gesamte Neuron. (Abb. 3A4A).
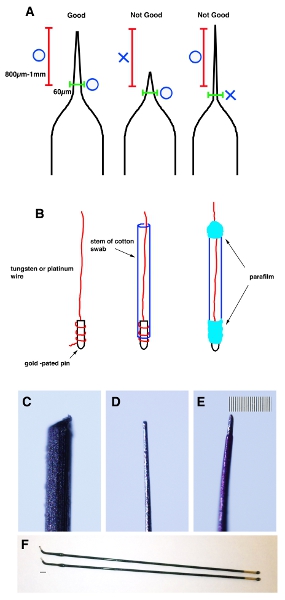
Abbildung 1. Cartoon schematische demonstriert die richtige Form der Kapillare. (A) A Glaskapillare gezogen wird mit einer Mikropipette puller bestimmte Form zu machen. Ein Tipp ist abgeschnürt durch Zangengeburt zu 20-30 um zu machen. Messen Sie 800 um-1mm von der Spitze (rote Klammer) und stellen Sie sicher, dass externe Durchmesser von weniger als 60 pm (grüne Klammer) ist. (B) Ein Ende des Wolfram-oder Platin-Drähte auf vergoldeten gewickelt und fixiert mit Parafilm. Dann nutzen Sie Schleifpapier, ihre Spitze stellen, um 20-30 um Außendurchmesser und 60 um 1 mm von der Spitze zu werden. (C) Bild von der Wolfram-Draht vor der Formgebung. (D) Bild von der Wolframdraht nach der Formgebung. (E) Bild von der Wolframdraht nach dem Auftragen dünn Nagellack. Maßstabsbalken in E ist 10 pm (kleinste Skala) für CE. (F) Stick Platinelektroden (Nepa Gen. CUY611P2-1). Balken in F ist 2 mm.
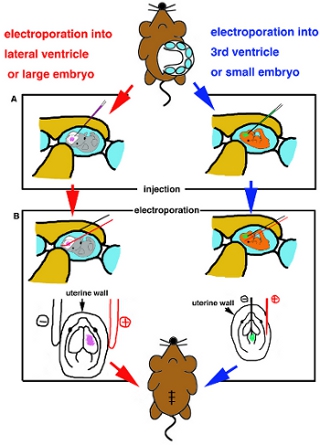
Abbildung 2. Cartoon-Schema des chirurgischen Eingriffs. (A) Schematische Darstellung der Injektion in Seitenventrikel oder großen Embryonen (links) und in 3 rd Ventrikels oder kleine Embryonen (rechts). (B) Schematische Darstellung der electrporation durch Platin Stabelektrode (links) und Nadel Elektrode (rechts).
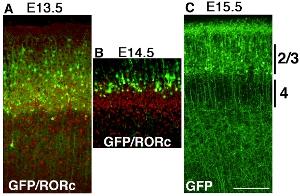
Abbildung 3. Entwickeln Maus Telencephalon wurde mit pCAG-EYFP bei E13.5 (A), E14.5 (B) und E15.5 (C) elektroporiert und geerntet P6. Die Gehirne wurden geschnitten koronalen und gefärbt mit GFP-Antikörper oder Antikörper RORC getrennt und Bilder zusammengeführt werden. (A) Elektroporation von pCAG-EYFP Plasmid bei E13.5 transfizieren vielen Schicht 4 Neuronen. die Überschneidung mit Schicht 4 Marker RORC. (B) Elektroporation von pCAG-EYFP Plasmid bei E14.5 Transfektion von Zellen, die mehr oberflächlich als Schicht 4 Neuronen. (C) E15.5 Elektroporation label viele oberflächliche Neuronen wie Layer 2 / 3. Maßstabsbalken 200 um.
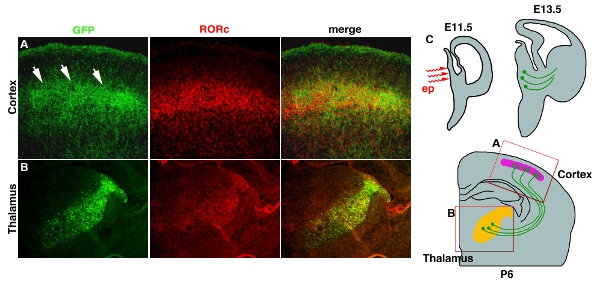
Abbildung 4. Transfektion von EYFP in thalamo-kortikalen Axone (TCA). (A) TCA Endstation in kortikalen Schicht 4 wird durch GFP-Antikörper-Färbung zeigte. RORC Antikörper-Färbung wird verwendet, um eine Position der Schicht 4 zu enthüllen. Beide Bilder stammen aus demselben Abschnitt übernommen und zusammengeführt. (B) Position der Elektroporation in den Thalamus wird auch von GFP Antikörper-Färbung und RORC Färbung, die ihren Ausdruck in den Thalamus 11 begrenzt wird angezeigt. (C) Cartoon Schaltplan für thalamischen Elektroporation und TCA-Projektion gezeigt. Maßstabsbalken 200 um.
Diskussion
In diesem Protokoll haben wir nur beschrieben Vorteile der Technik der pCAG-EYFP Transfektion in den geschützten Bereich einer kleinen embryonalen Gehirn mit verschieden geformten Elektroden. Zum Vergleich der Transfektionseffizienz von anderen Promotor zuvor beschrieben wird, zeigt, welche Zelltypspezifität 1. Allerdings gibt es Einschränkungen für die Technik, wie zum Beispiel die Transfektion ist nur vorübergehend und variiert abhängig von der Plasmid, es muss nicht jede Zelle Spezifität und es ist schwer, die Zahl der transfizierten Zellen zu steuern. ThereforeHowever, wird die Kombination dieses Protokoll mit anderen Techniken weiter bieten Möglichkeiten für verschiedene Methoden zur Manipulation. Zunächst wird Einbeziehung zellspezifischen Promotors in Plasmid-DNA ermöglichen zelltypspezifisch Transfektion, wie Neuronen, Gliazellen und Astrozyten. Zweitens, da die Transfektion transient ist, ist es nicht geeignet für Wissenschaftler, die die Funktion des Gens im späteren Leben analysieren möchten. Daher wird die Kombination mit einer Transposase, um Plasmid-DNA in das Genom integrieren sie in eine stabile Transfektion 8 zu konvertieren. Als nächstes Annahme des Tet-On-oder Tet-Off-System wird es möglich, den Zeitpunkt oder Zelltyp-spezifische Gen-Expression in neuronalen Zellen 8 manipulieren. Alternativ kann man dieses Protokoll mit Tamoxifen-induzierbare Cre-ER (T) Rekombinasen 9 und Reporter-Mäuse 10 zu kombinieren.
Diese breite Zugänglichkeit von Geweben wird sich drastisch verändern experimentellen Designs in den Neurowissenschaften eingesetzt.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde vom RIKEN Brain Science Institute (BSI), Human Frontier Science Program (HFSP) (verliehen TS) und RIKEN Junior Research Associate Program (JRA, verliehen an MK) RIKEN Brain Science Institute (BSI), Human Frontier Science Program gefördert (HFSP) (verliehen TS) und RIKEN Junior Research Associate Program (JRA, verliehen an MK) gefördert dieser Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Bare Wolfram Drahtdurchmesser 125 pm | AM-Systeme | 797600 | |
| blanken Platindraht Durchmesser 125 pm | AM-Systeme | 767000 | |
| Stabelektroden | Nepa-Gen | CUY610P4-1 | |
| Glaskapillare | Stölting | 50611 | |
| Mikromanipulator | KD Scientific | KDS310 | |
| Schere | Roboz | RS-5865 | |
| Impulsgeber | AM-Systeme | Modell 2100 | |
| 9 mm autoclip | Roboz | RS-9260 | |
| mit vergoldeten | WPI | 5482 | |
| RORC Antikörper | Perseus Proteomics | H3925 |
Referenzen
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Kataoka, A., Shimogori, T. Fgf8 controls regional identity in the developing thalamus. Development. 135, 2873-2881 (2008).
- Imayoshi, I., Shimogori, T., Ohtsuka, T., Kageyama, R. Hes genes and neurogenin regulate non-neural versus neural fate specification in the dorsal telencephalic midline. Development. 135, 2531-2541 (2008).
- Shimogori, T., Banuchi, V., Ng, H. Y., Strauss, J. B., Grove, E. A. Embryonic signaling centers expressing BMP, WNT and FGF proteins interact to pattern the cerebral cortex. Development. 131, 5639-5647 (2004).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development Growth & Differentiation. 50, 499-506 (2008).
- Takahashi, Y., Watanabe, T., Nakagawa, S., Kawakami, K., Sato, Y. Avian Embryology. Methods in Cell Biology. Vol 87, 2nd Edition, Elsevier Academic Press Inc. 271-271 (2008).
- Feil, R. Ligand-activated site-specific recombination in mice. Proceedings of the National Academy of Sciences of the United States of America. 93, 10887-10890 (1996).
- Indra, A. K. Temporally-controlled site-specific mutagenesis in the basal layer of the epidermis: comparison of the recombinase activity of the tamoxifen-inducible Cre-ERT and Cre-ERT2 recombinases. Nucleic Acids Research. 27, 4324-4327 (1999).
- Nakagawa, Y., O'Leary, D. D. M. Dynamic patterned expression of orphan nuclear receptor genes ROR alpha and ROR beta in developing mouse forebrain. Developmental Neuroscience. 25, 234-244 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten