Method Article
Mouse in Utero elettroporazione: controllato Transefection Gene spazio-temporale
In questo articolo
Riepilogo
Un metodo di trasferimento genico nel cervello del mouse di sviluppo è descritta utilizzando un metodo unico chirurgico e la forma speciale di elettrodi. Questa tecnica unica consente la trasfezione di DNA plasmidico temporalmente e spazialmente, che aiuterà molti neuroscienziati a studiare lo sviluppo del cervello.
Abstract
Per capire la funzione dei geni espressi nella specifica regione del cervello di sviluppo, tra cui molecole di segnalazione e le molecole di guida degli assoni, locale o il trasferimento di geni knock-out è richiesto. Gene targeting knock-in o knock-out in regioni locali è possibile eseguire con combinazione con una linea specifica CRE, che è laborioso, costoso e richiede tempo. Pertanto, un metodo di trasfezione semplice, un tecnica di elettroporazione in utero, che può essere eseguita con tempi brevi, sarà utile per testare la possibile funzione di geni candidati prima della generazione di animali transgenici 1,2. Oltre a questo, in elettroporazione utero obiettivi aree del cervello in cui non specifica linea CRE esiste, e limiterà letalità embrionale 3,4. Qui, vi presentiamo un metodo di elettroporazione in utero combinazione di due diversi tipi di elettrodi di trasferimento genico semplice e conveniente in aree obiettivo di sviluppo del cervello. In primo luogo, tenendo un metodo unico di embrioni con un ottica di luce in fibra ottica farà embrioni di piccole dimensioni (da E9.5), visibile per l'iniezione mirata soluzione di DNA in ventricoli e il tipo di elettrodi ad ago di inserimento nella zona del cervello mirati 5,6. Il modello del cervello come la zona corticale verificarsi in fase embrionale precoce, dunque, questi primi elettroporazione da E9.5 un importante contributo per comprendere l'intero evento patterning zona. In secondo luogo, la forma precisa di un capillare, previene i danni uterina facendo fori per l'inserimento del capillare. Inoltre, la forma precisa del elettrodi ad ago sono creati con il tungsteno e il filo di platino e affilata con carta vetrata e isolato con smalto 7, un metodo che è descritto in dettaglio in questo protocollo. Questa tecnica unica consente la trasfezione di DNA plasmidico in aree limitate del cervello e consentirà embrioni piccolo per essere elettroporate. Ciò contribuirà a, aprire una nuova finestra per molti scienziati che stanno lavorando sulla differenziazione delle cellule, la migrazione delle cellule, l'orientamento degli assoni in fase embrionale molto precoce. Inoltre, questa tecnica permetterà agli scienziati di trasfezione di DNA plasmidico in parti profonde del cervello di sviluppo, come talamo e ipotalamo, dove non molte regioni specifiche linee CRE esistono per guadagno di funzione (GOF) o la perdita di funzione (LOF) analisi.
Protocollo
1. Preparazione della soluzione capillare e del DNA per l'iniezione
- Purificare DNA plasmidico con un maxi-prep o metodo equivalente, e fare una concentrazione finale di 2-3 mg / mL. Aliquota 100 mg di DNA, aggiungere 10μl di digiuno colorante verde (1% stock) e TE (10mM Tris base, 1MM Soluzione EDTA, pH 8,0) e regolare un volume di 100 l per rendere la concentrazione finale del DNA per mix iniezione per 1μg / microlitri. La concentrazione di DNA plasmidico può essere cambiato dipende dalle dimensioni del plasmide, e anche la sua efficienza di trasfezione, che deve essere testato singolarmente.
- Gira la soluzione di DNA per 5 minuti a 14000 rpm a temperatura ambiente e raccogliere il supernatante per rimuovere eventuali residui.
- Tirare un capillare di vetro tubi di vetro capillari tubea con un estrattore micropipetta. Pizzicare la punta con una pinza per fare la punta ha un diametro di 20-30 micron. Misura 800 micron-1 mm dalla punta e controllare il diametro esterno è inferiore a 60 micron (Fig. 1A).
- Collegare il capillare alla micromanipolatore, e riempire con olio minerale. Per riempire il capillare con la soluzione DNA, immergere la punta nella soluzione e aspirare la soluzione di DNA.
2. Stick elettrodi di platino
Qui abbiamo usato elettrodi di platino bastone (Nepe gene, CUY611P2-1) a electroporate nella regione superficiale del cervello, come la corteccia (Fig. 1F).
3. Preparazione di micro-elettrodi
Usa micro-elettrodi elettroporate in parti profonde del cervello (cioè, talamo e ipotalamo) (Fig. 2B-E).
- Un'estremità del tungsteno (per elettrodi negativi) e platino (per gli elettrodi positivi) i fili è avvolto in oro placcato perni e fissati con parafilm. Inserire il filo per il gambo di un batuffolo di cotone e avvolgere entrambe le estremità con parafilm (Fig. 1B).
- Uniformemente affilare la punta del filo con la carta vetrata fino a raggiungere 20-30 micron di diametro esterno e 60 micron da 800 micron-1 mm di punta (Fig. 1 C e D).
- Applicare uno strato sottile di smalto al filo per l'isolamento. Dopo lo smalto si è asciugato, utilizzare un acetone-tampone di cotone imbevuto di rimuoverlo dalla punta (circa 200 micron dalla punta). Nota importante: Al fine di evitare danni all'utero del mouse, la porzione di 800 micron-1 mm di punta dovrebbe essere non più di 70 micron di diametro (Fig. 1E).
4. Preparazione della chirurgia
- Anestetizzare un topo gravide (E9.5-E15.5). Dimostriamo con anestesia di grado farmaceutico sodio pentobarbital (tabella II, 50 mcg per grammo di peso corporeo, iniettano intraperitoneale e attendere 5 min). Alternative al sodio pentobarbital come anestetico sono l'iniezione Ketamina / xylazina o anestetici gas (il gas è preferibile per le procedure di breve durata). L'iniezione deve essere fatta con attenzione per evitare qualsiasi organi, altrimenti si farà a danneggiare l'utero o uccidere animali. Quando IP di successo è fatto, il tasso di sopravvivenza è superiore al 95%. Anche la chirurgia può essere eseguita in ambiente a cielo aperto. Prima di iniziare l'operazione, prova per una mancanza di risposta da parte dell'animale di pizzicare i loro piedi per confermare anestetico.
- Radersi i capelli con l'addome con una lametta e il 50% EtOH. Preparare la pelle con alternanza di macchie di Betadine e alcool (70%).
- Fare un'incisione sulla linea mediana dell'addome con le forbici bene e tirare fuori tutte le corna uterine attenzione su un 37 ° C preriscaldato tampone fosfato salino (PBS)-garza di cotone inumidito, che si trova intorno alla ferita. Mantenere umido il utero con PBS per tutto il tempo.
- Tenere un cavo flessibile a fibre ottiche tra l'indice e il medio e lo pongo sotto il corno uterino. Cavo di pulire con il 70% EtOH prima dell'uso. Nessun microscopio o lente d'ingrandimento è necessario per la visualizzazione. Utero posizione tra il cavo ottico luce in fibra ottica e il pollice, e premere delicatamente per far salire l'embrione più vicino alla parete uterina.
5. L'iniezione di DNA ed elettroporazione
- Quando embrione è posizionato, inserire capillare di vetro con cautela nel ventricolo target e iniettare circa 1 ml di soluzione di DNA (Fig. 2A).
- Per l'elettroporazione di parte superficiale del brainIf utilizzo con elettrodi di platino per electoporation bastone, gli elettrodi al di fuori dell'utero e applicare suggerito impulsi di corrente ad onda quadra secondo le istruzioni di produzione (Tabella I). Se elettroporazione usingFor alla parte più profonda del cervello, elettroporazione nmicro, elettrodi tipo eedle vengono utilizzati. Iinsert un elettrodo di tungsteno multa negativi nel DNA iniettato ventricolo e un elettrodo di platino in utero e la destinazione regione posto tra due elettrodi, quindi applicare suggerito impulsi di corrente ad onda quadra (Tabella I) (Fig. 2B).
6. Messaggio elettroporazione
- Posizionare la parte posteriore dell'utero corno nella sua origposizione inale con e aggiungere 500 ml di 37 ° C preriscaldato PBS.
- Sutura lo strato interno con sutura chirurgica e chiudere strato esterno con una clip 9 millimetri autoclipauto.
- Animali luogo una piastra elettrica per 2 ore per consentire il recupero dall'anestesia. Gli analgesici come il carprofen o buprenorfina può essere somministrato per dolore post-operatorio.
7. Rappresentante dei risultati:
Alcuni esempi di elettroporazione corticale pCAG-EYFP costruire utilizzando elettrodi di platino bastone in diversi momenti sono mostrate nella figura Figura 32. Cervelli sono elettroporate a E13.5, E14.5 e E15.5, e raccolte al giorno postnatale (P) 6. AIl colorazione ntibody di RORC rivela posizione di livello 4 e la posizione delle cellule trasfettate EYFP sono rivelate dalla colorazione anticorpale GFP, e entrambe le immagini sono super imposto (Fig. 3A e B). Etichettati cellule corticali sono strato di cellule corticali elettroporate è chiaramente diversa in ogni esperimento (Fig. 32), che suggerisce dipendenti dal tempo elettroporazione rende strato corticale specifica GOF / LOF possibile.
La vitalità degli embrioni e l'efficienza di trasfezione delle cellule varia a seconda dell'età del dell'embrione e la posizione di elettroporazione. I campioni sono elencati nella Tabella 1, tuttavia, le condizioni dovrebbero essere ottimizzate per ogni elettroporazione a seconda dello stadio e la parte del cervello.
Elettroporazione in un tessuto profondo come il talamo e ipotalamo con l'utilizzo di elettrodi di platino bastone spesso danno bassa efficienza (Tabella 1). Questo problema può essere risolto utilizzando micro-elettrodi whichelectrodes, che raggiungerà a parti profonde del cervello. Figura 3 4 esempio mostra di pCAG-EYFP elettroporazione nel diencefalo di sviluppo. Soluzione di DNA plasmidico viene iniettato nel 3 ° ventricolo a E11.5 e seguiti da micro elettroporazione (Fig. 3C4C). L'area elettroporate è limitato nel talamo dove la maggior parte del progetto assoni alla corteccia (Fig. 3B4B). Proiezione degli assoni a livello 4 della corteccia può anche essere visualizzati da EYFP, che fillesfills il neurone intero. (Fig. 3A4A).
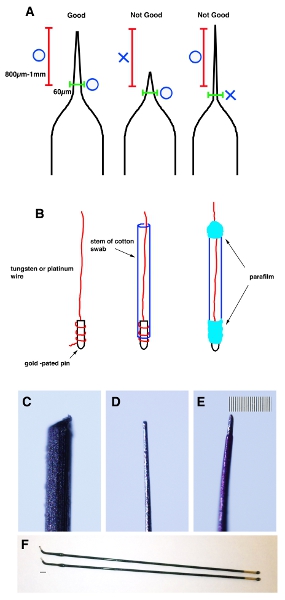
Figura 1. Schematico Cartoon dimostrare la forma corretta del capillare. (A) Un tubo capillare di vetro viene tirato con un estrattore micropipetta per rendere certa forma. Un consiglio è spento pizzicato da pinze per renderlo 20-30 micron. Misura 800 micron-1mm dalla punta (fascia rossa) e assicurarsi che il diametro esterno è inferiore a 60 micron (fascia verde). (B) Un capo del tungsteno o fili di platino è avvolto in oro placcato perni e fissati con parafilm. Poi usate la carta vetrata per rendere la loro punta a diventare 20-30 micron diametro esterno e 60 micron da 1 mm della punta. (C) Immagine del filo di tungsteno prima formazione. (D) Immagine del filo di tungsteno dopo la modellatura. (E) Immagine del filo di tungsteno dopo l'applicazione sottile strato di smalto. Barra di scala in E è di 10 micron (più piccola scala) per il CE. (F) Stick elettrodi di platino (gene Nepa. CUY611P2-1). Barra di scala in F è di 2 mm.
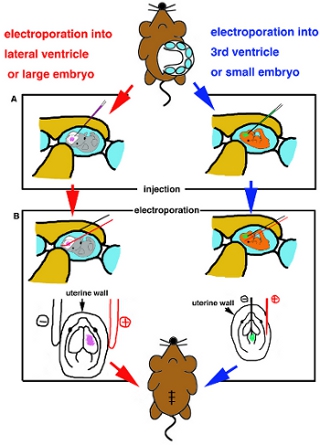
Figura 2. Cartoon schema di procedura chirurgica. (A) Schema di iniezione in ventricolo laterale o embrioni di grandi dimensioni (lato sinistro) e in 3 ° ventricolo o embrioni di piccole dimensioni (lato destro). (B) Schema di electrporation da elettrodo di platino bastone (lato sinistro) e con ago elettrodo tipo (lato destro).
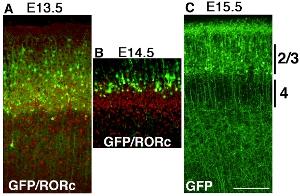
Figura 3. Sviluppo del mouse telencefalo era elettroporate con pCAG-EYFP a E13.5 (A), E14.5 (B) e E15.5 (C) e raccolte a P6. Cervelli sono stati sezionati coronale e colorate con anticorpi GFP o anticorpi RORC separatamente e immagini si fondono. (A) Elettroporazione di pCAG-EYFP plasmide a E13.5 molti strato trasfezione 4 neuroni. che si sovrappongono con livello 4 marcatori RORC. (B) Elettroporazione di pCAG-EYFP plasmide a E14.5 trasfezione delle cellule, che sono più superficiali di livello 4 neuroni. (C) E15.5 elettroporazione etichetta molti neuroni superficiali come layer 2 / 3. Scala bar 200 micron.
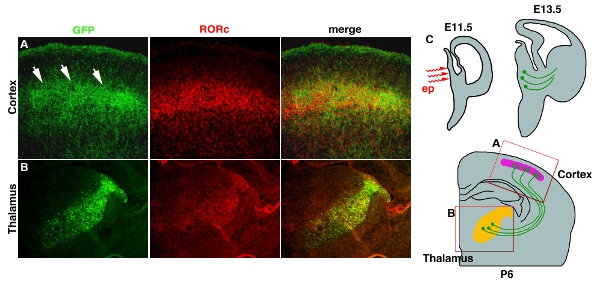
Figura 4. Transfection di EYFP nel talamo-corticale assoni (TCA). (A) capolinea TCA in strato corticale 4 è rivelata dalla colorazione anticorpale GFP. Colorazione anticorpale RORC viene usato per rivelare una posizione di livello 4. Entrambe le immagini sono prese dalla sezione stessa e uniti. (B) Posizione elettroporazione nel talamo è dimostrato anche dalla colorazione anticorpale GFP e colorazione RORC, limitato espressione nel talamo 11. (C) Schema Cartoon per l'elettroporazione talamo e la proiezione TCA sono mostrati. Scala bar 200 micron.
Discussione
In questo protocollo, abbiamo solo descritto i benefici della tecnica del pCAG-EYFP trasfezione in area riservata di un cervello piccolo embrionale utilizzando diversi elettrodi di forma. Per il confronto di efficienza di trasfezione di promotore diverso è descritto in precedenza, che mostra il tipo di specificità delle cellule 1. Tuttavia, ci sono limitazioni per la tecnica, come la transfezione è solo transitoria e varia a seconda del plasmide, che non ha alcuna specificità delle cellule ed è difficile controllare il numero di cellule transfettate. ThereforeHowever, combinando questo protocollo con altre tecniche saranno ulteriori possibilità di fornire diversi metodi di manipolazione. In primo luogo, che incorpora promotore specifiche cellule nel DNA plasmidico permetterà transfezione delle cellule di tipo specifico, come i neuroni, astrociti e cellule gliali. In secondo luogo, dato che la transfezione è transitorio, non è adatto per gli scienziati che vogliono analizzare la funzione del gene nella vita futura. Pertanto, l'associazione con una trasposasi per rendere DNA plasmidico integrarsi nel genoma verrà convertito in una trasfezione stabile 8. Prossimo, l'adozione del tet-on o tet-off sistema permetterà di manipolare il tempo o la cella tipo specifico di espressione genica nelle cellule neurali 8. In alternativa, si può combinare questo protocollo con tamoxifene-inducibile Cre-ER (T) ricombinasi 9 e topi reporter di 10.
Questa ampia accessibilità dei tessuti drasticamente cambiare i disegni sperimentali utilizzati nel campo delle neuroscienze.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato finanziato dalla RIKEN Brain Science Institute (BSI), Human Frontier Science Program (HFSP) (assegnato a TS) e RIKEN Research Program Junior Associate (JRA, assegnato a MK) RIKEN Brain Science Institute (BSI), Human Frontier Science Program (HFSP) (assegnato a TS) e RIKEN Research Program Junior Associate (JRA, assegnato a MK) finanziato questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| nudo filo di tungsteno di diametro 125 micron | AM sistemi | 797600 | |
| nudo filo di platino del diametro 125 micron | AM sistemi | 767000 | |
| Stick elettrodi | Nepa gene | CUY610P4-1 | |
| tubo di vetro capillare | Stoelting | 50611 | |
| micromanipolatore | KD scientifico | KDS310 | |
| forbici | Roboz | RS-5865 | |
| generatore di impulsi | Sistemi AM | Modello 2100 | |
| 9 millimetri autoclip | Roboz | RS-9260 | |
| placcati in oro pins | WPI | 5482 | |
| RORC anticorpi | Perseo Proteomica | H3925 |
Riferimenti
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240, 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294, 1071-1074 (2001).
- Kataoka, A., Shimogori, T. Fgf8 controls regional identity in the developing thalamus. Development. 135, 2873-2881 (2008).
- Imayoshi, I., Shimogori, T., Ohtsuka, T., Kageyama, R. Hes genes and neurogenin regulate non-neural versus neural fate specification in the dorsal telencephalic midline. Development. 135, 2531-2541 (2008).
- Shimogori, T., Banuchi, V., Ng, H. Y., Strauss, J. B., Grove, E. A. Embryonic signaling centers expressing BMP, WNT and FGF proteins interact to pattern the cerebral cortex. Development. 131, 5639-5647 (2004).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Development Growth & Differentiation. 50, 499-506 (2008).
- Takahashi, Y., Watanabe, T., Nakagawa, S., Kawakami, K., Sato, Y. Avian Embryology. Methods in Cell Biology. Vol 87, 2nd Edition, Elsevier Academic Press Inc. 271-271 (2008).
- Feil, R. Ligand-activated site-specific recombination in mice. Proceedings of the National Academy of Sciences of the United States of America. 93, 10887-10890 (1996).
- Indra, A. K. Temporally-controlled site-specific mutagenesis in the basal layer of the epidermis: comparison of the recombinase activity of the tamoxifen-inducible Cre-ERT and Cre-ERT2 recombinases. Nucleic Acids Research. 27, 4324-4327 (1999).
- Nakagawa, Y., O'Leary, D. D. M. Dynamic patterned expression of orphan nuclear receptor genes ROR alpha and ROR beta in developing mouse forebrain. Developmental Neuroscience. 25, 234-244 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon