Method Article
La detección de modificaciones de las histonas en hojas de las plantas
En este artículo
Resumen
Un enfoque confiable y útil para detectar modificaciones de las histonas en los genes específicos de la planta se describe. El enfoque combina la cromatina immunoprecipitation (CHIP) y en tiempo real PCR cuantitativa. Que permite la detección de modificaciones de las histonas en los genes específicos con un papel en diversos procesos fisiológicos.
Resumen
Estructura de la cromatina es importante para la regulación de la expresión génica en las células eucariotas. En este proceso, las modificaciones de remodelación de la cromatina, la metilación del ADN, y covalentes en las colas amino-terminal de las histonas H3 y H4 juegan un papel esencial 1-2. Modificaciones de histonas H3 y H4 incluyen la metilación de la lisina y la arginina, la acetilación de la lisina, y la fosforilación de 1-2 residuos de serina. Estas modificaciones se relacionan tanto con la activación de genes, la represión, o en un estado preparado de gen que admite la activación más rápida y robusta de expresión después de la percepción de las señales apropiadas (microbio patrones moleculares asociados, la luz, hormonas, etc) 3-7.
A continuación, presentamos un método para la detección fiable y sensible de determinadas modificaciones de la cromatina en los genes de plantas seleccionadas. La técnica se basa en el entrecruzamiento de (modificar) las histonas y el ADN con formaldehído 8,9, extracción y tratamiento con ultrasonidos de la cromatina, cromatina immunoprecipitation (CHIP) con la modificación de los anticuerpos específicos de 9,10, de reticulación de la histona-ADN complejos, y de genes específicos en tiempo real PCR cuantitativa. El enfoque ha demostrado ser útil para la detección de modificaciones de las histonas específicas asociadas a la fotosíntesis C 4 en el maíz 5,11 y la inmunidad sistémica en Arabidopsis 3.
Protocolo
1. Entrecruzamiento de material vegetal
- Cosecha de 1-2g de hojas de Arabidopsis (6 a 10 cm de diámetro roseta) en un tubo de plástico de 50 ml y completar hasta 40 ml con buffer de reticulación.
- Asegúrese de que deja permanecer sumergidos, por ejemplo, el relleno a la derecha a medida filtro de esponja sobre la superficie de amortiguación. A continuación, coloque los tubos en un desecador.
- Vacío infiltrarse durante 10 minutos. Añadir a cada tubo 2,5 ml de 2 M de glicina a dejar de reticulación, e invierta los tubos para garantizar la igualdad de la dispersión de la glicina.
- Vacío para infiltrarse en otro 5 minutos y deseche el líquido, mientras que el corte de hojas en un tamiz.
- Lavar las hojas dos veces con 1 litro de agua en un vaso de vidrio, y luego deja secar con toallas de papel.
- Recoger las hojas en un tubo de plástico fresco y congelar en nitrógeno líquido. Tienda deja a -80 ° C hasta que el aislamiento de la cromatina.
2. Aislamiento de la cromatina
- Las hojas se molieron con un mortero y el pistilo que se mantuvieron en nitrógeno líquido hasta su uso.
- Transferencia de polvo a un tubo de plástico de 50 ml y suspender en tampón de extracción de 30 ml # 1.
- Incubar durante 15 min a 4 ° C en un agitador de arriba.
- Filtrado suspensión a través de cuatro capas de Miracloth en un tubo de plástico fresco de 50 ml.
- Giro de 20 minutos a 2.800 xg a 4 ° C.
- Quitar el sobrenadante y suspender el precipitado con un pincel en tampón de extracción 1 ml # 2. Primero se debe agregar un pequeño volumen de tampón # 2, entonces suspender el precipitado con un pincel, y luego añadir el resto de buffer.
- Transferencia de suspensión a un tubo de microcentrífuga 1,5 ml y girar durante 10 minutos a 12.000 xga 4 ° C.
- Mientras tanto, prepare 2 ml-microcentrífuga tubos que contienen 1,5 ml de tampón de extracción # 3.
- Aspirar el sobrenadante del tubo de hilar (paso 2.7) y suspender el precipitado en 300μL de tampón de extracción # 3. Primero se debe agregar un pequeño volumen de buffer # 3, suspender el precipitado con un pincel, y luego agregar el resto del búfer.
- Cuidadosamente con pipeta el precipitado en suspensión (paso 2.9) en la parte superior del búfer de 1,5 ml de extracción # 3 preparada en la etapa 2.8. Asegúrese de que las dos fases no se mezclan. Giro de 1 hora a 16.000 xg a 4 ° C.
- Aspirar el sobrenadante y suspender la cromatina pastilla con un pincel en 300μL de tampón de sonicación.
- Sonicar cromatina con un sonotrodo, o en un baño de ultrasonidos, con un tamaño de ADN de aproximadamente 400bp. Cuando ultrasonidos, que la cromatina que no se calienta por encima de aproximadamente 30 ° C para proteger sensibles al calor enlaces cruzados. La duración del tratamiento con ultrasonidos debe determinarse experimentalmente, ya que varía considerablemente entre los dispositivos de ultrasonidos diferentes. Para la dirección, la configuración de dos dispositivos diferentes están disponibles:
De ultrasonidos con una marca Bandelin sonotrodo exponer la cromatina en 0,6 ml tubo de microcentrífuga cinco veces a 20 explosiones con la configuración de un 25% de energía, ciclo = 50. Al hacerlo, muestra fría después de cada 20 explosiones º en un baño de hielo.
De ultrasonidos con un baño de ultrasonidos Diagenode Bioruptor, llenar baño con agua y hielo y ultrasonidos diez veces durante 30 segundos en los tubos de 1,5 ml de microfuga con el ajuste "alto". Después cada 30 segundos, las muestras frescas durante otros 30 segundos.
- Giro sonicado muestra durante 5 minutos a 16.000 ga 4 ° C para precipitar el material no disuelto. El sobrenadante se puede utilizar directamente para la inmunoprecipitación. Por otra parte, las muestras pueden ser de choque congelado en nitrógeno líquido y almacenadas a -80 ° C hasta su uso posterior.
3. Inmunoprecipitación
- Prepare de 2 ml que contienen tubos de microcentrífuga 40μL de proteína-A. Agarosa y 1,8 ml de anticuerpo de unión de amortiguación Añadir 200μL de la preparación de la cromatina (paso 2,13).
- Incubar los tubos durante 1 hora en un agitador de arriba.
- Deseche la proteína-A perlas de agarosa y el uso de sobrenadante de la inmunoprecipitación.
- Eliminar una parte alícuota de 40μL-para determinar la concentración de la cromatina ('input').
- Añadir 30μL de proteína-A. Agarosa y la cantidad de modificación de anticuerpos específicos que se indica en la siguiente tabla de reactivos y equipos específicos para la suspensión 400μL cromatina sonica
- Incubar durante 2,5 h o durante la noche en un agitador de arriba a 4 ° C.
- Centrifugar durante 2 minutos en cuentas x 440 g.
- Lávese las bolas pellet con 900μL de cada solución lavadora (véase la lista más abajo). Para cada buffer, cuentas de incubar en la memoria durante 10 minutos en un agitador de arriba a 4 ° C, y luego girar durante 2 minutos a 440 xg, desechar el sobrenadante y añadir el siguiente búfer.
- Baja en sal tampón de lavado
- Elevado de sal tampón de lavado
- LiCl tampón de lavado
- TE tampón de lavado
- Después del último lavado, eliminar por completo cualquier resto del búfer.
4. De reticulación de las histonas y el ADN, y la purificación de ADN se precipitó
- Añadir 100μL de tampón de reticulación de la pastilla de agarosa y se muestra "entrada" de la 40μl de paso 3.4, la mezcla durante 5 minutos en un vórtex, las muestras de giro, y la INCUBate a 65 ° C durante la noche.
- Purificar el ADN con el ADN comercial o kit de purificación de PCR.
- Por lo general 5μl de una dilución 1:05 de la eluido de la columna final son suficientes para realizar convencional específica de locus cuantitativa en tiempo real RT-PCR (RT-qPCR).
5. Tabla de buffers
| Entrecruzamiento de búfer | |
| Butirato sódico | 10 mM |
| Sacarosa | 400 mM |
| Tris-HCl, pH 8,0 | 10 mM |
| β-mercaptoetanol | 5mM |
| Formaldehído | 3% (v / v) |
| Tampón de extracción # 1 | |
| Butirato sódico | 10 mM |
| Sacarosa | 400 mM |
| Tris-HCl, pH 8,0 | 10 mM |
| β-mercaptoetanol | 5mM |
| Inhibidor de la proteasa completa | 1x |
| Tampón de extracción # 2 | |
| Butirato sódico | 10 mM |
| Sacarosa | 250 mm |
| Tris-HCl, pH 8,0 | 10 mM |
| β-mercaptoetanol | 5mM |
| MgCl2 | 10 mM |
| Triton X-100 | 1% (w / v) |
| Inhibidor de la proteasa completa | 1x |
| Tampón de extracción # 3 | |
| Butirato sódico | 10 mM |
| Sacarosa | 1,7 millones |
| Tris-HCl, pH 8,0 | 10 mM |
| β-mercaptoetanol | 5mM |
| MgCl2 | 2 mM |
| Triton X-100 | 0,15% (w / v) |
| Inhibidor de la proteasa completa | 1x |
| Sonicación buffer | |
| Tris-HCl, pH 8,0 | 25 mM |
| EDTA-NaOH, pH 8,0 | 5mM |
| SDS | 0,5% (w / v) |
| Inhibidor de la proteasa completa | 1x |
| Unión de los anticuerpos de búfer | |
| Tris-HCl, pH 8,0 | 50 mM |
| EDTA-NaOH, pH 8,0 | 1 mM |
| NaCl | 150 mM |
| Triton X-100 | 0,1% (w / v) |
| Baja en sal tampón de lavado | |
| NaCl | 150 mM |
| SDS | 0,1% (w / v) |
| Triton X-100 | 1% (w / v) |
| EDTA-NaOH, pH 8,0 | 2 mM |
| Tris-HCl, pH 8,0 | 20 mM |
| Elevado de sal tampón de lavado | |
| NaCl | 500 mm |
| SDS | 0,1% (w / v) |
| Triton X-100 | 1% (w / v) |
| EDTA-NaOH, pH 8,0 | 2 mM |
| Tris-HCl, pH 8,0 | 20 mM |
| LiCl tampón de lavado | |
| Cloruro de litio | 250 mm |
| Nonidet-P40 | 1% (v / v) |
| Desoxicolato de sodio | 1% (w / v) |
| EDTA-NaOH, pH 8,0 | 1 mM |
| Tris-HCl, pH 8,0 | 20 mM |
| TE tampón de lavado | |
| EDTA-NaOH, pH 8,0 | 10 mM |
| Tris-HCl, pH 8,0 | 1 mM |
| Decrosslinking buffer | |
| Tris-HCl, pH 6,8 | 62,5 mm |
| NaCl | 200 mM |
| SDS | 2% (w / v) |
| TDT | 10 mM |
6. Los resultados representativos:
La expresión del gen de defensa de Arabidopsis thaliana que codifica una β PR2-1,3-glucanasa con actividad antimicrobiana 12, fue inducida por benzothiadiazole (BTH), un análogo sintético de la hormona vegetal ácido salicílico 3. La figura 1 muestra que la activación de PR2 expresión se asocia con un aumento en la acetilación de residuos de lisina de las histonas H3 y H4 en el promotor de PR2. Dado que la densidad disminuye nucleosoma durante la activación del gen 13, los valores de acetilación de histonas se normalizaron por la señal obtenida con un anticuerpo contra una región invariable de la histona 3.
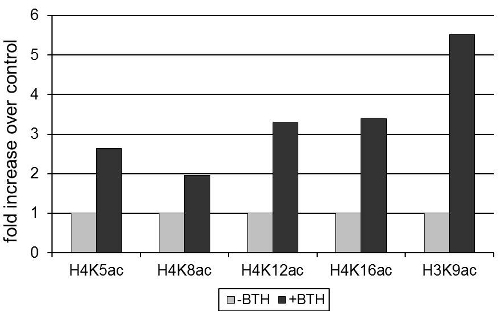
Figura 1 BTH induce la acetilación de histonas en el promotor de PR2 en Arabidopsis. Las plantas fueron tratadas con 100μM BTH o un control de polvo humectable. Después de 72 horas, se recogieron las hojas y la cromatina se aisló. La señal obtenida después de la precipitación con la acetilación de anticuerpos específicos (como se indica en la figura) se normalizó a la señal obtenida por precipitación con un anticuerpo a un dominio de los idiomas de la histona H3. Cromatina precipitado se cuantificó por RT-PCR cuantitativa. Los datos están estandarizados para los niveles de modificación de las histonas en la ausencia de tratamiento BTH.
Discusión
Pasos más importantes en el protocolo son el entrecruzamiento de ADN y las histonas, el tipo y cantidad de material de la hoja, la molienda de la materia, y la sonicación de la cromatina. Para una discusión más detallada de estos temas, ver refs. 9 y 10.
Sonicación y el entrecruzamiento:
Es importante para interrumpir la cromatina durante la sonicación a los fragmentos de alrededor de 400bp. Sonicación exhaustiva va a destruir la cromatina mediante la interrupción de ADN y las histonas, mientras que la sonicación insuficiente dejará largos fragmentos de la cromatina. Estos afectan a la especificidad del método, porque las modificaciones de las histonas distal del locus pruebas no pueden ser discriminados de modificaciones locales. La eficiencia es la mejor prueba de sonicación mediante la recopilación de la cromatina 20μL de las muestras antes y después del tratamiento con ultrasonidos, de reticulación del ADN y las histonas, aislando el ADN y la determinación de la longitud del ADN cortado por electroforesis en gel de agarosa. RNAsa debe ser añadido a las muestras antes de la electroforesis, ya que la preparación de la cromatina todavía contiene grandes cantidades de ARN en esta etapa de purificación que pueda interferir con la visualización de ADN fragmentado. Las muestras son útiles para la inmunoprecipitación de cromatina si el ADN de la cromatina no esquilada es más largo que 10kbp, mientras que el ADN de la cromatina cortado formas una prueba con una intensidad máxima de la señal alrededor de 400bp de ADN.
Nosotros usamos el 3% (v / v) de formaldehído para la reticulación de la cromatina en hojas intactas, pero el 1% (v / v) de formaldehído puede ser suficiente en la mayoría de los casos. En nuestras manos, las bajas concentraciones de formaldehído permitir tiempos de sonicación más cortos y las señales de fondo en la consiguiente reacción de PCR. Sin embargo, una cantidad insuficiente de formaldehído a menudo resultan en una baja reproducibilidad de la señal de PCR entre experimentos independientes. Esto puede ser debido a la penetración insuficiente de las hojas con formaldehído en concentraciones bajas. Asegúrese de que el intercambio de sus acciones de formaldehído con frecuencia como el compuesto tiende a polimerizar con el tiempo. Las soluciones de formaldehído son estables sólo durante aproximadamente un mes, y esta época no es prolongada por la estabilización de metanol. Se recomienda probar diferentes concentraciones de formaldehído en la creación de condiciones experimentales.
Cantidad de material vegetal y de molienda:
Es importante para infiltrar pequeñas cantidades de material de la hoja en un gran volumen de tampón para evitar que las hojas se peguen entre sí. Hoja se pegue a menudo resulta en la infiltración insuficiente de formaldehído. Además, el material vegetal demasiada bloquear los poros del tejido Miracloth. La eficiencia de la molienda depende considerablemente en el uso de un mortero con el ajuste perfecto. En forma rutinaria molienda con un nitrógeno líquido refrigerado mortero en la ausencia de nitrógeno líquido adicional de tres veces durante 50 segundos hasta que el material se muele hasta obtener un polvo fino.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por la Fundación Alemana para la Ciencia (DFG) y la Iniciativa de Excelencia de los gobiernos de Alemania federal y estatal.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Proteína A-agarosa | Roche | 11 134 515 001 | depende de la clase de anticuerpos |
| Proteína-G-agarosa | Roche | 11 243 233 001 | depende de la clase de anticuerpos |
| Anti-hyperacetyl-H4 | Millipore | 06-946 | hemos utilizado 5μL |
| Anti-acetil-H4K5 | Millipore | 07-327 | hemos utilizado 5μL |
| Anti-acetil-H4K8 | Millipore | 07-328 | hemos utilizado 5μL |
| Anti-acetil-H4K12 | Millipore | 07-595 | hemos utilizado 5μL |
| Anti-acetil-H4K16 | Millipore | 07-329 | hemos utilizado 5μL |
| Anti-acetil-H4K18 | Millipore | 07-354 | hemos utilizado 1μL |
| Anti-acetil-H3K9 | Millipore | 07-352 | hemos utilizado 5μL |
| Anti-acetil-H3K14 | Millipore | 07-353 | hemos utilizado 1μL |
| Anti-trimetil H3K4 | Diagenode | PAB-003-50 | hemos utilizado 5μL |
| Anti-dimetil-H3K4 | Millipore | 07-030 | hemos utilizado 5μL |
| Anti-monometil-H3K4 | Abcam | ab8895 | 2,5-10μL |
| Anti-H3 | Abcam | ab1791 | hemos utilizado para comprobar la densidad de 1μL histona |
| Bioruptor | Diagenode | UCD-200 A | |
| MS72 sonotrodo | Bandelin | ||
| Miracloth | Calbiochem | 475855 | |
| Inhibidor de la proteasa completa | Roche | 11836145001 |
Referencias
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO rep. 3, 224-229 (2002).
- Ruthenburg, A. J. Methylation of lysine 4 on histone H3: intricacy of writing and reading a single epigenetic. 25, 15-30 (2007).
- Jaskiewicz, M. Chromatin modification acts as a memory for systemic acquired resistance in the plant stress response. EMBO rep. 12, 50-55 (2011).
- Ng, D. W. Ordered histone modifications are associated with transcriptional poising and activation of the phaseolin promoter. Plant Cell. 18, 119-132 (2006).
- Offermann, S. Illumination is necessary and sufficient to induce histone acetylation independent of transcriptional activity at the C4-specific phosphoenolpyruvate carboxylase promoter in maize. Plant Physiol. 141, 1078-1088 (2006).
- Deng, W. Involvement of the histone acetyltransferase AtHAC1 in the regulation of flowering time via repression of FLOWERING LOCUS C in Arabidopsis. Plant Physiol. 143, 1660-1668 (2007).
- Benhamed, M. Arabidopsis GCN5, HD1, and TAF1/HAF2 interact to regulate histone acetylation required for light-responsive gene expression. Plant Cell. 18, 2893-2903 (2006).
- Bowler, C. Chromatin techniques for plant cells. Plant Journal. 39, 776-789 (2004).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde decrosslinked-chromatin immunoprecipitation. Trends Biochem. Sci. 25, 99-104 (2000).
- Haring, M. Chromatin immunoprecipitation: optimization, quantitative analysis and data normalization. Plant Meth. 3, 11-11 (2007).
- Danker, T. Developmental information but not promoter activity controls the methylation state of histone H3 lysine 4 on two photosynthetic genes in maize. Plant J. 53, 465-474 (2008).
- Uknes, S. Acquired resistance in Arabidopsis. Plant Cell. 4, 645-656 (1992).
- Workman, J. L. Nucleosome displacement in transcription. Genes Develop. 20, 2009-2017 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados