Method Article
Обнаружение модификации гистонов в листьях растений
В этой статье
Резюме
Надежный и полезный подход для обнаружения модификации гистонов на конкретных растительных генов описано. Подход сочетает хроматин иммунопреципитации (чип) и в режиме реального времени количественной ПЦР. Она позволяет обнаруживать модификации гистонов на конкретных генов с роли в различных физиологических процессах.
Аннотация
Структуры хроматина имеет важное значение для регуляции экспрессии генов у эукариот. В этом процессе, хроматина, метилирование ДНК, и ковалентных модификаций на аминоконцевого хвостов гистонов H3 и H4 играют существенную роль 1-2. Н3 и Н4 модификации гистонов включают метилирование лизина и аргинина, лизина ацетилирование и фосфорилирование серина остатков 1-2. Эти изменения связаны либо с активации генов, репрессии, или загрунтовать состояние гена, который поддерживает более быстрый и надежный активации выражение после восприятие соответствующих сигналов (микроб связанные молекулярные модели, свет, гормонов и т.д.) 3-7.
Здесь мы представляем метод надежный и чувствительный выявления специфических модификаций хроматина на отдельные гены растений. Методика основана на сшивание (модифицированный) гистонов и ДНК с формальдегидом 8,9, добычей и обработкой ультразвуком хроматина, хроматин иммунопреципитации (чип) с модификацией-специфических антител 9,10, де-сшивки гистонов ДНК-комплексов, а Ген конкретных реальном времени количественной ПЦР. Подход оказался полезным для выявления специфических модификаций гистонов связано с C 4 фотосинтез у кукурузы 5,11 и системного иммунитета у Arabidopsis 3.
протокол
1. Сшивание растительного материала
- Урожай 1-2 г листьев Arabidopsis (от 6 до 10 см диаметром розетки) в 50-мл пластиковую трубку и заполнить до 40 мл с сшивания буфера.
- Убедитесь, что листья оставаться погруженным, например, с начинкой с учетом фильтра право губки выше буфера поверхности. Затем поместите труб в эксикаторе.
- Вакуумные проникнуть в течение 10 минут. Для каждой пробирки добавить 2,5 мл 2 М глицин, чтобы остановить сшивание, и инвертировать трубы, чтобы гарантировать равные дисперсии глицина.
- Вакуумные проникнуть еще 5 минут и выбросить жидкость при уборке листьев на сито.
- Промыть листья дважды с 1 л воды в стеклянном стакане, то сухие листья тщательно с бумажными полотенцами.
- Сбор листьев в свежем пластиковую трубку и заморозить в жидком азоте. Магазин листьев при температуре -80 ° C до хроматина изоляции.
2. Выделение хроматина
- Листья земле ступку и пестик, которые хранились в жидком азоте до использования.
- Передача порошок 50-мл пластиковая трубка и приостановить в 30 мл буфера извлечения № 1.
- Инкубировать 15 минут при температуре 4 ° С на накладные шейкере.
- Фильтрата суспензии через четыре слоя miracloth в свежем 50-мл пластиковую трубку.
- Спиновые за 20 минут при 2800 мкг при 4 ° C.
- Удалить супернатант и приостановить гранул с кистью в 1 мл буфера добычи № 2. Сначала нужно добавить небольшой объем буфера # 2, то приостановить гранул с кистью, а затем добавить остальные буфера.
- Передача подвески 1,5 мл трубки микроцентрифужную и спина в течение 10 минут при 12000 мкг при 4 ° C.
- Между тем, готовить 2 мл-микроцентрифужную пробирки, содержащие 1,5 мл буфера извлечения № 3.
- Удалить супернатант из выделяемых трубки (шаг 2,7) и приостановить осадок в 300 мкл добычи буфера # 3. Сначала нужно добавить небольшой объем буфера # 3, приостановить гранул с кистью, а затем добавить остальные буфера.
- Тщательно пипетки приостановлено гранул (шаг 2.9) в верхней части 1,5 мл буфера для экстракции № 3 подготовлен в шаге 2.8. Убедитесь, что два этапа не будут смешиваться. Спиновые в течение 1 ч при 16000 мкг при 4 ° C.
- Удалить супернатант и приостановить хроматина шарик с краской кисть в 300 мкл буфера от ультразвука.
- Разрушать ультразвуком хроматина с волновод, или в ультразвуковой ванне, чтобы ДНК размером около 400bp. Когда sonicating, убедитесь, что хроматин не будет нагреваться выше примерно 30 ° С для защиты термочувствительных сшивки. Продолжительность обработки ультразвуком необходимо определить экспериментально, потому что она значительно варьируется между различными устройствами обработки ультразвуком. Для руководства, настройки для двух разных устройств, если:
Для обработки ультразвуком с брендом Bandelin сонотрода подвергать хроматина в трубке 0.6mL микроцентрифужную в пять раз до 20 всплесков с параметрами 25% мощности, цикл = 50. Делая это, прохладный образца после каждой 20-й очередей в ледяной бане.
Для обработки ультразвуком с Diagenode Bioruptor ультразвуковой ванне, заполнить ванну с водой и льдом и разрушать ультразвуком десять раз в течение 30 секунд в 1,5 мл труб микроцентрифужную с установкой "высокой". Через каждые 30 секунд, охладить образцы в течение еще 30 секунд.
- Спиновые ультразвуком образца для 5 мин при 16000 г при 4 ° С для осаждения нерастворенных материала. Супернатант может напрямую использоваться для иммунопреципитации. Кроме того, образцы могут быть шок замораживали в жидком азоте и хранили при температуре -80 ° C до последующего использования.
3. Иммунопреципитация
- Подготовка 2-мл микроцентрифужную пробирки, содержащие белок 40μL-агарозы и 1.8mL антитело-буфера для связывания. Добавить 200 мкл подготовки хроматина (шаг 2,13).
- Инкубируйте труб за 1 ч на накладные шейкере.
- Отменить белка агарозном бисером и использование супернатанта для иммунопреципитации.
- Удалить 40μL-аликвоту для определения концентрации хроматина ("вход").
- Добавить 30μL белка-агарозы и количество модификация-специфических антител, которая указана в таблице ниже конкретных реагентов и оборудования для 400μL ультразвуком подвески хроматина.
- Инкубируйте 2,5 часа или на ночь на накладные шейкере при температуре 4 ° C.
- Спином вниз шарики для 2мин при 440 х г.
- Вымойте шарик шарик с 900μL каждого промывочного буфера (см. ниже перечень). Для каждого буфера, инкубировать бусины в буфере в течение 10 минут на накладные шейкере при температуре 4 ° С, то спина для 2мин при 440 мкг, отбросить супернатант, и добавьте следующий буфер.
- Низкий промывочный буфер соли
- Высокая промывочный буфер соли
- LiCl промывочный буфер
- ТЕ-буфера для промывки
- После последней промывки, полностью удалить все оставшиеся буфера.
4. Де-сшивающие гистонов и ДНК, и очистки ДНК осаждали
- Добавьте 100 мкл де-буфер для сшивания агарозном гранул и образец "вход" 40μl с шагом 3,4, смесь для 5мин на вихревой смеситель, спина образцы и incuБАТЭ при 65 ° С в течение ночи.
- Purify ДНК с ДНК или коммерческих ПЦР очистки комплект.
- Как правило 5 мкл в разведении 1:5 окончательного элюата колонки являются достаточными для выполнения обычных локуса конкретного реального времени количественного ПЦР (RT-КПЦР).
5. Таблица буферов
| Сшивание буфер | |
| Натрий бутират | 10 мМ |
| Сахароза | 400 мм |
| Трис-HCl, рН 8,0 | 10 мМ |
| β-меркаптоэтанол | 5 мМ |
| Формальдегид | 3% (объем / объем) |
| Добыча буфера # 1 | |
| Натрий бутират | 10 мМ |
| Сахароза | 400 мм |
| Трис-HCl, рН 8,0 | 10 мМ |
| β-меркаптоэтанол | 5 мМ |
| Полное ингибитора протеазы | 1x |
| Добыча буфера # 2 | |
| Натрий бутират | 10 мМ |
| Сахароза | 250 мм |
| Трис-HCl, рН 8,0 | 10 мМ |
| β-меркаптоэтанол | 5 мМ |
| MgCl 2 | 10 мМ |
| Тритон Х-100 | 1% (м / о) |
| Полное ингибитора протеазы | 1x |
| Добыча буфера # 3 | |
| Натрий бутират | 10 мМ |
| Сахароза | 1,7 |
| Трис-HCl, рН 8,0 | 10 мМ |
| β-меркаптоэтанол | 5 мМ |
| MgCl 2 | 2 мМ |
| Тритон Х-100 | 0,15% (м / о) |
| Полное ингибитора протеазы | 1x |
| Ультразвуком буфер | |
| Трис-HCl, рН 8,0 | 25 мМ |
| ЭДТА-NaOH, рН 8,0 | 5 мМ |
| SDS | 0,5% (м / о) |
| Полное ингибитора протеазы | 1x |
| Антитела буфера для связывания | |
| Трис-HCl, рН 8,0 | 50 мМ |
| ЭДТА-NaOH, рН 8,0 | 1mM |
| NaCl | 150 мМ |
| Тритон Х-100 | 0,1% (м / о) |
| Низкий промывочный буфер соли | |
| NaCl | 150 мМ |
| SDS | 0,1% (м / о) |
| Тритон Х-100 | 1% (м / о) |
| ЭДТА-NaOH, рН 8,0 | 2 мМ |
| Трис-HCl, рН 8,0 | 20 мМ |
| Высокая промывочный буфер соли | |
| NaCl | 500 мм |
| SDS | 0,1% (м / о) |
| Тритон Х-100 | 1% (м / о) |
| ЭДТА-NaOH, рН 8,0 | 2 мМ |
| Трис-HCl, рН 8,0 | 20 мМ |
| LiCl промывочный буфер | |
| Хлорид лития | 250 мм |
| Nonidet-P40 | 1% (об. / об) |
| Натрий дезоксихолатом | 1% (м / о) |
| ЭДТА-NaOH, рН 8,0 | 1mM |
| Трис-HCl, рН 8,0 | 20 мМ |
| ТЕ-буфера для промывки | |
| ЭДТА-NaOH, рН 8,0 | 10 мМ |
| Трис-HCl, рН 8,0 | 1mM |
| Decrosslinking буфер | |
| Трис-HCl, рН 6,8 | 62.5mM |
| NaCl | 200 мМ |
| SDS | 2% (м / о) |
| DTT | 10 мМ |
6. Представитель результаты:
Экспрессия генов Arabidopsis thaliana обороны PR2 кодирования β-1,3-глюканазы с антимикробной активностью 12, было вызвано benzothiadiazole (BTH), синтетический аналог гормона завод салициловая кислота 3. Рисунок 1 показывает, что активация PR2 выражение связано с увеличением ацетилирования остатков лизина на гистонов Н3 и Н4 на PR2 промоутера. С нуклеосом плотность уменьшается при активации генов 13, гистонов ацетилирования значения были нормализованы для сигнала, полученного с антителами к инвариантной области гистонов 3.
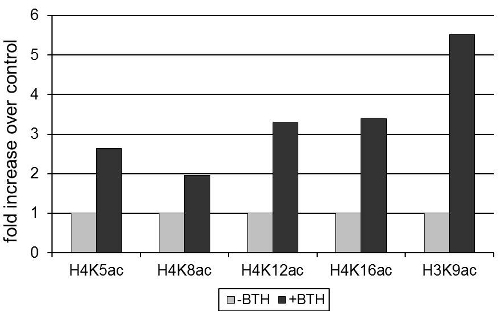
Рисунок 1 BTH вызывает ацетилирование гистонов на PR2 промотора в Arabidopsis. Растения обрабатывали 100 мкм BTH или смачиваемых контроль порошок. После 72 часов, листья были собраны и хроматина, был изолирован. Сигнала, полученного после осаждения ацетилирования-специфических антител (как указано на рисунке) была нормирована на сигнал, полученный путем осаждения антитела к инвариантной области гистона H3. Осажденный хроматина количественно RT-КПЦР. Данные стандартизированы для гистонов уровней изменений в отсутствии BTH лечения.
Обсуждение
Большинство критических шагов в протоколе сшивки ДНК и гистонов, тип и количество листьев материал, измельчение материала, а ультразвуком хроматина. Для более детального обсуждения этих вопросов см. назв. 9 и 10.
Ультразвуком и сшивания:
Важно, чтобы сорвать хроматина во время обработки ультразвуком с фрагментами о 400bp. Исчерпывающая ультразвуком уничтожит хроматина, разрушая ДНК и гистонов, в то время как недостаточная ультразвуком оставят длинные фрагменты хроматина. Они воздействуют на специфичность метода, так как модификации гистонов дистальных из протестированных локуса не может быть подвергнут дискриминации из локальных изменений. Ультразвука эффективность тестировать, собирая 20 мкл хроматина из образцов до и после обработки ультразвуком, де-сшивающие ДНК и гистонов, изолируя ДНК и определения длины стриженой ДНК с помощью электрофореза в агарозном геле. РНКазы должны быть добавлены к образцов до электрофореза, потому что хроматина подготовки все еще содержит большое количество РНК на этой стадии очистки, которые могут помешать визуализации фрагментированной ДНК. Образцы полезны для иммунопреципитации хроматина, если ДНК из не-стриженого хроматина длиннее 10kbp, в то время как ДНК из стриженого хроматина формы мазка с максимальной интенсивностью сигнала вокруг 400bp ДНК.
Мы обычно используют 3% (объем / объем) формальдегида для сшивания хроматина в интактных листьях, но 1% (об. / об) формальдегида может быть достаточным в большинстве случаев. В наших руках, низкие концентрации формальдегида позволяют короче ультразвуком раз и фоновых сигналов в последующей реакции ПЦР. Однако, недостаточное количество формальдегида часто приводит к низкой воспроизводимости результатов ПЦР-сигнала между независимых экспериментов. Это может быть из-за недостаточного проникновения листьев с формальдегидом при низких концентрациях. Убедитесь в том, чтобы обменять свои акции формальдегида часто, как соединение имеет тенденцию к полимеризации с течением времени. Формальдегид решения устойчивы только в течение примерно одного месяца, и этот период вряд ли продлен метанола стабилизации. Рекомендуется для тестирования различных концентраций формальдегида при настройке условий эксперимента.
Количество растительного материала и шлифования:
Важно, чтобы проникнуть небольшое количество листьев материал в большом объеме буфера, чтобы избежать прилипания листьев друг к другу. Листья торчащие часто приводит к недостаточной инфильтрации формальдегида. Кроме того, слишком много растительного материала будет блокировать поры miracloth ткани. Шлифовальные эффективность существенно зависит от использования ступку и пестик, с их идеальной подгонки. Мы регулярно растереть с охлаждаемой жидким азотом пестик и ступка, в отсутствие дополнительных жидким азотом три раза в течение 50 секунд, пока материал измельчается в мелкий порошок.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансировалась немецкий научный фонд (DFG) и совершенство Инициатива немецких федеральных и государственных органов власти.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Белково-А-агарозы | Roche | 11 134 515 001 | зависит от антител класса |
| Белково-G-агарозы | Roche | 11 243 233 001 | зависит от антител класса |
| Анти-hyperacetyl-H4 | Millipore | 06-946 | мы использовали 5 мкл |
| Анти-ацетил-H4K5 | Millipore | 07-327 | мы использовали 5 мкл |
| Анти-ацетил-H4K8 | Millipore | 07-328 | мы использовали 5 мкл |
| Анти-ацетил-H4K12 | Millipore | 07-595 | мы использовали 5 мкл |
| Анти-ацетил-H4K16 | Millipore | 07-329 | мы использовали 5 мкл |
| Анти-ацетил-H4K18 | Millipore | 07-354 | мы использовали 1 мкл |
| Анти-ацетил-H3K9 | Millipore | 07-352 | мы использовали 5 мкл |
| Анти-ацетил-H3K14 | Millipore | 07-353 | мы использовали 1 мкл |
| Анти-триметил-H3K4 | Diagenode | ПАБ-003-50 | мы использовали 5 мкл |
| Анти-диметил-H3K4 | Millipore | 07-030 | мы использовали 5 мкл |
| Анти-монометиловый-H3K4 | Abcam | ab8895 | 2,5-10 мкл |
| Анти-H3 | Abcam | ab1791 | мы использовали 1 мкл и проверить плотность гистонов |
| Bioruptor | Diagenode | UCD-200 К | |
| Волновод MS72 | Bandelin | ||
| Miracloth | Calbiochem | 475855 | |
| Полное ингибитора протеазы | Roche | 11836145001 |
Ссылки
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO rep. 3, 224-229 (2002).
- Ruthenburg, A. J. Methylation of lysine 4 on histone H3: intricacy of writing and reading a single epigenetic. 25, 15-30 (2007).
- Jaskiewicz, M. Chromatin modification acts as a memory for systemic acquired resistance in the plant stress response. EMBO rep. 12, 50-55 (2011).
- Ng, D. W. Ordered histone modifications are associated with transcriptional poising and activation of the phaseolin promoter. Plant Cell. 18, 119-132 (2006).
- Offermann, S. Illumination is necessary and sufficient to induce histone acetylation independent of transcriptional activity at the C4-specific phosphoenolpyruvate carboxylase promoter in maize. Plant Physiol. 141, 1078-1088 (2006).
- Deng, W. Involvement of the histone acetyltransferase AtHAC1 in the regulation of flowering time via repression of FLOWERING LOCUS C in Arabidopsis. Plant Physiol. 143, 1660-1668 (2007).
- Benhamed, M. Arabidopsis GCN5, HD1, and TAF1/HAF2 interact to regulate histone acetylation required for light-responsive gene expression. Plant Cell. 18, 2893-2903 (2006).
- Bowler, C. Chromatin techniques for plant cells. Plant Journal. 39, 776-789 (2004).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde decrosslinked-chromatin immunoprecipitation. Trends Biochem. Sci. 25, 99-104 (2000).
- Haring, M. Chromatin immunoprecipitation: optimization, quantitative analysis and data normalization. Plant Meth. 3, 11-11 (2007).
- Danker, T. Developmental information but not promoter activity controls the methylation state of histone H3 lysine 4 on two photosynthetic genes in maize. Plant J. 53, 465-474 (2008).
- Uknes, S. Acquired resistance in Arabidopsis. Plant Cell. 4, 645-656 (1992).
- Workman, J. L. Nucleosome displacement in transcription. Genes Develop. 20, 2009-2017 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены