Method Article
Detecção de histona Modificações nas folhas das plantas
Neste Artigo
Resumo
Uma abordagem confiável e útil para detectar modificações das histonas em genes específicos de plantas é descrito. A abordagem combina cromatina imunoprecipitação (chip) e real-time PCR quantitativo. Ela permite a detecção de modificações das histonas em genes específicos, com um papel em diversos processos fisiológicos.
Resumo
Estrutura da cromatina é importante para a regulação da expressão gênica em eucariotos. Neste processo, a remodelação da cromatina, a metilação do DNA e modificações covalentes nas caudas amino-terminal de histonas H3 e H4 desempenham papéis essenciais 1-2. H3 e H4 modificações das histonas incluem metilação de lisina e arginina, acetilação da lisina e fosforilação de resíduos de serina 1-2. Essas modificações estão associadas tanto com a ativação do gene, a repressão, ou um estado preparado de gene que suporta a ativação mais rápida e robusta de expressão após a percepção de sinais apropriados (micróbio-padrões moleculares associados, luz, hormônios, etc) 3-7.
Aqui, apresentamos um método para a detecção confiável e sensível de modificações específicas da cromatina em genes de plantas selecionadas. A técnica é baseada na reticulação de (modificado) histonas e DNA com formaldeído 8,9, extração e sonicação da cromatina, cromatina imunoprecipitação (CHIP) com a modificação de anticorpos específicos 9,10, de reticulação de histona-DNA complexos, e gene-específicos em tempo real, PCR quantitativo. A abordagem tem se mostrado útil para detectar modificações específicas histonas associadas C 4 fotossíntese em 5,11 milho e imunidade sistêmica em 3 Arabidopsis.
Protocolo
1. Reticulação de material vegetal
- Colheita 1-2g de folhas de Arabidopsis (6 a 10 centímetros de diâmetro de roseta) em um tubo plástico de 50 ml e encher-se para 40mL com tampão de reticulação.
- Certifique-se de folhas de ficar imersa, por exemplo, encher um direito adaptado esponja do filtro acima da superfície buffer. Em seguida, coloque os tubos em um dessecador.
- Vácuo infiltrado por 10min. A cada tubo adicionar 2,5 ml de glicina 2M para parar de reticulação, e inverter os tubos para justificar a dispersão igual de glicina.
- Vácuo infiltrado por outro 5min e descarte de fluidos, enquanto o corte de folhas em uma peneira.
- Lave as folhas duas vezes com 1L de água em um copo de vidro, em seguida, deixa secar bem com papel toalha.
- Coleta de folhas em um tubo de plástico fresco e congelar em nitrogênio líquido. Loja deixa a -80 ° C até o isolamento da cromatina.
2. Isolamento de cromatina
- Folhas foram moídas com argamassa e pistilo que foram mantidas em nitrogênio líquido até o uso.
- Transferência de pó para um tubo plástico de 50 mL e suspendê-tampão de extração 30mL # 1.
- Incubar por 15 min a 4 ° C em um agitador vertical.
- Filtrado de suspensão por quatro camadas de miracloth em um tubo plástico de 50 mL fresco.
- Rotação por 20min em 2800 xg, a 4 ° C.
- Remover o sobrenadante e pellet suspender com um pincel em tampão de extração 1mL # 2. Primeiro adicionar um pequeno volume de tampão # 2, então suspender o pellet com um pincel, em seguida, adicione o restante do buffer.
- Transferência de suspensão para um tubo de microcentrífuga 1,5 ml e girar para 10min a 12.000 xg, a 4 ° C.
- Enquanto isso, prepare-microcentrífuga 2mL tubos contendo tampão de extração 1,5 ml # 3.
- Remover o sobrenadante do tubo girou (passo 2.7) e suspender sedimento em 300 ul de tampão de extração n º 3. Primeiro adicionar um pequeno volume de tampão # 3, suspender pellet com um pincel, e depois adicionar o buffer restante.
- Pipeta com cuidado o pellet suspenso (passo 2.9) em cima do tampão de extração 1,5 mL # 3 preparada no passo 2.8. Certifique-se que as duas fases não se misturam. Rotação por 1h a 16.000 xg, a 4 ° C.
- Remover o sobrenadante e pellet suspender cromatina com um pincel em 300 ul de tampão de sonicação.
- Sonicate cromatina com um sonotrodo, ou em um banho ultra-sônico, para um tamanho de DNA de aproximadamente 400pb. Quando sonicando, fazer cromatina certeza não vai ser aquecido acima de aproximadamente 30 ° C para proteger sensíveis ao calor ligações cruzadas. A duração da sonicação precisa ser determinado experimentalmente, porque varia significativamente entre os dispositivos sonicação diferentes. Para orientação, as definições para dois dispositivos diferentes são fornecidos:
Para sonicação com uma marca Bandelin sonotrodo expor cromatina em tubo de microcentrífuga de 0,6 ml cinco vezes a 20 explosões com configurações de 25% de energia de ciclo, = 50. Ao fazê-lo amostra, fresco após cada 20 rajadas º em banho de gelo.
Para sonicação com um banho de ultra-som Bioruptor Diagenode, preencha banho com água e gelo e sonicate dez vezes por 30 segundos em tubos de microcentrífuga 1,5 ml com ajuste de 'alto'. Depois a cada 30 segundos, as amostras de fresco por mais 30 segundos.
- Spin-sonicado amostra para 5min a 16.000 g a 4 ° C para precipitar o material não dissolvido. O sobrenadante pode ser usado diretamente para imunoprecipitação. Alternativamente, as amostras podem ser de choque congelado em nitrogênio líquido e armazenadas a -80 ° C até à sua utilização.
3. Imunoprecipitação
- Prepare os tubos de 2 mL de microcentrífuga contendo proteína-A 40μL. Agarose e 1.8mL de anticorpos de ligação de tampão Adicionar 200μL da preparação da cromatina (passo 2.13).
- Incubar os tubos por 1h em um agitador vertical.
- Descarte de proteína-A agarose contas e usar o sobrenadante para imunoprecipitação.
- Remover uma alíquota de 40μL para determinar a concentração de cromatina ('input').
- Adicionar 30μL de proteína-A. Agarose ea quantidade de anticorpos específicos de modificação que está indicado na tabela abaixo de reagentes e equipamentos específicos para suspensão da cromatina 400μL sonicado
- Incubar por 2.5h ou durante a noite em um agitador vertical a 4 ° C.
- Spin down contas de 2min em 440 x g.
- Lavar talão pellet com 900μL de cada tampão de lavagem (veja a lista abaixo). Para cada buffer, contas incubar no buffer de 10min em um agitador vertical a 4 ° C, em seguida, girar para a 2min a 440 xg, elimine o sobrenadante e adicionar o próximo buffer.
- Tampão de lavagem pouco sal
- Tampão de lavagem de alta sal
- LiCl tampão de lavagem
- TE tampão de lavagem
- Após a última lavagem, remover completamente qualquer solução remanescente.
4. De crosslinking de histonas e DNA, e purificação de DNA precipitado
- Adicionar 100μL de reticulação de-buffer para o pellet agarose e amostra 'input' do 40μl a partir do passo 3.4, mix de 5min em um misturador vórtice, as amostras de spin, e incubate a 65 ° C durante a noite.
- Purificar DNA com DNA comercial ou kit de purificação de PCR.
- Tipicamente 5μl de uma diluição de 1:05 do eluído finais são suficientes para executar convencionais lugar específico quantitativa em tempo real de RT-PCR (RT-qPCR).
5. Tabela de buffers
| Buffer de reticulação | |
| Butirato de sódio | 10mM |
| Sacarose | 400mm |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoetanol | 5mM |
| Formaldeído | 3% (v / v) |
| Tampão de extração # 1 | |
| Butirato de sódio | 10mM |
| Sacarose | 400mm |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoetanol | 5mM |
| Inibidor de Protease completo | 1x |
| Tampão de extração # 2 | |
| Butirato de sódio | 10mM |
| Sacarose | 250mm |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoetanol | 5mM |
| MgCl 2 | 10mM |
| Triton X-100 | 1% (w / v) |
| Inibidor de Protease completo | 1x |
| Tampão de extração # 3 | |
| Butirato de sódio | 10mM |
| Sacarose | 1.7M |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoetanol | 5mM |
| MgCl 2 | 2mM |
| Triton X-100 | 0,15% (w / v) |
| Inibidor de Protease completo | 1x |
| Tampão de sonicação | |
| Tris-HCl, pH 8,0 | 25mM |
| EDTA-NaOH, pH 8,0 | 5mM |
| SDS | 0,5% (w / v) |
| Inibidor de Protease completo | 1x |
| Tampão de ligação do anticorpo | |
| Tris-HCl, pH 8,0 | 50mM |
| EDTA-NaOH, pH 8,0 | 1mM |
| NaCl | 150mm |
| Triton X-100 | 0,1% (w / v) |
| Tampão de lavagem pouco sal | |
| NaCl | 150mm |
| SDS | 0,1% (w / v) |
| Triton X-100 | 1% (w / v) |
| EDTA-NaOH, pH 8,0 | 2mM |
| Tris-HCl, pH 8,0 | 20mM |
| Tampão de lavagem de alta sal | |
| NaCl | 500mM |
| SDS | 0,1% (w / v) |
| Triton X-100 | 1% (w / v) |
| EDTA-NaOH, pH 8,0 | 2mM |
| Tris-HCl, pH 8,0 | 20mM |
| LiCl tampão de lavagem | |
| Cloreto de lítio | 250mm |
| Nonidet-P40 | 1% (v / v) |
| Desoxicolato de sódio | 1% (w / v) |
| EDTA-NaOH, pH 8,0 | 1mM |
| Tris-HCl, pH 8,0 | 20mM |
| TE tampão de lavagem | |
| EDTA-NaOH, pH 8,0 | 10mM |
| Tris-HCl, pH 8,0 | 1mM |
| Tampão Decrosslinking | |
| Tris-HCl, pH 6,8 | 62,5 mm |
| NaCl | 200mM |
| SDS | 2% (w / v) |
| TDT | 10mM |
6. Resultados representativos:
Expressão do gene Arabidopsis thaliana defesa PR2 codifica uma β-1,3-glucanase com atividade antimicrobiana 12, foi induzido por benzothiadiazole (BTH), um análogo sintético do ácido salicílico hormônio vegetal 3. Figura 1 demonstra que a ativação de PR2 expressão é associada a um aumento na acetilação de resíduos de lisina na histona H3 e H4 do promotor PR2. Como a densidade diminui nucleosome durante a ativação do gene 13, os valores de acetilação das histonas foram normalizados para o sinal obtido com um anticorpo para uma região invariante de 3 histonas.
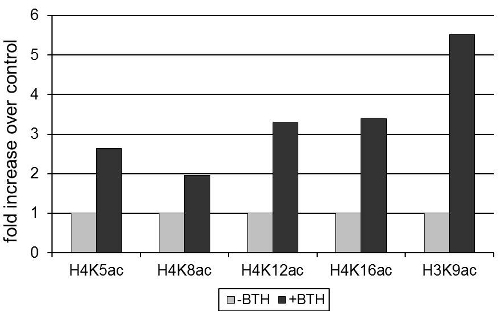
Figura 1 BTH induz acetilação das histonas no promotor PR2 em Arabidopsis. As plantas foram tratadas com 100μM BTH ou um controle de pó molhável. Após 72h, foram coletadas folhas e cromatina foi isolado. O sinal obtido após precipitação com acetilação anticorpos específicos (como indicado na figura) foi normalizada para o sinal obtido por precipitação com um anticorpo para um domínio invariante de histona H3. Cromatina precipitado foi quantificada por RT-qPCR. Dados são padronizados para níveis de modificação das histonas na ausência de tratamento BTH.
Discussão
Etapas mais críticas no protocolo são a reticulação de DNA e histonas, o tipo ea quantidade de material foliar, moagem do material, ea sonicação de cromatina. Para uma discussão mais detalhada dessas questões, ver refs. 9 e 10.
Sonicação e crosslinking:
É importante para interromper cromatina durante a sonicação a fragmentos de cerca de 400pb. Sonicação exaustiva irá destruir cromatina interrompendo DNA e histonas, enquanto que sonicação insuficiente vai deixar fragmentos de cromatina longo. Estes afetam a especificidade do método, porque modificações das histonas distal do locus testados não podem ser discriminados de alterações local. Eficiência sonicação é melhor testado através da recolha de cromatina 20μL de amostras de DNA antes e depois sonicação, de reticulação e histonas, isolando o DNA e determinar o comprimento do DNA cortado por eletroforese em gel de agarose. RNAse deve ser adicionado às amostras antes de eletroforese, porque a preparação da cromatina ainda contém grandes quantidades de RNA nesta fase de purificação que pode interferir com a visualização de DNA fragmentado. As amostras são úteis para imunoprecipitação da cromatina se o DNA de cromatina não-cortado é maior do que 10kbp, enquanto que o DNA de cromatina sheared forma uma mancha com intensidade máxima do sinal em torno de 400pb de DNA.
Rotineiramente usamos 3% (v / v) de formaldeído para crosslinking cromatina em folhas intactas, mas 1% (v / v) de formaldeído pode ser suficiente na maioria dos casos. Em nossas mãos, as concentrações de formaldeído baixo permitem menor tempo de sonicação e sinais de fundo em reações consequente PCR. No entanto, quantidades insuficientes de formaldeído muitas vezes resultam em baixa reprodutibilidade do sinal de PCR entre os experimentos independentes. Isso pode ser devido a penetração insuficiente de folhas com formaldeído em baixas concentrações. Certifique-se de trocar o seu estoque de formaldeído com freqüência como o composto tende a polimerizar com o tempo. As soluções de formaldeído são estáveis apenas para cerca de um mês, e este período é prolongado por quase estabilização metanol. É aconselhável a análise de diferentes concentrações de formaldeído durante a configuração de condições experimentais.
Quantidade de material vegetal e de moagem:
É importante para se infiltrar pequenas quantidades de material foliar em um grande volume de tampão para evitar que as folhas grudem umas nas outras. Folha furando muitas vezes resulta em infiltração insuficiente de formaldeído. Além disso, o material vegetal muito vai bloquear os poros do tecido miracloth. A eficiência de moagem depende consideravelmente usando um almofariz e um pilão, com o ajuste perfeito. Rotineiramente moer com nitrogênio líquido refrigerado pilão na ausência de nitrogênio líquido adicional de três vezes por 50 segundos até que o material é moído para um pó fino.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pela Fundação Alemã de Ciência (DFG) ea Iniciativa de Excelência dos governos federal alemão e do Estado.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| Proteína-A-Agarose | Roche | 11 134 515 001 | depende da classe de anticorpos |
| Proteína-G-Agarose | Roche | 11 243 233 001 | depende da classe de anticorpos |
| Anti-hyperacetyl-H4 | Millipore | 06-946 | usamos 5μL |
| Anti-acetil-H4K5 | Millipore | 07-327 | usamos 5μL |
| Anti-acetil-H4K8 | Millipore | 07-328 | usamos 5μL |
| Anti-acetil-H4K12 | Millipore | 07-595 | usamos 5μL |
| Anti-acetil-H4K16 | Millipore | 07-329 | usamos 5μL |
| Anti-acetil-H4K18 | Millipore | 07-354 | usamos 1μL |
| Anti-acetil-H3K9 | Millipore | 07-352 | usamos 5μL |
| Anti-acetil-H3K14 | Millipore | 07-353 | usamos 1μL |
| Anti-trimetil-H3K4 | Diagenode | PAB-003-50 | usamos 5μL |
| Anti-dimetil-H3K4 | Millipore | 07-030 | usamos 5μL |
| Anti-monometil-H3K4 | Abcam | ab8895 | 2,5-10μL |
| Anti-H3 | Abcam | ab1791 | usamos 1μL para verificar a densidade das histonas |
| Bioruptor | Diagenode | UCD TO-200 | |
| Sonotrodo MS72 | Bandelin | ||
| Miracloth | Calbiochem | 475855 | |
| Inibidor de Protease completo | Roche | 11836145001 |
Referências
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO rep. 3, 224-229 (2002).
- Ruthenburg, A. J. Methylation of lysine 4 on histone H3: intricacy of writing and reading a single epigenetic. 25, 15-30 (2007).
- Jaskiewicz, M. Chromatin modification acts as a memory for systemic acquired resistance in the plant stress response. EMBO rep. 12, 50-55 (2011).
- Ng, D. W. Ordered histone modifications are associated with transcriptional poising and activation of the phaseolin promoter. Plant Cell. 18, 119-132 (2006).
- Offermann, S. Illumination is necessary and sufficient to induce histone acetylation independent of transcriptional activity at the C4-specific phosphoenolpyruvate carboxylase promoter in maize. Plant Physiol. 141, 1078-1088 (2006).
- Deng, W. Involvement of the histone acetyltransferase AtHAC1 in the regulation of flowering time via repression of FLOWERING LOCUS C in Arabidopsis. Plant Physiol. 143, 1660-1668 (2007).
- Benhamed, M. Arabidopsis GCN5, HD1, and TAF1/HAF2 interact to regulate histone acetylation required for light-responsive gene expression. Plant Cell. 18, 2893-2903 (2006).
- Bowler, C. Chromatin techniques for plant cells. Plant Journal. 39, 776-789 (2004).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde decrosslinked-chromatin immunoprecipitation. Trends Biochem. Sci. 25, 99-104 (2000).
- Haring, M. Chromatin immunoprecipitation: optimization, quantitative analysis and data normalization. Plant Meth. 3, 11-11 (2007).
- Danker, T. Developmental information but not promoter activity controls the methylation state of histone H3 lysine 4 on two photosynthetic genes in maize. Plant J. 53, 465-474 (2008).
- Uknes, S. Acquired resistance in Arabidopsis. Plant Cell. 4, 645-656 (1992).
- Workman, J. L. Nucleosome displacement in transcription. Genes Develop. 20, 2009-2017 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados