Method Article
植物の葉におけるヒストン修飾の検出
要約
特定の植物遺伝子上にヒストン修飾を検出するために信頼性の高い有用なアプローチが説明されています。アプローチは、クロマチン免疫沈降(ChIP)とリアルタイム定量PCRを兼ね備えています。それは、多様な生理学的プロセスにおいて役割を持つ特定の遺伝子のヒストン修飾の検出を可能にする。
要約
クロマチン構造は、真核生物における遺伝子発現の調節に重要である。このプロセスでは、ヒストンH3およびH4のアミノ末端尾部でのクロマチンリモデリング、DNAメチル化、および共有結合修飾は、本質的な役割1〜2果たす。 H3およびH4ヒストン修飾は、リジンやアルギニンのメチル化、リジンのアセチル化、および1-2のセリン残基のリン酸化が含まれています。これらの修飾は遺伝子の活性化、抑制、または適切な信号(微生物体関連分子パターン、光、ホルモン、等)3-7の認識の後の式のより迅速かつ堅牢な活性化をサポートしている遺伝子のプライミング状態のいずれかで関連付けられています。
ここでは、選択された植物遺伝子上の特定のクロマチン修飾の信頼性と感度に検出する手法を提案する。技術は、特異的修飾抗体9,10、ヒストン- DNA複合体の脱架橋、とクロマチン、クロマチン免疫沈降(ChIP)の抽出及び超音波処理、ホルムアルデヒド8,9付き(修正)ヒストンとDNAの架橋に基づいており、遺伝子特異的リアルタイム定量PCR。アプローチは、トウモロコシ5,11およびシロイヌナズナ3の全身性免疫におけるC 4光合成に関連する特定のヒストン修飾を検出するために役立っています。
プロトコル
1。植物材料の架橋
- 50 mlのプラスチックチューブで収穫シロイヌナズナの葉の1〜2グラム(6〜10cmのロゼットの直径)と架橋のバッファと40mlのためにいっぱいに。
- 葉は右側のバッファの表面上に合わせたフィルタースポンジを詰めることによって、例えば、浸漬滞在を確認してください。その後、デシケーター中にチューブを置きます。
- 真空は、10分間浸潤。各チューブに架橋を停止するには2Mグリシンの2.5mLを追加し、そしてグリシンの均等分散を保証するためにチューブを反転させる。
- 真空は、別の5分間に潜入し、ふるいに葉を収穫しながら液を捨てる。
- 洗浄は、ガラスのビーカーの水の1L、徹底的にペーパータオルで乾燥した葉で二回葉。
- 新鮮なプラスチック製のチューブで葉を収集し、液体窒素中で凍結する。店は-80葉° Cまでのクロマチンの単離。
2。クロマチンの単離
- 葉は、使用するまで液体窒素中に保管されたモルタルと雌しべで粉砕した。
- を50 mLプラスティックチューブに粉を移し、30mLを抽出バッファー#1で一時停止。
- オーバーヘッドシェーカー上で4℃で15分間インキュベートする。
- 新鮮な50 mLのプラスチックチューブにミラクロスの4つの層を介してろ液は、懸濁液。
- 4℃で2800 × gで20分のためにスピン℃に
- 上清を除去し、1mLの抽出バッファー#2のペイントブラシでペレットを懸濁する。まず、ペイントブラシでペレットを中断し、バッファの残りを追加し、バッファ#2の小さなボリュームを追加します。
- 4℃で12,000 xgで10分間1.5mlのマイクロチューブとスピンして懸濁液を移す℃に
- 一方、1.5mlの抽出バッファー#3を含む液2ml、マイクロチューブを用意する。
- 紡糸管(ステップ2.7)から上清を除去し、抽出緩衝液第3位の300μLでペレットを懸濁する。最初のバッファの小さなボリュームを追加する#3、ペイントブラシでペレットを中断し、残りのバッファを追加します。
- ステップ2.8で作成した1.5 mLの抽出バッファー#3の上に慎重にピペット中断ペレットを(ステップ2.9)。二つの相が混在しないことを確認してください。 4℃で16000 × gで1時間のためにスピン℃に
- 上清を除去し、超音波処理のバッファの300μLでペイントブラシでクロマチンペレットを中断。
- 約400bpのDNAの大きさに、sonotrodeと、または超音波浴中でクロマチンを超音波処理してください。超音波処理するときに、クロマチンは° Cは熱に敏感な架橋を保護するために約30以上に加熱されることはありませんことを確認してください。それは別の超音波デバイスの間に著しく変化するため、超音波処理の期間は、実験的に決定する必要があります。ガイダンスについては、二つの異なるデバイスの設定が用意されています:
設定は25%の電力で0.6mL微量遠心管でBandelinブランドsonotrodeを公開クロマチンと超音波処理のための5倍〜20バースト、周期= 50。氷浴では20 番目のバーストの後に、編集作業中に、涼しいサンプル。
DiagenodeのBioruptor超音波洗浄機と超音波処理の場合は、水と氷で風呂を記入し、"高"に設定して1.5mlのマイクロチューブに30秒間十倍を超音波で分解する。毎30秒後、別の30秒間クールなサンプル。
- スピンは4で16,000 gで5分間サンプルを超音波処理℃で溶解していない物質を沈殿させる。上清を直接免疫沈降に使用することができます。また、サンプルは、衝撃、液体窒素で凍結し、-80℃で保存できますさらに使用するまでのC。
3。免疫沈降
- 40μlのタンパク質 - 抗体 - 結合バッファーのアガロースおよび1.8mLを含む2 mLのマイクロ遠心チューブを準備します。クロマチンの調製(ステップ2.13)の200μLを追加。
- オーバーヘッドシェーカーで1時間のためのチューブをインキュベートします。
- プロテインA -アガロースビーズを破棄し、免疫沈降のために上清を使用してください。
- クロマチンの濃度を('input')を決定するために40μlの-アリコートを削除します。
- 30μlのプロテインA -アガロースおよび400μL音波処理クロマチンの懸濁液に特異的な試薬と設備の下の表に示されている修正特異的抗体の量を追加します。
- 4時オーバーヘッドシェーカー上で2.5時間または一晩インキュベート℃に
- 440 xgで2分間ビーズをスピンダウン
- 各洗浄バッファーの900μL(下のリストを参照)ビーズペレットを洗浄します。各バッファの場合は、4℃でオーバーヘッドシェーカーで10分間バッファーでビーズをインキュベートして、440 xgで2分間スピンし上清を捨て、そして次のバッファを追加します。
- 低塩の洗浄バッファー
- 高塩分洗浄バッファー
- LiClを洗浄バッファー
- TE洗浄バッファー
- 最終洗浄後、完全に残っているバッファを削除します。
4。ヒストンとDNAの脱架橋、および沈殿したDNAの精製
- アガロースをペレットと40μlの"入力"のサンプル手順3.4、ボルテックスミキサーで5分のミックス、スピンのサンプルから、とincuに脱架橋バッファー100μLを加える℃で一晩65℃で脱灰する。
- 市販のDNAやPCR精製キットでDNAを精製。
- 通常は最後のカラム溶出液の1:5希釈の5μlのは、実行するのに十分であり、従来の遺伝子座特異的リアルタイム定量RT - PCR(RT - QPCR)。
5。バッファの表
| 架橋バッファ | |
| 酪酸ナトリウム | 10mMの |
| スクロース | 400mmの |
| トリス- HCl、pH8.0の | 10mMの |
| β-メルカプトエタノール | 5mMの |
| ホルムアルデヒド | 3%(v / v)の |
| 抽出緩衝液第1位 | |
| 酪酸ナトリウム | 10mMの |
| スクロース | 400mmの |
| トリス- HCl、pH8.0の | 10mMの |
| β-メルカプトエタノール | 5mMの |
| 完全なプロテアーゼ阻害剤 | 1X |
| 抽出バッファー#2 | |
| 酪酸ナトリウム | 10mMの |
| スクロース | 250mmの |
| トリス- HCl、pH8.0の | 10mMの |
| β-メルカプトエタノール | 5mMの |
| MgCl 2の | 10mMの |
| トリトンX - 100 | 1%(w / v)の |
| 完全なプロテアーゼ阻害剤 | 1X |
| 抽出緩衝液第3位 | |
| 酪酸ナトリウム | 10mMの |
| スクロース | 1.7M |
| トリス- HCl、pH8.0の | 10mMの |
| β-メルカプトエタノール | 5mMの |
| MgCl 2の | 2mMの |
| トリトンX - 100 | 0.15%(w / v)の |
| 完全なプロテアーゼ阻害剤 | 1X |
| 超音波処理のバッファ | |
| トリス- HCl、pH8.0の | 25mMの |
| EDTA - NaOHで、pH8.0の | 5mMの |
| SDS | 0.5%(w / v)の |
| 完全なプロテアーゼ阻害剤 | 1X |
| 抗体結合バッファー | |
| トリス- HCl、pH8.0の | 50mmの |
| EDTA - NaOHで、pH8.0の | 1mMの |
| NaClの | 150MM |
| トリトンX - 100 | 0.1%(w / v)の |
| 低塩の洗浄バッファー | |
| NaClの | 150MM |
| SDS | 0.1%(w / v)の |
| トリトンX - 100 | 1%(w / v)の |
| EDTA - NaOHで、pH8.0の | 2mMの |
| トリス- HCl、pH8.0の | 20mMの |
| 高塩分洗浄バッファー | |
| NaClの | 500mmの |
| SDS | 0.1%(w / v)の |
| トリトンX - 100 | 1%(w / v)の |
| EDTA - NaOHで、pH8.0の | 2mMの |
| トリス- HCl、pH8.0の | 20mMの |
| LiClを洗浄バッファー | |
| リチウム塩化 | 250mmの |
| ノニデット- P40 | 1%(v / v)の |
| デソキシコール酸ナトリウム | 1%(w / v)の |
| EDTA - NaOHで、pH8.0の | 1mMの |
| トリス- HCl、pH8.0の | 20mMの |
| TE洗浄バッファー | |
| EDTA - NaOHで、pH8.0の | 10mMの |
| トリス- HCl、pH8.0の | 1mMの |
| Decrosslinkingバッファ | |
| トリス- HCl、pH 6.8の | 62.5mM |
| NaClの | 200mmの |
| SDS | 2%(w / v)の |
| DTT | 10mMの |
6。代表的な結果:
βをエンコードするシロイヌナズナPR2防御遺伝子の発現抗菌活性を持つ1,3 -グルカナーゼ12は 、ベンゾチアジアゾール(BTH)、植物ホルモンであるサリチル酸3の合成アナログで誘導した。 図1は、PR2の発現の活性化は、ヒストンのリジン残基のアセチル化の増加に関連付けられている実証PR2プロモーター上のH3とH4。ヌクレオソーム密度が遺伝子の活性化は13減少するため、ヒストンアセチル化の値は、ヒストン3の不変領域に対する抗体を用いて得られた信号のために標準化した。
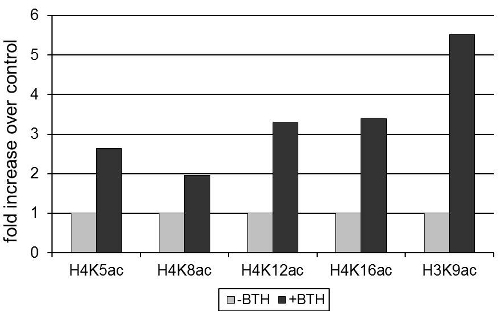
図1 BTHは、シロイヌナズナのPR2プロモーターのヒストンアセチル化を誘導する 。植物は100μMBTHまたは水和剤のコントロールで処理した。 72時間後、葉を採取し、クロマチンを単離した。アセチル化 - 特異的抗体(図に示される)で沈殿後に得られた信号は、ヒストンH3の不変ドメインに対する抗体で沈殿させることにより得られる信号に対して標準化した。沈殿したクロマチンは、RT -定量PCRにより定量した。データは、BTHの治療がない場合のヒストン修飾のレベルの標準化されています。
ディスカッション
プロトコルにおいて最も重要なステップは、材料の研削、およびクロマチンの超音波処理、DNAとヒストン、型と葉の物質の量の架橋です。これらの問題についての詳細は、refsを参照してください。 9と10。
超音波処理と架橋:
400bp程度の断片に超音波照射時のクロマチンを妨害することが重要です。不十分な超音波処理が長いクロマチンの断片を残すのに対し、徹底的な超音波処理は、DNAとヒストンを破壊することによりクロマチンを破壊します。テストした軌跡から遠位ヒストン修飾がローカルの変更と区別できないため、これらは、メソッドの特異性に影響を与えます。超音波処理の効率が最高のDNAを単離し、アガロースゲル電気泳動により断片化したDNAの長さを決定する、超音波処理、脱架橋DNAとヒストンの前と後のサンプルから20μLクロマチンを収集することによってテストされています。クロマチンの準備がまだ断片化したDNAの可視化を妨げる可能性のある精製のこの段階でRNAを大量に含まれているため、RNアーゼは、電気泳動前のサンプルに追加する必要があります。非断片化したクロマチンからDNAが10kbp以上の場合、断片化したクロマチンからDNAは、DNAの400bp前後の最大信号強度とスミアを形成するのに対し、サンプルは、クロマチン免疫沈降のために有用です。
我々は日常的に無傷の葉におけるクロマチン架橋のために3%(v / v)のホルムアルデヒドを使用していますが、1%(v / v)のホルムアルデヒドは、ほとんどのケースで十分な場合があります。私たちの手では、低ホルムアルデヒドの濃度が短い超音波処理時間とそれに伴うPCR反応のバックグラウンドシグナルを可能にする。しかし、ホルムアルデヒドの不十分な量は、しばしば独立した実験の間でPCR信号の低再現性につながる。これは、低濃度でホルムアルデヒドと葉の不十分な浸透に起因するかもしれない。化合物が時間とともに重合する傾向があるので頻繁にホルムアルデヒドの株式を交換することを確認してください。ホルムアルデヒドのソリューションは、約一ヶ月間安定しており、この期間はほとんどメタノールの安定化によって延長されていません。それは、実験条件を設定するときに別のホルムアルデヒド濃度をテストすることをお勧めします。
植物材料の量と研削:
お互いに付着葉を避けるために、バッファの大量の葉材料の少量に潜入することが重要です。葉は、しばしば、ホルムアルデヒドの不十分な浸潤の結果を突き出し。また、あまりにも多くの植物材料は、ミラクロス組織の細孔をブロックします。粉砕効率が大幅に完璧にフィットで乳鉢と乳棒を使用してによって異なります。材料を微粉末に粉砕されるまで、我々は定期的に追加の液体窒素の欠如50秒間、3回の液体窒素冷却乳棒と乳鉢を用いて挽く。
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、ドイツ科学財団(DFG)とドイツ連邦政府と州政府のエクセレンスイニシアチブによって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| プロテイン- A -アガロース | ロッシュ | 11 134 515 001 | 抗体のクラスによって異なります。 |
| プロテイン- G -アガロース | ロッシュ | 11 243 233 001 | 抗体のクラスによって異なります。 |
| 抗hyperacetyl - H4 | ミリポア | 06から946 | 我々は、5μLを用い |
| 抗アセチル- H4K5 | ミリポア | 07から327 | 我々は、5μLを用い |
| 抗アセチル- H4K8 | ミリポア | 07から328 | 我々は、5μLを用い |
| 抗アセチル- H4K12 | ミリポア | 07から595 | 我々は、5μLを用い |
| 抗アセチル- H4K16 | ミリポア | 07から329 | 我々は、5μLを用い |
| 抗アセチル- H4K18 | ミリポア | 07から354 | 我々は、1μLを用い |
| 抗アセチル- H3K9 | ミリポア | 07から352 | 我々は、5μLを用い |
| 抗アセチル- H3K14 | ミリポア | 07から353 | 我々は、1μLを用い |
| 抗トリメチル- H3K4 | Diagenodeの | PAB - 003から50 | 我々は、5μLを用い |
| 抗ジメチル- H3K4 | ミリポア | 07から030 | 我々は、5μLを用い |
| 抗モノメチル- H3K4 | アブカム | ab8895 | 2,5 -10μL |
| 抗H3 | アブカム | ab1791 | 我々は、ヒストンの密度を確認するために1μLを用い |
| Bioruptor | Diagenodeの | UCD - 200に | |
| Sonotrode MS72 | Bandelin | ||
| ミラクロス | カルビオケム | 475855 | |
| 完全なプロテアーゼ阻害剤 | ロッシュ | 11836145001 |
参考文献
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO rep. 3, 224-229 (2002).
- Ruthenburg, A. J. Methylation of lysine 4 on histone H3: intricacy of writing and reading a single epigenetic. 25, 15-30 (2007).
- Jaskiewicz, M. Chromatin modification acts as a memory for systemic acquired resistance in the plant stress response. EMBO rep. 12, 50-55 (2011).
- Ng, D. W. Ordered histone modifications are associated with transcriptional poising and activation of the phaseolin promoter. Plant Cell. 18, 119-132 (2006).
- Offermann, S. Illumination is necessary and sufficient to induce histone acetylation independent of transcriptional activity at the C4-specific phosphoenolpyruvate carboxylase promoter in maize. Plant Physiol. 141, 1078-1088 (2006).
- Deng, W. Involvement of the histone acetyltransferase AtHAC1 in the regulation of flowering time via repression of FLOWERING LOCUS C in Arabidopsis. Plant Physiol. 143, 1660-1668 (2007).
- Benhamed, M. Arabidopsis GCN5, HD1, and TAF1/HAF2 interact to regulate histone acetylation required for light-responsive gene expression. Plant Cell. 18, 2893-2903 (2006).
- Bowler, C. Chromatin techniques for plant cells. Plant Journal. 39, 776-789 (2004).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde decrosslinked-chromatin immunoprecipitation. Trends Biochem. Sci. 25, 99-104 (2000).
- Haring, M. Chromatin immunoprecipitation: optimization, quantitative analysis and data normalization. Plant Meth. 3, 11-11 (2007).
- Danker, T. Developmental information but not promoter activity controls the methylation state of histone H3 lysine 4 on two photosynthetic genes in maize. Plant J. 53, 465-474 (2008).
- Uknes, S. Acquired resistance in Arabidopsis. Plant Cell. 4, 645-656 (1992).
- Workman, J. L. Nucleosome displacement in transcription. Genes Develop. 20, 2009-2017 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved