Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cuantificación de la actividad agonista en el G receptores acoplados a proteínas
En este artículo
Resumen
Un método para estimar la constante de afinidad de un agonista para el estado activo ( K B) De una proteína G-receptor acoplado se describe. El análisis proporciona medidas absolutas o relativas de K B Dependiendo de si la activación del receptor constitutiva se puede medir. Nuestro método se aplica a abajo varias respuestas de activación de los receptores.
Resumen
Cuando un agonista activa una población de G receptores acoplados a proteínas (GPCRs), que provoca una vía de señalización que culmina en la respuesta de la célula o tejido. Este proceso puede ser analizado a nivel de un solo receptor, con una población de receptores, o una respuesta abajo. A continuación se describe la forma de analizar la respuesta de abajo para obtener una estimación de la afinidad agonista constante para el estado activo de los receptores individuales.
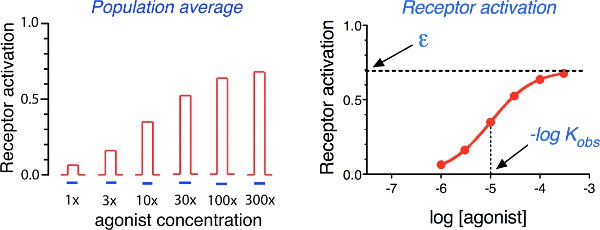
Receptores se comportan como interruptores cuánticos que se alternan entre los estados activos e inactivos (Figura 1). El estado activo interacciona con las proteínas G específica u otros socios de señalización. En ausencia de ligandos, el estado inactivo predomina. La unión de agonistas aumenta la probabilidad de que el receptor pasará al estado activo, porque su constante de afinidad para el estado activo (K b) es mucho mayor que para el estado inactivo (K a). La suma de lossalidas al azar de todos los receptores en la población de los rendimientos de un nivel constante de activación de los receptores en el tiempo. El recíproco de la concentración del agonista de la mitad de la máxima provocar la activación del receptor es equivalente a la constante de afinidad observada (K obs), y la fracción de los complejos agonista de los receptores en el estado activo se define como la eficacia (ε) (Figura 2).
Métodos para el análisis de las respuestas aguas abajo de GPCRs han sido desarrollados, que permiten la estimación de la K obs y la eficacia relativa de un 1,2 agonista. En este informe, se muestra cómo modificar este análisis para estimar el valor de b agonistas K respecto a la de otro agonista. Para los ensayos que muestran actividad constitutiva, se muestra cómo estimar K b en unidades absolutas de M-1.
Nuestro método de análisis de agonista curvas concentración-respuesta consiste en 3,4de regresión no lineal utilizando mundial el modelo de operación 5. Se describe un procedimiento a través de la aplicación de software, Prism (GraphPad Software, Inc., San Diego, CA). El análisis se obtiene una estimación del producto de K obs y un parámetro proporcional a la eficacia (τ). La estimación de τK obs de un agonista, dividido por el de otro, es una medida relativa de K b (AR I) 6. Para cualquier receptor exhiben una actividad constitutiva, es posible estimar un parámetro proporcional a la eficacia del complejo de receptores libres (τ sistema). En este caso, el valor de K b de un agonista es equivalente a τK obs / τ sistema 3.
Nuestro método es útil para determinar la selectividad de un agonista de los subtipos de receptores y para cuantificar el agonista del receptor de señalización a través de diferentes proteínas G.
Protocolo
1. La medición de agonista curvas concentración-respuesta: no hay actividad constitutiva
- Para la estimación de los valores relativos de agonistas K b (RA i), una serie de al menos dos agonistas de curvas concentración-respuesta se requiere. Cualquier ensayo in vitro de la respuesta funcional de un GPCR puede ser medido, siempre que la concentración de agonista puede ser controlado y un solo tipo de receptor media la respuesta. Adecuados ensayos basados en células incluyen la medición de 4,7 y la acumulación de AMPc inositolfosfato 8,9 en una línea de células que expresan un receptor recombinante. Ejemplos de ensayos de todo el tejido incluyen la medición de la contracción del músculo liso de 10 o M-2 de los receptores muscarínicos y β 1-adrenérgicos mediada por alteraciones de la contracción de la rata de campo estimuló la aurícula izquierda 11.
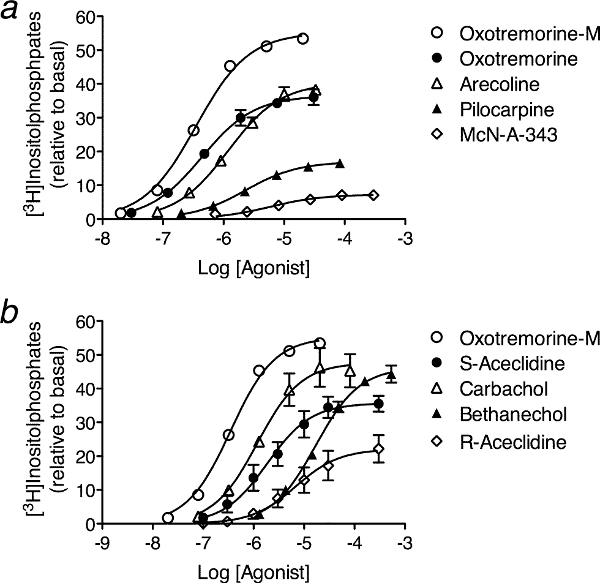
- Elija una serie de agonistas para el análisis como un agonista altamente eficaz(Por ejemplo, ligando, endógena). En un experimento dado, medida completa curvas concentración-respuesta para cada agonista. Si el número de agonistas es demasiado grande para completar el ensayo en un solo experimento, se dividen los agonistas en subgrupos, cada uno con un número manejable de los agonistas de un solo experimento. Para cada subgrupo, medir la curva concentración-respuesta del agonista altamente eficaces, junto con las de los otros agonistas en el subgrupo (ver Figura 3). Repita el experimento para cada subgrupo de 3 a 6 veces, aproximadamente, dependiendo de la variabilidad de los datos.
- Para cada curva concentración-respuesta, medir la respuesta en ausencia del agonista (respuesta basal), y en presencia de concentraciones crecientes del agonista. Espacio de las concentraciones de agonista de manera uniforme en una escala logarítmica aproximadamente cada 0,3 a 0,7 log 10 unidades, que cubren la gama de respuestas y la definición de la respuesta máxima (E max) (ver Figura 3). Para experimlos padres sobre las líneas celulares, cada medición se realizó por triplicado.
- Resta la respuesta basal de la que se mide en la presencia de cada concentración de agonista. Las respuestas presentan en la Figura 3 se calcula de esta manera.
2. El análisis preliminar de agonista curvas concentración-respuesta: no hay actividad constitutiva
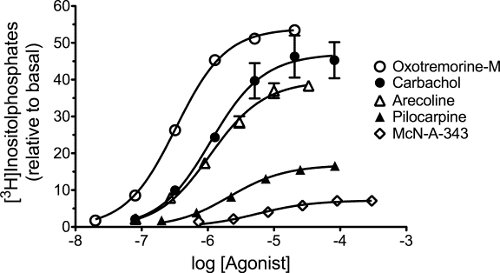
- Introduzca los datos de los experimentos de concentración-respuesta (por ejemplo, la Figura 5) en una tabla de datos en Prism. Todas las concentraciones de registro agonista se indican en la columna titulada X. Las medidas de respuesta para el agonista de la que parece tener el valor de E max grande se introducen en la columna A, y los de los agonistas de otros se introducen en las columnas adyacentes letras. Mediciones repetidas de las curvas de concentración-respuesta se introducen en sub-columnas de una determinada columna con letras.
- Seleccione la hoja de gráfico en el que se representan los datos, y analizar los datos mediante análisis de regresión no lineal utilizandola ecuación de derecho, log (agonista) vs respuesta - pendiente variable (cuatro parámetros). Restringir el "fondo" parámetro a cero, y realizar el análisis de regresión. Copie el "Top" (E max) y registro CE de 50 parámetros en una hoja de cálculo Excel para su uso en el cálculo de las estimaciones de los parámetros iniciales. El agonista con la estimación más grande de E max es designado como el "agonista estándar", mientras que los agonistas son designados como "agonistas de la prueba".
- Calcular la estimación inicial de registro τK obs (LOGR1) como el logaritmo negativo valor de EC50 de agonista estándar (-log EC 50 ').
Calcular la estimación inicial de la RA registro i valor de cada agonista de prueba (Logra) como log {(Top CE * 50 ') / (Top' * EC 50)}, en el que los parámetros del agonista estándar se indican con un apóstrofo .
Calcular el registro de afinidad Constants de los agonistas de la prueba (LOGK2 - LOGK5) como el logaritmo negativo de sus respectivos valores de EC50.
3. La estimación de los valores agonista RAi utilizando análisis de regresión no lineal: no hay actividad constitutiva
- Introducir los datos en una tabla de datos en el prisma como se describió anteriormente en el punto 2.1. Asegúrese de que los datos para el agonista estándar se introducen en la columna A.
- Introduzca una ecuación definida por el usuario, "log Rai", en Prisma en varias líneas, como se muestra para el caso que involucra a un total de cinco agonistas:
- Introduzca las estimaciones iniciales de los parámetros de la siguiente manera:
Introduzca un valor arbitrariamente baja de 0 en el registro constante de afinidad (LOGK1) del agonista estándar.
Entrar en la estimación inicial deLOGR y las constantes de afinidad (LOGK2 - LOGK5) y registro de valores RAi (Logra) de los agonistas de la prueba.
Asignar el presupuesto inicial del factor de pendiente del transductor (M) un valor de 1,0.
Asignar la estimación inicial de la respuesta máxima del sistema (MSys) un valor equivalente al máximo E del agonista estándar (Top). - Aplican las restricciones siguientes parámetros: LOGK1 obligado a la constante, 0; LOGR1, MSys y M, valor compartido para todos los conjuntos de datos; LOGK2 - LOGK5 y Logra, sin restricciones.
- Iniciar el análisis de regresión no lineal. Los resultados de rendimiento del log K obs y registro RA i los valores de los agonistas de la prueba. Si el agonista de la norma es un agonista completo, entonces el tanto en el log K obs y registro de valores de RA i son exactas. Si el agonista más eficaz (agonista estándar) es en realidad un agonista parcial, el K obs valores de los más eficaces agonists puede ser sobreestimado. Sin embargo, las estimaciones de registro RA i todavía precisa en esta situación.
- Si la regresión no converge, el experimentador puede desear para trazar la curva teórica definida por los parámetros estimados iniciales. Si hay grandes desviaciones entre los puntos de datos y las curvas teóricas, revisar el cálculo de las estimaciones de los parámetros iniciales. Si uno o más agonistas han Emax los valores equivalentes a la del agonista de la norma, puede ser necesario limitar su log K obs valores a 0 para la regresión a converger en una solución.
- Para la estimación de los agonistas K valores de b en unidades absolutas de M-1, basado en células en ensayos in vitro se utilizan muestran que la actividad constitutiva del receptor. Constituciónla actividad del receptor TIV se define como el aumento de la respuesta por encima del nivel basal causada por la expresión del receptor de interés.
- Elija agonistas y el diseño del experimento se describe en la sección 1.2.
- Para cada curva concentración-respuesta, medir la respuesta ante la ausencia de agonistas en células no transfectadas (respuesta basal) y en las células transfectadas con el receptor de interés (respuesta basal + respuesta constitutiva). Medir la respuesta en la presencia de diferentes concentraciones de los distintos agonistas como se describe en la Sección 1.3.
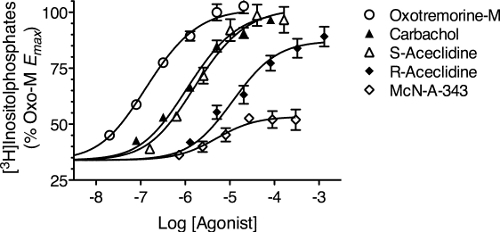
- Calcular la actividad del receptor constitutiva y la respuesta a cada concentración de agonista como la respuesta medido menos la respuesta basal en las células no transfectadas con el receptor. La figura 6 muestra las respuestas a diversos agonistas calculado de esta manera por una vía de señalización que exhiben actividad constitutiva muy bajo.
5. Preliminar de unalysis agonista de curvas concentración-respuesta exhibe la actividad constitutiva
- Introduzca los datos (por ejemplo, la Figura 6) en una tabla de datos en el prisma como se describe en la sección 3.1, pero también entran en la respuesta causada por la actividad del receptor constitutiva en las columnas correspondientes letras que corresponde a una concentración de agonista registro de -20. Un logaritmo negativo grande se entra a la aproximación de una concentración de agonista de cero.
- Analizar los datos como se describe anteriormente en la sección 2.2, pero con el "fondo" de parámetros limitados por lo que es "común para todos los conjuntos de datos." Copie el "Top" (E max), compartida "Abajo" y registro de parámetros de EC50 en una hoja de cálculo Excel para su uso en el cálculo de las estimaciones de los parámetros iniciales.
- Calcular las estimaciones iniciales de los parámetros de la siguiente manera:
La afinidad de registro constante de los agonistas estándar (LOGK1) o cualquier otro agonista total, la prueba debe ser determinado en experimentos separados como se describió anteriormente 3 .
Calcular la estimación inicial del log K obs valor de cada prueba agonista parcial (es decir, sólo LOGK2 en este caso) como log {(Top'-Top) / (CE 50 (Top'-Bottom))}, en el que "Bottom "denota la respuesta causada por la activación del receptor constitutiva.
Calcular la estimación inicial de log K b (LOGKb) para cada agonista como log {Inicio / (EC 50 inferior)}.
Calcular la estimación inicial de registro de sistema τ (LOGTsys) como log {inferior / (Top '- inferior)}.
6. Estimación de los valores Kb agonista de respuestas presentan una actividad constitutiva del receptor mediante el análisis de regresión no lineal
- Introducir los datos en una tabla de datos en el prisma como se describió anteriormente en el punto 3.1
- Introduzca una ecuación definida por el usuario, "Registro de Kb", en Prisma en varias líneas, como se muestra por la condición de dos agonistas:
- Introduzca las estimaciones iniciales de los parámetros de la siguiente manera:
Introduzca las constantes de afinidad de cada agonista (LOGK1 - introduzca un valor determinado en el paso 5.3).
Entrar en el K obs estimaciones de cada agonista de prueba.
Introduzca las estimaciones Kb de los agonistas.
Escriba log τ sistema (LOGTsys) estiman.
Asignar el factor de la pendiente del transductor (M) y la respuesta máxima del sistema (MSys) los valores de 1,0 y 'Top (E max de los agonistas de serie), respectivamente. - Aplican las restricciones siguientes parámetros: LOGTsys, MSys y M, valor compartido para todos los conjuntos de datos; LOGK2 y LOGKb, sin restricciones.
- Iniciar el análisis de regresión no lineal. Los resultados de rendimiento en el registro de K b del agonista estándar, el log K obs y registro de valores de K b de los agonistas parciales, y la respuesta máxima del sistema (MSys), el valor de τ sistema para el complejo receptor libre (LOGTsys), y el factor de la pendiente del transductor en el modelo de operación (M).
- Si la regresión no converge, siga los pasos descritos anteriormente en el punto 3.6.
Discusión
Debido a que nuestro método de estimación de la AR I (relativo valor de K b) sólo se requiere la medición de los agonistas de curvas concentración-respuesta, nuestro análisis se puede hacer en cualquier momento estas curvas se miden.
Si el día a día, la variación en la respuesta de la preparación experimental (por ejemplo, las células o tejido) es grande, las medidas de respuesta de cada curva concentración-respuesta puede ser normalizada con respec...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por los Institutos Nacionales de Salud Grant GM 69829.
Referencias
- Stephenson, R. P. A modification of receptor theory. British Journal of Pharmacology. 11, 379-393 (1956).
- Furchgott, R. F. The use of b-haloalkylamines in the differentiation of receptors and in the determination of dissociation constants of receptor-agonist complexes. Advances in Drug Research. 3, 21-55 (1966).
- Ehlert, F. J., Suga, H., Griffin, M. T. Analysis of agonism and inverse agonism in functional assays with constitutive activity: Estimation of orthosteric ligand affinity constants for active and inactive receptor states. J. Pharmacol. Exp. Ther. 33, 671-686 (2011).
- Griffin, M. T., Figueroa, K. W., Liller, S., Ehlert, F. J. Estimation of Agonist Activity at G Protein-Coupled Receptors: Analysis of M2 Muscarinic Receptor Signaling through Gi/o,Gs, and G15. J. Pharmacol. Exp. Ther. 321, 1193-1207 (2007).
- Black, J. W., Leff, P. Operational models of pharmacological agonism. Proceedings of the Royal Society of LondonSeries B: Biological Sciences. 220, 141-162 (1983).
- Tran, J. A., Chang, A., Matsui, M., Ehlert, F. J. Estimation of relative microscopic affinity constants of agonists for the active state of the receptor in functional studies on M2 and M3 muscarinic receptors. Mol. Pharmacol. 75, 381-396 (2009).
- Schultz, J., Hamprecht, B., Daly, J. W. Accumulation of adenosine 3':5'-cyclic monophosphate in clonal glial cells: labeling of intracellular adenine nucleotides with radioactive adenine. Proceedings of the National Academy of Sciences of the United States of America. 69, 1266-1270 (1972).
- Berridge, M. J., Downes, C. P., Hanley, M. R. Lithium amplifies agonist-dependent phosphatidylinositol responses in brain and salivary glands. Biochemical Journal. 206, 587-595 (1982).
- Kendall, D. A., Hill, S. J. . Methods in Neurotransmitter Receptor Analysis. , 68-87 (1990).
- Pulido-Rios, M. Vitro Isolated Tissue Functional Muscarinic Receptor Assays. Current Protocols in Pharmacology. 48, 4-15 (2010).
- Kenakin, T., Enna, S. J. . Current Protocols in Pharmacology. , (2001).
- Ehlert, F. J., Griffin, M. T., Sawyer, G. W., Bailon, R. A. simple method for estimation of agonist activity at receptor subtypes: comparison of native and cloned M3 muscarinic receptors in guinea pig ileum and transfected cells. Journal of Pharmacology and Experimental Therapeutics. 289, 981-992 (1999).
- Burstein, E. S., Spalding, T. A., Brann, M. R. Pharmacology of muscarinic receptor subtypes constitutively activated by G proteins. Mol. Pharmacol. 51, 312-319 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados