このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Gタンパク質共役受容体でアゴニスト活性を定量化
要約
アクティブ状態のためのアゴニストの親和定数を推定する方法( K B)Gタンパク質共役型受容体の多くは説明されています。分析は、絶対または相対的な尺度を提供する K B構成的受容体の活性化が測定可能であるかどうかによって異なります。私たちの方法は、受容体の活性化から、様々な応答の下流に適用されます。
要約
アゴニストは、Gタンパク質共役受容体(GPCR)の人口をアクティブにすると、それは細胞または組織の応答で絶頂に達するシグナル伝達経路を誘発する。このプロセスは、単一の受容体、受容体の人口、または下流の応答のレベルで分析することができます。ここでは、単一の受容体のアクティブ状態のための一定のアゴニストの親和性の推定値を得るために下流の応答を分析する方法について説明します。
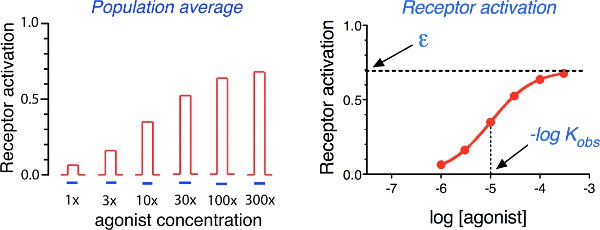
受容体は、アクティブと非アクティブな状態(図1)との間の量子スイッチその代替として動作します。アクティブ状態は、特定のGタンパク質または他のシグナル伝達パートナーと相互作用する。リガンドの非存在下で、非アクティブ状態が優勢。アゴニストの結合は、アクティブな状態(K B)のための定数の親和性が非アクティブ状態(K a)のそれよりもはるかに大きいため、受容体が活性状態に切り替える可能性が高くなります。の総和人口の受容体のすべてのランダムな出力は、時間の受容体の活性化の一定のレベルが得られます。最大値の半分の受容体の活性化を誘発するアゴニストの濃度の逆数は、観察された親和性定数(K OBS)と等価であり、アクティブ状態のアゴニスト受容体複合体の割合は、有効性(ε)(図2)として定義されています。
GPCRの下流応答を分析するための方法は、K OBSとアゴニストの1,2の相対的な有効性の推定を可能にすることが開発されている。このレポートでは、我々は別のアゴニストのように相対的なアゴニストK b値を推定するためにこの分析を変更する方法を示します。恒常的な活性を示すアッセイでは、我々はM -1の絶対的な単位で、K bを推定する方法を示します。
アゴニスト濃度反応曲線3,4を分析する我々の方法が構成されています運用モデル5を使用してグローバルな非線形回帰の。我々は、プリズム(グラフパッドソフトウェア社、サンディエゴ、CA)、ソフトウェアアプリケーションを使用して手順を説明します。分析は、Kの製品OBSと有効性(τ)に比例するパラメータの推定値が得られます。別のそれによって分割された1つのアゴニストのτKOBS、、の推定値は、K bの相対的な尺度(RA i)は6です。恒常的な活性を示す任意の受容体の場合は、それは自由な受容体複合体の効果(τSYS)に比例するパラメータを推定することが可能です。このケースでは、アゴニストのK bの値はτSYS 3 / OBSτKと同等です。
私たちの方法は、受容体サブタイプのアゴニストの選択性を決定するための、異なるGタンパク質を介してアゴニスト受容体のシグナル伝達を定量化するのに便利です。
プロトコル
1。アゴニスト濃度反応曲線の測定:ない恒常的な活性
- 相対的なアゴニストK b値(RA i)の推定には、少なくとも二つのアゴニスト濃度反応曲線のシリーズが必要です。 GPCRの機能的応答のためのインビトロアッセイはいずれもアゴニストの濃度を制御し、受容体を媒介する単一の種類の応答できることを提供する測定することができます。適切なセルベースアッセイは、組換え受容体を発現する細胞株におけるcAMP 4,7の測定とinositolphosphate蓄積8,9などがあります。全組織のアッセイの例としては、平滑筋10またはM 2ムスカリン受容体とアトリウム11を左フィールド刺激によるラットの収縮におけるβ1アドレナリン受容体を介した変化の収縮の測定が含まれています。
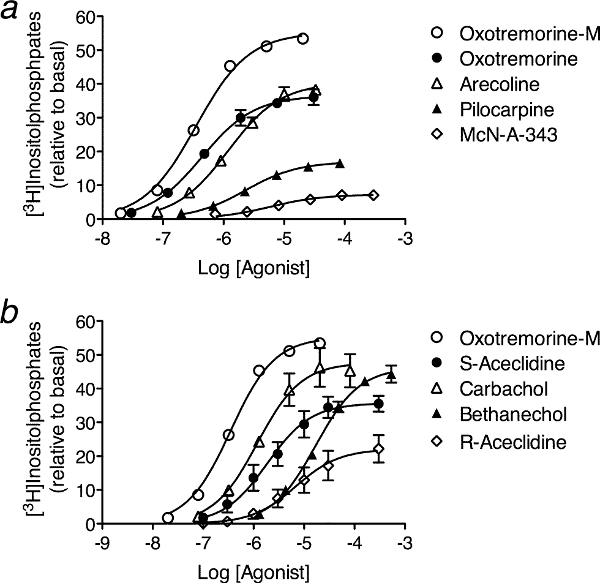
- 非常に有効アゴニストを含む、分析のためのアゴニストのシリーズを選択してください(例えば、内因性リガンド)。与えられた実験では、各アゴニストのための完全な濃度 - 応答曲線を測定する。アゴニストの数は、単一の実験で分析を完了するには大きすぎる場合、サブグループ、単一の実験のためのアゴニストの管理可能な数から成るそれぞれにアゴニストを分ける。各サブグループの場合は、(図3参照)サブグループ内の他のアゴニストのものと一緒に非常に有効アゴニストの濃度 - 応答曲線を測定する。データの変動に応じて、およそ、6回 - 各サブグループ3の実験を繰り返します。
- それぞれの濃度反応曲線の場合は、アゴニストの非存在下(基底応答)で、とアゴニストの増加濃度の存在下で反応を測定する。空間一様に対数スケール上でアゴニストの濃度はおよそ0.3から0.7ログ10単位、応答の範囲をカバーし、最大反応(E max)を定義する(図3参照)。 experim用細胞株でents、各測定は三連で行われます。
- アゴニストの各濃度の存在下で測定されたものから基礎の応答を引く。図3にプロットされた応答は、この方法で算出した。
2。アゴニスト濃度反応曲線の予備的分析:ない恒常的な活性
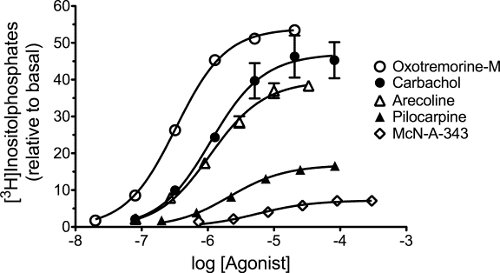
- プリズム内のデータテーブルへの濃度 - 反応の実験(例えば、図5)からデータを入力してください。ログのアゴニスト濃度のすべてがXというラベルの付いた列の下に入力されている最大のEの最大値を持っているように見えるアゴニストに対する応答の測定は、カラムに入力されている、と他のアゴニストのものは、隣接するには、文字列に入力されます。濃度 - 応答曲線の測定を複製する特定の文字で表される列のサブ列に入力されます。
- データがプロットされているグラフシートを選択し、使用して非線形回帰分析によってデータを分析する方程式と題する、ログ(アゴニスト)対応答 - 可変スロープ(4変数)。ゼロに" 底 "パラメータを制約し、回帰分析を行う。 " トップ"(E max)をコピーし、初期パラメータ推定値の計算に使用するためのExcelスプレッドシートにEC 50のパラメータを記録します。他のアゴニストは、"テストのアゴニスト"として指定されているのに対し、最大のEの最大の推定値とアゴニストは、"標準的なアゴニスト"として指定されています。
- 標準的なアゴニストの負の対数EC 50値として(LOGR1)OBSログτKの初期推定値を計算する(- logを"EC 50)。
ログとしてログRA各テストのアゴニストのiの値(LOGRA)の初期推定値を計算する{(トップ* EC 50')/(トップ'* EC 50)}標準アゴニストのパラメータは、アポストロフィで示されている、 。
ログ親和CONを計算するそれぞれのEC 50値の負の対数として-テストのアゴニストのstants(LOGK5 LOGK2)。
3。非線形回帰分析を用いてアゴニストRAI値の推定:ない恒常的な活性
- 2.1の下で上記のようなプリズムでデータテーブルにデータを入力してください。標準的なアゴニストのデータが列Aに入力されていることを確認してください
- fiveアゴニストの合計を含む場合のために示すように、ユーザー定義の数式を入力して、複数行でプリズムに、"RAIをログに記録":
- 次のように、初期パラメータ推定値を入力します。
標準的なアゴニストのログの親和性定数(LOGK1)の場合は0の任意の低い値を入力します。
の初期推定値を入力します。LOGRとの親和性定数(LOGK2 - LOGK5)とテストのアゴニストのRAI値(LOGRA)を記録します。
トランスデューサのスロープファクター(M)1.0の値の初期推定値を割り当てます。
システムの最大応答(MSYSの)標準的なアゴニスト(トップ") のE maxに相当する値の初期推定値を割り当てます。 - ; LOGR1、MSYSとM、すべてのデータセットのための共有値、 - LOGK5とLOGRA、制約のないLOGK2 LOGK1定数、0に制約:次のパラメータの制約を適用します。
- 非線形回帰分析を開始する。結果は、OBSログKが得られると、テストのアゴニストのRA i値を記録します。標準的なアゴニストはフルアゴニストである場合は、両方のログK OBSとログRA iの値は正確です。最も効果的なアゴニスト(標準アゴニスト)が実際に部分的なアゴニストである場合、より効果AGの後、K OBSの値onistsは過大評価されることがあります。それにもかかわらず、ログRAの推定値は、 私はこのような状況で、まだ正確です。
- 回帰が収束しない場合、実験者は、初期のパラメータ推定値によって定義される理論曲線をプロットすることもできます。データ点と理論曲線との間に大きな偏差がある場合は、初期パラメータ推定値の計算を確認してください。つまたは複数のアゴニストは、標準的なアゴニストと同等のE maxの値を持っている場合、それはソリューションに収束する回帰の場合は0に、そのログのK obsの値を制約する必要がある場合があります。
4。構成的受容体の活性を示す細胞ベースのアッセイにおけるアゴニスト濃度反応曲線の測定
- M -1の絶対単位でアゴニストK B値の推定については、細胞ベースのin vitroアッセイでは、展示構成的受容体活性ことに使用されています。 Constitutive受容体活性は、関心の受容体の発現に起因する基礎レベル上記の応答の増加として定義されています。
- アゴニストを選択し、セクション1.2で上記のような実験を設計する。
- それぞれの濃度反応曲線の場合は、非トランスフェクト細胞におけるアゴニストの非存在下(基底応答)で、目的の受容体(基底応答+構成的応答)でトランスフェクトされた細胞の応答を測定します。セクション1.3で説明したように異なるアゴニストの異なる濃度の存在下で反応を測定する。
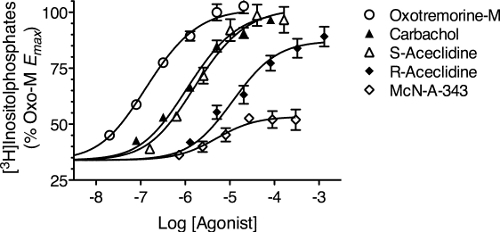
- 受容体でトランスフェクションできない細胞の基底応答マイナスの測定値の応答として構成的受容体活性とアゴニストの各濃度に対する応答を計算する。図6は、非常に低い恒常的な活性を示すシグナル伝達経路のためにこのように算出された様々なアゴニストに対する応答を示しています。
5。予備的恒常的な活性を示すアゴニスト濃度反応曲線のalysis
- 3.1節で説明したようにプリズムのデータテーブルにデータ(例えば、図6)を入力するだけでなく、-20のログアゴニストの濃度に対応する適切な文字で表される列内での恒常的な受容体活性に起因する応答を入力します。大きな負の対数はゼロのおおよそのアゴニストの濃度に入力されます。
- 2.2節で、それがされるように制約を"ボトム"パラメータで前述のようにデータを分析し、"すべてのデータセット用に共有。" "ボトム"共有" トップ"(E max)を 、コピーし、初期パラメータ推定値の計算に使用するためのExcelスプレッドシートにEC50のパラメータを記録します。
- 次のように、初期パラメータ推定値を計算します。
以前に3説明されている標準的なアゴニスト(LOGK1)またはその他のフル、テストのアゴニストの定数ログ親和性は、別の実験で決定する必要があります。 。
ログの初期推定値を計算するK OBSログ{(Top'トップ)/(EC 50(Top'ボトム))}のようにそれぞれの部分的なテストのアゴニストの値(すなわち、この場合にのみLOGK2)、その"下の"構成的受容体の活性化によって引き起こされる応答を示します。
ログ{トップ/(EC 50下)}として、各アゴニストのログK B(LOGKb)の初期推定値を計算する。
ログとしてログτSYS(LOGTsys)の初期推定値を計算する{/ボトム(トップ" -ボトム)}。
6。非線形回帰分析を用いて構成的受容体活性を示す応答のためのアゴニストのKB値の推定
- 3.1で上記のようなプリズムでデータテーブルにデータを入力してください
- twoアゴニストの条件を示すように、ユーザー定義の数式を入力して、複数行でプリズムに、"KB:ログ":
- 次のように、初期パラメータ推定値を入力します。
各アゴニストの親和性定数( - ステップ5.3で決定した値を入力LOGK1)を入力します。
各テストのアゴニストのK obsの推定値を入力します。
アゴニストのKBの推定値を入力します。
τSYS(LOGTsys)推定値をログに記録する入力します。
それぞれ、変換器のスロープファクター(M)およびシステムの最大応答(MSYSの)1.0とトップ "(標準アゴニストのE max)の値を割り当てます。 - ; LOGK2とLOGKb、制約のないLOGTsys、MSYSとM、すべてのデータセットのための共有値:次のパラメータの制約を適用します。
- 非線形回帰分析を開始する。結果は、標準的なアゴニストのログK B、ログK OBSをもたらすとK bの部分アゴニストの値、およびシステムの最大応答(MSYSの)、無料の受容体複合体(LOGTsys)、および運用モデル(M)のトランスデューサのスロープファクターのためのτsys値を記録する。
- 回帰が収束しない場合、ポイント3.6の下で、上記の手順に従ってください。
ディスカッション
RA I(相対K b値)を推定する手法が唯一のアゴニスト濃度-応答曲線の測定を必要とするため、これらの曲線が測定されるたびに、我々の分析を行うことができます。
実験的な準備(例えば、細胞または組織)の応答における日々の変動が大きい場合は、それぞれの濃度反応曲線の応答の測定は、毎日のための標準的なアゴニストの" トップ
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、健康グラントGM 69829の国立研究所によってサポートされていました。
参考文献
- Stephenson, R. P. A modification of receptor theory. British Journal of Pharmacology. 11, 379-393 (1956).
- Furchgott, R. F. The use of b-haloalkylamines in the differentiation of receptors and in the determination of dissociation constants of receptor-agonist complexes. Advances in Drug Research. 3, 21-55 (1966).
- Ehlert, F. J., Suga, H., Griffin, M. T. Analysis of agonism and inverse agonism in functional assays with constitutive activity: Estimation of orthosteric ligand affinity constants for active and inactive receptor states. J. Pharmacol. Exp. Ther. 33, 671-686 (2011).
- Griffin, M. T., Figueroa, K. W., Liller, S., Ehlert, F. J. Estimation of Agonist Activity at G Protein-Coupled Receptors: Analysis of M2 Muscarinic Receptor Signaling through Gi/o,Gs, and G15. J. Pharmacol. Exp. Ther. 321, 1193-1207 (2007).
- Black, J. W., Leff, P. Operational models of pharmacological agonism. Proceedings of the Royal Society of LondonSeries B: Biological Sciences. 220, 141-162 (1983).
- Tran, J. A., Chang, A., Matsui, M., Ehlert, F. J. Estimation of relative microscopic affinity constants of agonists for the active state of the receptor in functional studies on M2 and M3 muscarinic receptors. Mol. Pharmacol. 75, 381-396 (2009).
- Schultz, J., Hamprecht, B., Daly, J. W. Accumulation of adenosine 3':5'-cyclic monophosphate in clonal glial cells: labeling of intracellular adenine nucleotides with radioactive adenine. Proceedings of the National Academy of Sciences of the United States of America. 69, 1266-1270 (1972).
- Berridge, M. J., Downes, C. P., Hanley, M. R. Lithium amplifies agonist-dependent phosphatidylinositol responses in brain and salivary glands. Biochemical Journal. 206, 587-595 (1982).
- Kendall, D. A., Hill, S. J. . Methods in Neurotransmitter Receptor Analysis. , 68-87 (1990).
- Pulido-Rios, M. Vitro Isolated Tissue Functional Muscarinic Receptor Assays. Current Protocols in Pharmacology. 48, 4-15 (2010).
- Kenakin, T., Enna, S. J. . Current Protocols in Pharmacology. , (2001).
- Ehlert, F. J., Griffin, M. T., Sawyer, G. W., Bailon, R. A. simple method for estimation of agonist activity at receptor subtypes: comparison of native and cloned M3 muscarinic receptors in guinea pig ileum and transfected cells. Journal of Pharmacology and Experimental Therapeutics. 289, 981-992 (1999).
- Burstein, E. S., Spalding, T. A., Brann, M. R. Pharmacology of muscarinic receptor subtypes constitutively activated by G proteins. Mol. Pharmacol. 51, 312-319 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved