Method Article
De placas paralelas de flujo y la Cámara de circuito de flujo continuo para evaluar las células progenitoras endoteliales bajo una tensión cortante de flujo laminar
En este artículo
Resumen
Estamos describiendo un método de someter a las células adherentes al esfuerzo cortante de flujo laminar en un circuito de flujo continuo estéril. Adhesión de las células, la morfología puede ser estudiado a través de la cámara transparente, las muestras obtenidas de los circuitos para el análisis de metabolitos y células recolectadas después de la exposición de corte para futuros experimentos o la cultura.
Resumen
El objetivo general de este método consiste en describir una técnica de someter a las células adherentes a las condiciones de flujo laminar y evaluar su respuesta al corte de fluido y cuantificables tensiones 1.
Nuestro diseño de la cámara de flujo y un circuito de flujo (Fig. 1) contiene una zona de visualización transparente, que permite realizar pruebas de adhesión celular y la imagen de la morfología de las células inmediatamente antes del flujo (Fig. 11A, B), en varios momentos durante el flujo (Fig. 11C) , y después de flujo (Fig. 11D). Estos experimentos se ilustran con el cordón umbilical humano derivados de la sangre las células progenitoras endoteliales (CPE) y CPE porcino 2,3.
Este método también es aplicable a otros tipos de células adherentes, por ejemplo, células de músculo liso (SMC) o fibroblastos.
La cámara y todas las partes del circuito son fácilmente esterilizados con autoclave de vapor. A diferencia de otroscámaras, por ejemplo, cámaras de microfluidos, un gran número de células (> 1 millón, dependiendo del tamaño celular) se puede recuperar después del experimento de flujo bajo condiciones estériles para el cultivo celular o de otros experimentos, por ejemplo, ADN o la extracción de ARN, o inmunohistoquímica (Fig. 11E), o microscopía electrónica de barrido 5. El esfuerzo de corte se puede ajustar mediante la variación de la velocidad de flujo de la perfusión, la viscosidad del fluido, o la altura y la anchura del canal. Este último puede reducir el volumen de líquido o de las necesidades de la celda al tiempo que garantiza que el flujo unidimensional se mantiene. No es necesario medir la altura de la cámara entre los experimentos, ya que la altura de la cámara no depende de la utilización de las juntas, lo que aumenta enormemente la facilidad de múltiples experimentos. Además, el diseño del circuito permite fácilmente la toma de muestras para el análisis de perfusión y / o cuantificación de los metabolitos secretados por las células en la exposición de fluidos esfuerzo cortante, por ejemplo, óxido nítrico (Fig. 12) 6
Protocolo
1. Progenitoras endoteliales aislamiento de células
- Antes de cualquier acumulación de sangre periférica humana, presente su protocolo de investigación para la Junta de Revisión Institucional (IRB), y después de su aprobación, obtener de los donantes voluntarios "consentimiento informado (colección de sangre periférica y el aislamiento EPC había sido aprobado por la IRB y la Universidad de Duke está en pleno cumplimiento de los requisitos de EE.UU. reglamentarios relacionados con la protección de los participantes en la investigación humana).
- Cuando se trabaja con derivados de animales EPC, tiene su protocolo de investigación aprobado por el animal de Atención Institucional y el empleo Comisión (IACUC). Todos nuestros experimentos porcina había sido aprobado por el IACUC la Universidad de Duke y se llevaron a cabo de acuerdo con los más altos estándares del cuidado humano.
- Para el aislamiento de células progenitoras endoteliales, recoger 50 ml de sangre periférica a través de la técnica estándar de flebotomía de un donante voluntario consentido en las bolsas de recogida de sangre lleno de Citrat anticoagulantee fosfato dextrosa y diluir 1:1 con solución salina tamponada de Hank (sin CaCl2, MgCl2, MgSO4) y la capa de volúmenes iguales de Histopaque para crear capas bien definidas.
- Centrífuga (30 min, 740 g, el establecimiento de ruptura bajo) y recoger las células mononucleares (MNC) (capa leucocitaria) de la capa. Resuspender y lavar las multinacionales x 3 con Fosfato de Dulbecco solución salina tamponada (DPBS) con suero fetal bovino al 10% (FBS) x 10 min, 515 g, de las placas, en dos placas de 12 pocillos en medio completo el crecimiento de EPC (MCDB-131 medio con 5 ml de 200 mM L-glutamina, un 10% de SFB y el EGM-2 SingleQuots) a 37 ° C, 5% de CO 2.
- Poco a poco cambio de medio cada 24 horas durante los 7 primeros días, y luego cada dos días. Colonias EPC puede ser identificado después de un tiempo promedio de 14 días en base a su morfología de adoquines. Una vez que las CPE en la cultura cubrir ¼ de la superficie de 12 pocillos, expandir las células y confirmar la identidad de EPC con citometría de flujo mediante el análisis de la presencia de marcadores de superficieCD31 y ausencia de CD14, CD45 como se describió anteriormente 6. Otros ensayos que se pueden realizar son la morfología celular y el etiquetado con DII-Ac-LDL.
- Para los experimentos descritos en este documento, ampliar EPC aislados hasta que están casi confluentes en 3 T-75 frascos de cultivo celular en medio de EPC en un incubador humidificado a 37 ° C, 5% de CO 2.
2. Cálculo de esfuerzo cortante
- Recomendamos que estos cálculos se realizan antes de la fabricación de la cámara y el canal para tener un conocimiento profundo de las condiciones que se pueden lograr. Calcule el flujo de la perfusión en el circuito basado en la corte deseado destaca que debe aplicarse a las células de acuerdo con la ecuación 1 1,

donde Q es el caudal deseado, τ es el objetivo sescuchar el estrés actúa tangencialmente en las células, w es el ancho de la cámara de flujo, h es la altura de la cámara de flujo, y μ es la viscosidad de la perfusión (flujo medio).
- Un valor típico de la viscosidad (μ) por medio utilizado es de 0,9 cP (0,009 g cm -1 s -1). Tenga en cuenta que la viscosidad también puede aumentar mediante el uso de dextrano de alto peso molecular, si así lo desea 7. Un valor típico de estrés blanco de corte (τ) que se utiliza es de 15 dinas / cm 2, (típico de la tensión arterial de corte) o de 100 dinas / cm 2, si supra-fisiológicos esfuerzo de corte que se desea. Nuestra cámara suele tener un ancho (w) de 1,9 cm y la altura (h) en el rango de 166 a 267 micras.
3. Cámara de flujo de fabricación
- Cortar las placas superior e inferior de the la cámara de aleación de aluminio 6061 de valores rectangular con una dimensión superior de 7 x 2 "dimensiones e inferior de 7 x 2 x 0.25" x 0.5.
- El receso de la placa superior en la parte central de 0.125 "de profundidad, dejando a 0.950" por fin para el 1.375 "de ancho x 0,3125" depósito de líquido de profundidad.
- Taladro de 1 / 16 "de ancho x 0.625" slots largo de la parte inferior con el fin de penetrar en el depósito en la entrada y salida de los extremos.
- Al final de cada placa superior, perfore un céntrico hotel de 10/32 "pistas por pulgada (TPI) de diámetro para el polipropileno 1 / 8" para manguera para penetrar en el depósito del líquido. En el extremo de entrada, crear un complemento del lado de 10/32 "TPI a través del agujero de polipropileno 1 / 8" para manguera.
- Cono la parte de abajo arriba de la entrada de fluido a la ventana de visualización de cristal a 0.518 grados de una mezcla adecuada de líquido.
- Cortar una ventana corredera de vidrio en la placa de fondo en línea con la ventana de visualización superior. Utilizando cemento acuario, pegar una lámina de vidrio en la cámara. Deje que se cure por lo menos 24 horas.Asegúrese de que la ventana de visualización se encuentra oculto para que un 75 x 25 x 1 mm microscopio lámina de vidrio se sentará en la cámara de descarga.
- Crear un receso de un anillo alrededor de la parte inferior de las placas como superior e inferior que están separados por 0,02 ". Inserte la goma de las juntas tóricas.
- Perforar 10 juego 8 / 32 "agujeros de TPI en las cámaras superior e inferior para su uso con 8 / 32" tornillos de cabeza plana.
4. Flujo del circuito de montaje
- Arme el circuito de caudal, luego proceder a su esterilización.
- Adjuntar un 36 "segmento de tubo de duro a un extremo del amortiguador de pulsaciones (a través de 1 / 8"). En el otro extremo, conecte un 18 "segmento de tubos flexibles.
- Coloque un 1 / 8 "adaptador luer macho en el extremo de los 18" sección tubos flexibles, que se menciona en el paso 4.2. Conecte el luer macho a un 1 / 8 "luer hembra. Conecte el luer hembra con un nuevo 18" tubos segmento blando.
- Perforar tres agujeros en una tapa de 250 ml vaso de vidrio para poder adaptarse a la tubería. Yonsert un 1,5 "segmento de tubos flexibles (como salida de aire) en un agujero y los extremos libres de los tubos duros y blandos a través de los otros dos agujeros en la tapa en el frasco de vidrio de 250 ml (como depósito) (Fig. 2). Asegúrese de que el tubo dura llega al fondo del depósito (como el tubo de salida del depósito).
- Esterilizar las piezas sobre el autoclave de vapor a 121 ° C durante 60 min. Además autoclave una cámara de flujo completo, 3 x 2 "los segmentos de tubos flexibles, 1 macho y 1 hembra de 1 / 8" luer, 4 x ½ "y 6 x 5 / 16" 8-32 tornillos de cabeza plana, un par de pinzas , un 75 x 25 x 1 mm placa de vidrio (u otro material deseado de la superficie celular), y 2 toallas quirúrgicas.
- Coloque toallas estériles en campana de flujo laminar. Coloque el circuito de flujo, cámara de flujo, 4 x 4-way llaves de paso, 1 x 1-forma de llave, y todas las piezas esterilizadas a partir del paso 4.5 en este campo estéril.
- Ahora el uso de guantes estériles para conectar dos llaves de paso de 4 vías. Tapas de lugar en los puertos de la muestra abierta.
- Separar los adaptadores luer macho y hembra conectar los dos segmentos blandos tubería del circuito de flujo e insertar las llaves de paso conectado (Fig. 3).
- Conecte el tubo suave que se inserta en el depósito a una jeringa de 30 ml y eliminar el émbolo de la jeringa. Llena la botella con 125 ml de medio de EPC (Fig. 4).
- Colocar un filtro de jeringa estéril en el conducto de ventilación (Fig. 4).
- Mover el circuito de flujo en un incubador humidificado a 37 ° C, 5% de CO 2.
- Pince la línea dura en el cabezal de la bomba de rodillos indicado para su uso con este tipo de tubería (Fig. 5). Asegúrese de que el tubo no se superpone con las pistas de rodillos montaje de la bomba. Marcar el tubo por donde sale la cabeza de la bomba a cada lado con un marcador.
- Asegúrese de que todas las llaves de paso están cerradas hacia los puertos de la muestra y abierta a lo largo del circuito de flujo. En marcha la bomba. Verifique la dirección del flujo. La perfusión debe pasar from el depósito de vidrio a través del tubo con fuerza en el amortiguador de pulsaciones.
5. EPC fluorescentes etiquetado
- Mientras se calienta el circuito de flujo a 37 ° C, preparar las células para la siembra en la diapositiva. Tenga en cuenta que el etiquetado fluorescente es necesaria si las células se visualizaron en los materiales opacos, por ejemplo, titanio (Ti).
- Crear una solución de 1 mM de celular Rastreador de Orange (CTO) mediante la dilución de 50 mg CTO en polvo con 90 l de dimetilsulfóxido (DMSO). Asegúrese de proteger a esta mezcla de exposición a la luz (apagar la luz durante el trabajo en campana de flujo).
- Crear una solución de 2 M de trabajo de CTO, diluyendo 36 l de solución madre CTO en 18 ml de suero libre de MCDB-131 medio.
- Enjuague EPCs en 3 cerca de confluencia T-75 frascos de cultivo celular con 10 ml de DPBS (sin Ca y Mg).
- Añadir 6 ml de la solución 2 M CTO de trabajo a cada matraz. Incubar durante 15 min a 37 ° C. Enjuagar x 2 con 10 ml de DPBS (sin Ca y Mg).
- Añadir 4 ml de tripsina a cada matraz. Se incuba a 37 ° C durante 3 min. Neutralizar con 8 ml de solución de neutralización de tripsina.
- Lave por centrifugación x 5 minutos a 600g y resuspender en 5 ml de medio de EPC.
6. Células de siembra de diapositivas antes de conjunto de la cámara de flujo
- Una corredera de vidrio, titanio u otro material puede ser utilizado, y la superficie de deslizamiento puede ser modificado por capa de la vuelta de un polímero o la adición de una capa de metal. Colocar la placa en una estéril rectangular de cuatro cámaras recipiente de cultivo de células (o tejido uso de la cultura frasco de diapositivas si la superficie de poliestireno se desea). Recuento de células y las semillas de 1,5 x 10 6 células en el portaobjetos en 5 ml de medio de EPC x 6 horas si una capa de células confluentes se desea en el inicio del flujo (Fig. 11A).
- A fin de probar la propagación de células y la adhesión bajo una tensión cortante líquido, permiten 3 x 10 6 células se adhieran a sólo 15 minutos antes del inicio del flujo (quick-siembra) ( Figura. 11B).
7. Flujo de conjunto de la cámara
- El uso de guantes estériles, conecte un 2 "segmento de tubos flexibles con un 1 / 8" luer hembra. Conecte otro 2 "segmento de tubos flexibles con un 1 / 8" adaptador luer macho.
- Coloque los 2 "tubos flexibles con adaptador luer hembra para el puerto de entrada. Coloque los 2" tubos flexibles con luer macho en el puerto de salida. Coloque las llaves de paso de 4 vías con dos de estos adaptadores luer. Conecte el restante 2 "pedazo tubos flexibles en el conector de puerto lateral que salió de la trampa de burbujas y colocar una llave de paso de 1 vía (Fig. 6).
- Con unas pinzas esterilizadas, extraiga la diapositiva de células cabeza de serie del recipiente de cultivo de células (o si usa un frasco de diapositivas, retirar el matraz de la diapositiva) y colocarlo en el hueco de la placa inferior de la cámara de flujo. Asegúrese de que la diapositiva se coloca con el lado de las células sembradas hacia arriba.
- Pipetear 10 ml de medio de EPC caliente en la diapositiva. Dejar que el medio para cubrir la diapositiva y la cámara de flujo, but no se derrame sobre el medio de la junta tórica en la placa inferior.
- Coloque la placa de la parte superior de la cámara de flujo en la placa inferior, alineando los orificios de los tornillos. Tenga cuidado de no introducir burbujas de aire en la cámara durante este paso, manteniendo las dos placas paralelas.
- Atornillar las placas (una automática de baterías velocidades destornillador hasta este proceso).
- Eliminar las burbujas de aire de entrada de la trampa de burbujas abriendo la llave de paso de una vía conectada al puerto de entrada del lado de la burbuja trampa y lave cuidadosamente el tubo de entrada con el medio de EPC usando una jeringa de 10 ml. A continuación, cerrar esta llave de paso y tapa de él (Fig. 7).
- Ahora eliminar las burbujas de aire desde el canal de la cámara abriendo el puerto de salida de 4 vías llave de paso y con cuidado el lavado medio EPC a través de la cámara de flujo, de nuevo utilizando una jeringa de 10 ml. Si las burbujas siguen siendo grandes, levantar el extremo de salida de la cámara a un ángulo de 45 ° (Fig. 8).
- Cap todas las conexiones de llave de paso de 4 vías y cierreque se retiraran. Mueva la cámara de flujo en la incubadora con el circuito de flujo de ensamblado (Fig. 9).
- Una pausa en la bomba del circuito de flujo. Cierre las llaves de paso del circuito de flujo en la dirección del flujo para evitar fugas y mantener el interior de la cámara estéril. Transporte de la cámara de flujo de la campana de flujo en el circuito de flujo. Conecte la cámara de flujo en el circuito de flujo. Abra las llaves de paso en la dirección del flujo. Reanudar el flujo de la bomba. Asegúrese de que la perfusión fluye en la dirección correcta. Ajustar el caudal a la tensión de corte deseado.
- Durante el experimento de flujo, la cámara de flujo se puede eliminar del circuito a la imagen de las células a través de la luz o microscopía de fluorescencia. Con el fin de hacerlo, desconecte la cámara de flujo del circuito de flujo en las conexiones de llave-llave de paso. Para mantener la esterilidad de la cámara, cerrar las llaves de paso del circuito de flujo y llaves de paso del flujo de cámara en la dirección del flujo y la tapa de todos los grifos, antes de retirar el circuito de flujode la incubadora (Fig. 9).
8. Perfundido recogida de muestras
- Para la recogida de muestras de fácil perfundido para el análisis, (por ejemplo, la síntesis de óxido nítrico), la primera pausa de la bomba.
- Cierre la llave de paso más cercana a la amortiguador de pulsaciones. Retire el tapón de protección e insertar una jeringa de tamaño pequeño, por ejemplo, jeringa de 3 ml, en el puerto de la muestra. Mantenga la tapa y asegurarse de que no se contaminen, colocándolo boca abajo.
- Cierre la llave de paso en la dirección de la cámara de flujo, manteniendo el puerto de la muestra y el circuito en el sentido de la apertura amortiguador de pulsaciones.
- Dibuja la cantidad deseada de la muestra, por ejemplo, 150 l, en el circuito. Cierre la llave de paso hacia el puerto de la muestra antes de retirar la jeringa. Almacenar la muestra de perfusión en un vial etiquetado y se congelan a - 80 ° C (para la determinación de óxido nítrico en un punto más adelante).
- Vuelva a tapar el puerto de la muestra y garantizar que todas las llaves de paso están abiertas antes de comenzar de flujo.
9. Los resultados representativos
Usando nuestro método rápido de semillas, humanos derivados de la sangre las células progenitoras endoteliales pueden ser sembrados en las diapositivas de titanio durante 15 minutos y se adhieren en fisiológicas (arterial) las fuerzas de corte de 15 dinas / cm 2.
Como se muestra en la Figura 10, EPC se extienden bajo la influencia del flujo de 210 ± 11,4 m 2, inmediatamente después de la siembra, a 657 ± 39,1 m 2 después de 3 horas, y de 1152 ± 55,3 m 2 después de 24 horas de estrés fluido de corte de 15 dinas / cm 2 (diferencia entre los grupos es estadísticamente significativa con p <0,0001, 1-way ANOVA). Paralelamente al aumento en el área de la celda, que se pueden visualizar a través de la cámara transparente con microscopio de luz o fluorescentes, la redondez calculada según la ecuación 2 6
/ Files/ftp_upload/3349/3349eq2.jpg "/>
se redujo de 878 x 10 -3 ± 5,9 x 10 -3, inmediatamente después de la siembra, a 671 x 10 -3 ± 19,2 x 10 -3 después de 3 horas, y de 526 x 10 -3 ± 19,2 x 10 -3 después de 48 horas de la exposición al estrés mismo fluido de corte (diferencia entre los grupos es de nuevo estadísticamente significativa con p <0,0001, 1-way ANOVA).
Figura 11D muestra que EPCs alinear y orientar en la dirección del flujo después de 48 horas de esfuerzo de corte de fluido a 15 dinas / cm 2 en comparación con su orientación al azar después de un período de siembra estática de 6 horas, que se muestra en la Figura 11A.
Nuestro método también permite la obtención de muestras de la perfusión en los puntos de tiempo predeterminado para el análisis y / o cuantificación de los metabolitos de la celda secreta. Como ejemplo representativo que representan la producciónción de nitrito (NO 2 -) durante un experimento de flujo de 48 horas con EPC porcina en la Figura 12. Hemos medido directamente el producto de la oxidación primaria de óxido nítrico (NO) como un marcador sustituto para el NO en las muestras recogidas medio del circuito de flujo en los puntos de tiempo diferentes a 12,0 nmol de 6 horas, el 13,1 nmol a las 12 horas, 16,3 nmol a los 24 horas, y el 24,6 nmol después de 48 horas para 1 x 10 6 células de 15 dinas / cm 2 6.
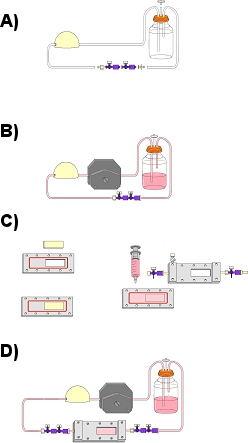
Figura 1. Esquema que muestra una visión general de la asamblea de circuito de flujo y el experimento de flujo. (A) Flujo de montaje del circuito sin la cámara de flujo. Aquí se incluyen el depósito, amortiguador de pulsaciones, la tubería dura, tubos flexibles, llaves de paso de 4 vías y conectar adaptadores luer, así como filtro de aire. (B) Conexión de la cámara de flujo a través del segmento de tubo duro a la cabeza de la bomba de flujo. (C) En sertion de la diapositiva EPC cabeza de serie en la placa inferior de la cámara de flujo (D). Completar el montaje del circuito de flujo con la cámara de flujo.

Figura 2. Flujo completamente montado del circuito para la esterilización.
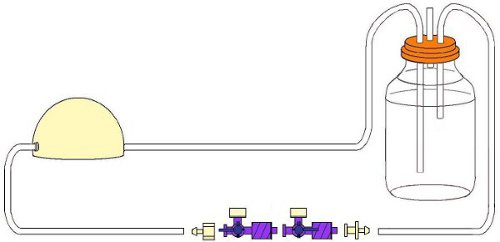
Figura 3. Circuito ensamblado de flujo después de la esterilización con llaves de cierre incluido.
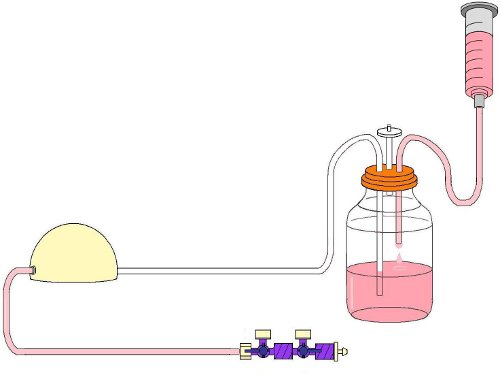
Figura 4. Llenar el depósito de vidrio con 125 ml de medio de EPC.
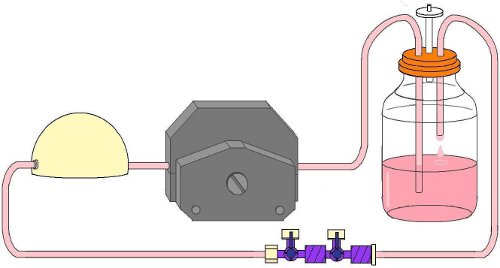
Figura 5. Flow circuito sujeta en la cabeza de la bomba de flujo antes de la inserción de flujo de la cámara.
jpg "/>
Figura 6. Asamblea Placa superior de la cámara.
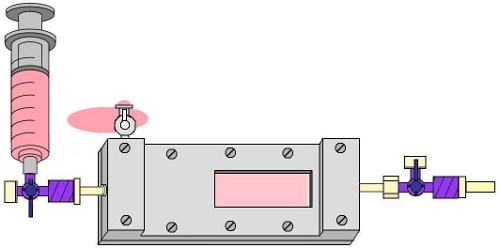
Figura 7. Lavado de la trampa de la burbuja con el medio de EPC para eliminar las burbujas de un lado de entrada de la cámara.
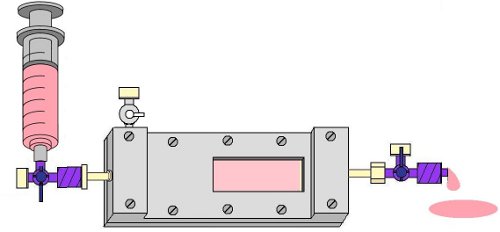
Figura 8. Lavado de la cámara con el medio de EPC para eliminar las burbujas de la diapositiva y el lado de los egresos de la cámara.
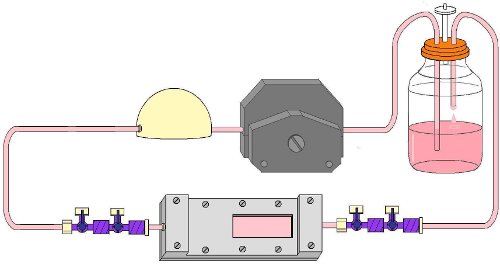
Figura 9. Completamente montados circuito de flujo con la cámara de flujo se inserta durante un experimento de flujo.
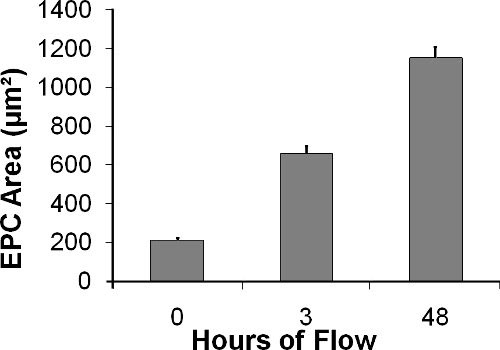
Figura 10. EPC área (en m 2) aumenta en el transcurso del experimento de flujo.
files/ftp_upload/3349/3349fig11.jpg "/>
Figura 11. (A) Imagen de microscopia de luz de HUCB EPCs sembradas en una placa de vidrio recubierta de fibronectina x 6 horas antes de que fluya con un aumento de x 100. (B) HUCB EPCs etiquetados con CTO y rápida sin semillas, en un portaobjetos de Ti x 15 min antes de que el flujo, visualiza con microscopía de fluorescencia con un aumento de x 100. (C) La misma diapositiva Ti con EPC HUCB como en (B), después de 3 horas de flujo de 100 dinas / cm 2 y la imagen a través de la cámara transparente con un aumento de x 100. Tenga en cuenta la orientación de la propagación de las células al azar, pero aún después de 3 horas de flujo. (D) La misma diapositiva Ti, ahora después de 48 horas de exposición a un aumento del flujo x 100. EPC se etiquetan con CTO y núcleos de las células son teñidas con Hoechst (azul) después de flujo. Tenga en cuenta la alineación de las células en la dirección del flujo. (E) EPC porcino para la comparación en Ti después de 48 horas de flujo y 15 dinas / cm 2 de la exposición al esfuerzo cortante. Bordes de las celdas se tiñeron con anti-PECAM tinción (verde) y los núcleos con Sytox Acid Orange nucleicos mancha. Tenga en cuenta la alineación de las células en la dirección del flujo.
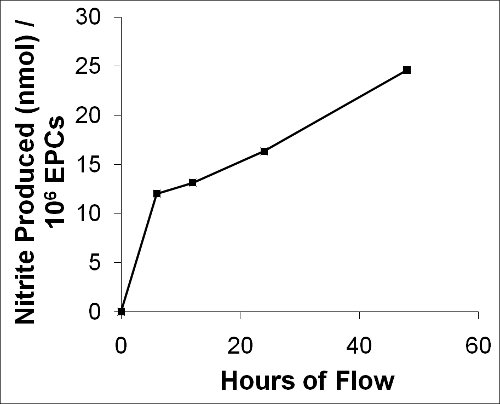
Gráfico de la Figura 12. Describe la producción de NO de CPE porcina durante las 48 horas de flujo. Un producto de la oxidación primaria del NO, el nitrito (NO 2 -), se midió como un marcador sustituto para el NO a partir de muestras recogidas en medio de diferentes puntos de tiempo durante el flujo.
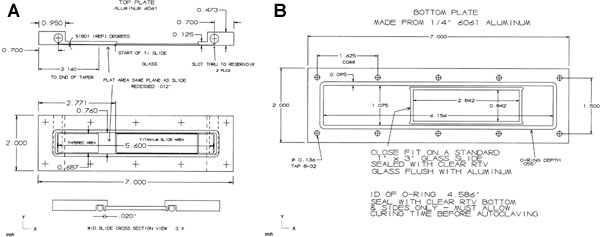
Figura 13. La cámara de flujo es de aleación de aluminio 6061 de valores rectangular, con la parte superior (A) de 0,5 "x 2" x 7 "y la sección inferior (B) 0,25" x 2 "x 7" en la dimensión. La parte superior escepillada en su superficie inferior de contacto tóricas de 0,45 "con el fin de asegurar la planitud para el sellado. La parte superior está empotrado en su parte central a 0.125", que sale 0,95 "por fin un 0,3125" x 1.375 "depósito de líquido. El depósito de sección superior es roscada 3/8-24 TPI y 0.25 "de profundidad para recibir tapones roscados de acero inoxidable. Ranuras de la medición de 1 / 16 "x 0.625" fueron a máquina en la parte inferior que penetran hacia el embalse. El tapón del lado de entrada tiene un 10/32 "a través del agujero de un polipropileno 1 / 8" para manguera para conectar a una llave de paso. Cada unidad tiene un final situado en el centro roscado 10/32 TPI por 0.25 "de profundidad para una porción de polipropileno 1 / 8" para manguera en el 0,45 "x 2" final. Los extremos de utilizar un 0,07 "agujero desde el fondo de las discusiones a través de penetrar en el depósito. La parte inferior de la parte superior tiene una superficie cónica 0.6875" de ancho, 0.518 grados desde el centro de una ranura de LH en una distancia de 1,460 ". Este cono mezcla de un área plana 0.6875 "de ancho x 0,0118" de profundidad y 0.590 "de la final del vidrios (u otra superficie de diapositivas, de titanio, por ejemplo) el recreo. Este piso debe estar al ras con el vidrio (u otra superficie, por ejemplo, diapositivas de titanio) una vez que la corredera se instale. La forma cónica y plana se pulen. La superficie de la diapositiva es 0.0118 "empotrado en la superficie inferior. La 0,0118" receso continúa a la ranura de depósito en el extremo de humedad relativa. Una junta tórica se encuentra oculto por completo alrededor de las ranuras y deslice dejando 0.020 "de la superficie original entre la ranura del anillo y de diapositivas. La parte superior e inferior son las unidades de perforación de diez agujeros. La parte superior tiene agujeros de paso de 8 / 32 TPI plana avellanada tornillos de cabeza. La sección inferior tiene agujeros colocados juego los orificios superiores y son de rosca 8 / 32 TPI. La unidad base tiene un tobogán de vidrio transparente ras ventana empotrada con su superficie situada sobre el portaobjetos de vidrio celular de la superficie (o diapositiva de titanio). La unidad tiene una ranura del que engloba las ranuras de la unidad superior con un ancho de 0,04 a salir "de la superficie original entre la diapositiva y la parte inferior de la ranura interior O-ring. El O-rings son de silicona roja AS568A, Número Dash 044 de la sección superior y 046 de la sección inferior.
Discusión
Nuestro circuito de flujo y la cámara de flujo permiten someter a las células adherentes, EPC, por ejemplo, para definir destaca fluido de corte. Desde la cima de la cámara y el fondo son la adhesión transparente, y la morfología de células pueden ser evaluados, ya sea en tiempo real, a través de la propia cámara, o después de un experimento de flujo y el desmontaje de la cámara de flujo. En ese momento, las células pueden ser cosechadas en condiciones estériles y sea resembrado, o para recoger su ADN o ARN, etc, para su posterior análisis.
Para conseguir un flujo laminar, el diseño de la cámara debe ser tal que se cumplen varias condiciones.
En primer lugar, el flujo debe ser laminar, que se puede verificar mediante el cálculo de su número de Reynolds (Re), que es la relación de fuerzas de inercia a las fuerzas viscosas. (Si predominan las fuerzas viscosas, Re es pequeño y el flujo es laminar o "plenamente desarrollado" - por lo general para Re <2300.Si predominan las fuerzas de inercia, el flujo se vuelve más y más al azar hasta que es turbulento, como es el caso de Re> 4000). Podemos calcular Re acuerdo con la ecuación 3 8,

Donde ρ es la densidad del fluido, Q es el caudal, μ es la viscosidad, w y h son la anchura y la altura de la cámara, respectivamente, y D h es el diámetro hidráulico, definido de acuerdo con la ecuación 4 8
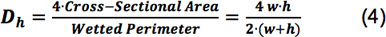
El número de Reynolds de nuestras cámaras de flujo de tres, con alturas que van desde 166 hasta 267 micras, rango de 13,9 a 34,6 en las tasas de flujo calculated para obtener una tensión de corte de 15 dinas / cm 2. En los caudales calculados para una tensión de corte de 100 dinas / cm 2, el número de Reynolds de las cámaras van desde 90,4 hasta 234. Todos estos números de Reynolds es mucho menor que 2300 y cumplen el criterio de flujo laminar.
En segundo lugar, para el campo de la velocidad y la tensión de corte para ser independiente de la distancia a lo largo del canal de flujo (es decir, completamente desarrollado), la distancia desde la entrada de fluido a la diapositiva debe ser más largo que la longitud de entrada, e L. Esto puede ser satisfecho mediante el cálculo de la longitud de entrada, de acuerdo con la ecuación 5 9.

Para los valores mencionados anteriormente, la longitud de entrada varía de 0,01 a 0,25 cm.
En tercer lugar, con el fin de garantizar que la velocidad y el esfuerzo cortante en la dirección lateral no varíansignificativamente del valor de caudal en canal unidimensional (Ph Δ / 2 l), la relación h / w debe ser mucho menor que 1. Para la tensión de cizallamiento promedio bajo condiciones de flujo en dos dimensiones que el 95% de la tensión de cizallamiento en flujo unidimensional, h / w debe ser igual a 0,10, y para la tensión de cizallamiento en condiciones de flujo en dos dimensiones a ser el 97,5% de la tensión de cizallamiento en flujo unidimensional, h / w debe ser igual a 0,05. Con las dimensiones de nuestra cámara de flujo diseñado de 1,7 cm de ancho y 166 a 267 m de altura, se cumplen estos criterios.
La presión varía sólo en la dirección del flujo, si no hay gradientes de presión lateral en la entrada. Esto se puede evaluar el uso de tintes o las partículas en la trayectoria del flujo. Además, para los experimentos de flujo continuo, un amortiguador de pulsaciones se inserta en el circuito de flujo. El amortiguador de pulsaciones saca la mayoría de los pulsatility causada por la bomba de rodillos en el circuito, y nos permite aproximar la suposición de flujo constante. Es de destacar que el amortiguador de pulsaciones utilizado debe ser compatible con la bomba y la tubería utilizada en el circuito, así que puede eliminar efectivamente las pulsaciones en el flujo de salida de las frecuencias específicas de la bomba de rodillos. En nuestra demostración de la Masterflex L / S amortiguador de pulsaciones consigue un flujo laminar cuando se utiliza en la línea de descarga con cualquier bomba de la serie Masterflex L / S (0 a 600 RPM) y E / P tubería de 26. Para el flujo pulsátil, una bomba programable se puede utilizar para generar formas de onda diferentes.
Para el flujo pulsátil, una bomba programable se puede utilizar para generar formas de onda diferentes.
Además, el circuito está diseñado de tal forma que las muestras de perfundido se pueden recoger en diferentes puntos de tiempo sin riesgo de contaminación de las células o fluido. En nuestro ejemplo, la concentración de NO 2 - se midió por quimioluminiscencia conun analizador de Ionics / Sievers Óxido Nítrico (NOA 280, Instrumentos Sievers, Boulder, CO) como se describió previamente 10. El reductor utilizado para el análisis de nitrito se yoduro de potasio en ácido acético (14,5 M de ácido acético y 0,05 M de KI), que tiene el potencial de reducción para convertir nitrato en NO, pero no es suficiente para reducir los óxidos de nitrógeno más altos, tales como nitratos y por lo tanto es relativamente específica para el nitrito. El nitrito cantidad total producida fue calculada como el producto de la concentración de producción y el volumen total del circuito, mientras que el ajuste de volumen que se pierde, mientras que la toma de muestras 6.
Los siguientes pasos son esenciales para la exitosa ejecución de los experimentos de flujo:
- Es deseable evitar la formación de burbujas durante el flujo de set-up, ya que las burbujas tienen el potencial para arrancar las células de su superficie. Esto se puede evitar teniendo cuidado al colocar la parte superior de la cámara de flujo en la parte inferior, que es el mejorlogra manteniendo ambas paralelas entre sí y la reducción de la parte superior en la parte inferior de un movimiento sin reajustes. De este modo, pequeñas burbujas de aire que puedan estar presentes y / o flotando en el canal de flujo, se desviarán en la trampa de burbujas en cada extremo de la carcasa de aluminio.
- Es importante asegurarse de que el tubo de salida en el depósito llega hasta el fondo del embalse. De lo contrario, el aire puede ser absorbido en el tubo que conduce desde el depósito a la cámara si el nivel de perfusión cae ligeramente por debajo del extremo del tubo.
- El investigador debe estar familiarizado con la dirección del flujo de la bomba para que la bomba no querer correr en la dirección opuesta al inicio del flujo, lo que resultaría en aire que es aspirado en el circuito y la cámara.
- Para evitar la formación de espuma (debido a las proteínas desnaturalizadas contenidas en el suero) se recomienda bajar la tubería que va desde la cámara al depósito de aproximadamente una pulgada por encima de la perfusate nivel en el depósito. Sin embargo, mantenerlo por encima del nivel medio del flujo le permite verificar el flujo en el depósito durante el experimento.
- Al atornillar las piezas de cámara juntos, es importante captar firmemente la caja con una mano mientras se utiliza el destornillador eléctrico con la otra mano. Tenga en cuenta que el movimiento del destornillador eléctrico se traducirá en el par que tiene el potencial de "tirar la cámara alrededor de" una vez que se aprieta el tornillo.
- Para evitar la formación de ondas de presión en el circuito y el levantamiento de las células de su superficie, asegúrese de que todas las llaves de paso están abiertas antes de iniciar el flujo.
- Especialmente para estudios de flujo a largo plazo (> 48 horas) se recomienda utilizar el tubo más difícil y más resistentes que se insertan en el cabezal de la bomba para prevenir la rotura de la tubería.
- Es posible que la tubería 'migra' en el interior del cabezal de la bomba debido a la mala cabeza de la bomba ajusta los dientes. Por lo tanto le sugerimos prestar atención a la forma en la bañeraING se asegura en el cabezal de la bomba y el marcado de cada extremo del tubo con un marcador de tal manera que usted puede notar fácilmente si el tubo está "tirado en la 'o desplazado durante el experimento.
- Siempre revise cuidadosamente cada conector individual del circuito y la cámara antes de comenzar la perfusión con el fin de evitar la fuga de perfusión durante un experimento, debido a una conexión defectuosa. Esto es especialmente importante para los conectores de entrada y salida de amortiguadores de pulso!
- Recuerde que debe limitar la exposición de la luz si se utiliza marcadores fluorescentes.
Una posible limitación de nuestra cámara de flujo es que la altura es determinada por la altura del canal de mecanizado en el aluminio. Sin embargo, esto tiene la ventaja de no tener que verificar y ajustar la altura del canal antes de cada experimento y por lo tanto, simplifica los cálculos de esfuerzo cortante con sólo ajustar el caudal de la bomba al valor deseado. Dependiendo de los objetivos de su investigación, puede ser deseable paraaumento de la tensión de corte, sin aumento de velocidad de la bomba. En este caso se recomienda aumentar la viscosidad de la perfusión, por ejemplo, la adición de dextrano en el medio 11.
Una posible limitación del circuito de flujo es el gran volumen de medio utilizado, que puede ser problemático cuando se trata de cuantificar las concentraciones muy pequeñas de metabolitos celulares. Aunque no se muestra aquí, es posible reducir sustancialmente el volumen de circuitos mediante el uso de un pequeño embalse y amortiguador de pulsaciones y la disminución de longitud de la tubería y el diámetro.
Además, hay otros sistemas disponibles en el mercado que pueden utilizarse para aplicar la tensión de corte de fluido de las células en cultivo. Microfluidos basada en los sistemas, por ejemplo, el sistema de BioFlux Fluxion, permitir el análisis simultáneo de las células en diferentes canales de flujo de microfluidos cargado con solución en placas que actúan como entrada y salida de depósitos de estos canales 12,13,14. Sin embargo, estos y otros microsistemas de fluidos no son compatibles con el microscopio estándar y no permite la recuperación de un número suficiente de células para nuevos experimentos, como RT-PCR o Western Blot. Además, es menos fácil de usar, el costo mínimo de $ 40.000 y puede llegar a un total de más de $ 100,000, dependiendo del equipo accesorio.
Dos sistemas macrofluidic disponibles de la Corporación FlexCell Internacional, el Streamer FlexCell y los sistemas de FlexFlow, se han utilizado con éxito para estudiar las células endoteliales 15,16,17, las células del anillo 18 y los fibroblastos 19 bajo condiciones de flujo de fluidos. Un tercer sistema, disponible a través de GlycoTech, se ha utilizado para estudiar la adhesión de células tumorales 20 y adhesión de los leucocitos de 21 a monocapas endoteliales.
El sistema de Streamer permite a varias diapositivas que se ejecutan bajo las condiciones de estrés misma corte de una vez, pero carece de una ventana de visualización y - a diferencia de nuestrosdiseño - no permite la visualización en tiempo real de las células bajo flujo.
El sistema FlexFlow tiene una ventana de visualización, sino que requiere un microscopio vertical, que podría no ser el microscopio estándar que se utiliza en la mayoría de los laboratorios. Además, el sistema FlexFlow requiere un cubreobjetos recubiertos de células que se invierte cuando se coloca en la cámara de flujo. Esto impide la visualización de las células fluorescentes en una superficie opaca, como el titanio recubierto de vidrio, que se demuestra en nuestro estudio. Por último, la cubierta se desliza especializados tienen que ser comprados específicamente para el sistema FlexFlow, que está en el rango de precio de varios miles de millones de dólares, similar al sistema de Streamer FlexCell.
GlycoTech ofrece circulares y rectangulares placas paralelas cámaras de flujo, que son mucho menos costosos, pero fabricados en material acrílico fundido que no pueden ser convenientemente madre autoclave como la nuestra cámara. Es de destacar que otras cámaras de flujo que se han descrito para ser autoclavableparece poco práctico, ya que requieren especial lentes microscópicas 22,23. El sistema utiliza GlycoTech juntas de goma de silicona se interpuso entre las placas superior e inferior, que se cambio en el espesor con el uso repetido y por lo tanto, cambiar la altura de la cámara a través del tiempo (el fabricante recomienda la adquisición de otras nuevas después de cada diez usos). Nuestra cámara de aluminio con una función de anillos permite la completa oposición de las placas superior e inferior y se asegura la altura de la cámara constante entre los experimentos. Por último, las bombas de vacío son necesarias para lograr un sellado a prueba de fugas en muchos diseños de cámara de flujo, incluyendo las cámaras de GlycoTech, que no son necesarios en nuestro diseño.
Mientras que no se muestra aquí, la cámara de flujo se pueden mantener bajo el microscopio durante el experimento de caudal de imágenes en tiempo real de la adhesión celular y / o comportamiento. Si se desea, se recomienda utilizar lámparas de calor o una almohadilla de calefacción en la cámara para mantener la temperatura perfundido a 37 ° C. Pielallí, la bomba de rodillos puede ser sustituida por una bomba de jeringa, si no "recirculación" de cualquiera de las células o de sus metabolitos o fármacos en investigación o agentes que se desea 24.
También es posible que el flujo de las células etiquetadas de forma diferente en las células adherentes, por ejemplo, las plaquetas fluorescente sobre una capa de EPCs confluentes (utilizando el ensayo de plaquetas descrito por Achneck et al. 6,25) para evaluar la célula a célula de interacción bajo una tensión cortante del fluido. Nuestra cámara de flujo combina las valiosas aportaciones de otras cámaras de flujo disponibles, tales como un puerto de muestreo perfusión y un visor, tiene la importante ventaja de la compatibilidad, ya sea con un microscopio invertido o vertical. Es totalmente autoclavable y permite experimentos repetidos a la altura de la cámara constante y sin necesidad de bombas de vacío para obtener un sellado hermético.
Divulgaciones
La producción y el libre acceso de este video-artículo es patrocinado por Cole-Parmer Instrument Co.
Agradecimientos
Los autores desean agradecer a Joe Owen en el Instrumento Biomédica y Machine Shop por sus incansables esfuerzos en la fabricación y montaje de las piezas de cámara de flujo y Matt Maudsley de Leica Microsystems para asistir en las técnicas de imagen a las células a través de cámaras de flujo. Estamos en deuda con Kevin Collins Servicios de perfusión de Duke y el Dr. Steve Wallace en el Departamento de Ingeniería Biomédica por sus útiles sugerencias sobre el diseño de flujo de circuito. También nos gustaría agradecer a la Fundación Nacional de Ciencias de Posgrado Programa de Becas de Investigación para el apoyo a Alexandra Jantzen y el NIH, por su apoyo a través de subvención "forro autólogo de EPC para mejorar la biocompatibilidad de los dispositivos de asistencia circulatoria" RC1HL099863-01.
Materiales
| Name | Company | Catalog Number | Comments |
| Productos / Reactivos | Empresa | Producto # | |
| 10 ml jeringa | Cole Parmer Instrument Co. | 07940-12 | |
| 1-Vía Stopcoks | Cole Parmer Instrument Co. | 30600-00 | |
| 30 ml jeringa | BD Medical | 309650 | |
| Camino de 4 Llaves | Cole Parmer Instrument Co. | 30600-04 | |
| Aleación de aluminio | N / A | 6061 | |
| De cultivo celular platos (4-así, rectangular) | Thermo Scientific, Nunc | 267061 | |
| Celular Rastreador de naranja | Invitrogen | C34551 | |
| DMSO | Research Organics | 2162D | |
| DPBS (-/-) | Invitrogen | 14190-144 | |
| EGM-2 Singlequots | Lonza | CC-4176 | |
| Adaptador Luer hembra | Cole Parmer Instrument Co. | SI-45500-04 | |
| Fibronectina | Sigma | F0895-2MG | |
| Botellas de vidrio (250 ml) con tapa | Cole Parmer Instrument Co. | 34594-24 | |
| Tubos duro | Cole Parmer Instrument Co. | 06508-16 | |
| HBSS | Sigma | H8264-500ML | |
| Histopaque | Sigma | H8889-500ML | |
| Hoechst manchas Solución | Sigma | H6024 | |
| Hyclone FBS | Thermo Scientific | SH30071.01 | |
| L-glutamina | Lonza | 17-605E | |
| Adaptador Luer macho | Cole Parmer Instrument Co. | EW-45505-04 | |
| MCDB-131, 1x Media | Cellgro | 15 a 100 CV | |
| Accesorios de púas de polipropileno | Cole Parmer Instrument Co. | 06365-90 | |
| O-Rings | N / A | AS568A | |
| Amortiguador de impulsos | Cole Parmer Instrument Co. | 07596-20 | |
| Bomba-Drive (Masterflex L / S de velocidad variable impulsar la economía) | Cole Parmer Instrument Co. | 7524-40 | |
| Bomba-Head (Masterflex Fácil cabezal de la bomba de carga) | Cole Parmer Instrument Co. | 07518-60 | |
| Diapositiva | Cole Parmer Instrument Co. | 48500-00 | |
| Tubos flexibles | Cole Parmer Instrument Co. | 96400-16 | |
| Filtro de jeringa | Cole Parmer Instrument Co. | 02915-12 | |
| Sytox Acid Orange nucleicos manchas | Invitrogen | S-11368 | |
| Tripsina EDTA | Lonza | CC-5012 | |
| Neutralizar la solución de tripsina | Lonza | CC-5002 |
Referencias
- Bhat, V. D., Truskey, G. A., Reichert, W. M. Fibronectin and avidin-biotin as a heterogeneous ligand system for enhanced endothelial cell adhesion. J. Biomed. Mater. Res. 41, 377-385 (1998).
- Broxmeyer, H. E. Cord blood stem and progenitor cells. Methods Enzymol. 419, 439-473 (2006).
- Achneck, H. E. . American Heart Association Scientific Sessions, Abstract Oral Sessions, Medical Aspects End Stage Heart Failure: Transplantation and Device Therapies. , (2010).
- Brown, M. A., Wallace, C. S., Angelos, M., Truskey, G. A. Characterization of umbilical cord blood-derived late outgrowth endothelial progenitor cells exposed to laminar shear stress. Tissue. Eng. Part. A. 15, 3575-3587 (2009).
- Achneck, H. E. Regenerating titanium ventricular assist device surfaces after gold/palladium coating for scanning electron microscopy. Microsc. Res. Tech. 73, 71-76 (2010).
- Achneck, H. E. The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells: EPC-seeded antithrombotic Ti Implants. Biomaterials. 32, 10-18 (2011).
- Rinker, K. D., Prabhakar, V., Truskey, G. A. Effect of contact time and force on monocyte adhesion to vascular endothelium. Biophys. J. 80, 1722-1732 (2001).
- Truskey, G. A., Yuan, F., Katz, D. F., Horton, M. J. Ch. 2. Transport Phenomena in Biological Systems. , (2004).
- Truskey, G. A., Yuan, F., Katz, D. F., Horton, M. J. Ch. 2. Transport Phenomena in Biological Systems. , (2009).
- Allen, J. D. Plasma nitrite response and arterial reactivity differentiate vascular health and performance. Nitric Oxide. 20, 231-237 (2009).
- Xiao, Y., Truskey, G. A. Effect of receptor-ligand affinity on the strength of endothelial cell adhesion. Biophys. J. 71, 2869-2884 (1996).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet Adhesion and Aggregation Under Flow using Microfluidic Flow Cells. J. Vis. Exp. (32), e1644-e1644 (2009).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. W. e. l. l. plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Conant, C. G. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J. Lab. Autom. 16, 148-152 (2011).
- Metaxa, E. Nitric oxide-dependent stimulation of endothelial cell proliferation by sustained high flow. Am. J. Physiol. Heart. Circ. Physiol. 295, H736-H742 (2008).
- Radel, C., Carlile-Klusacek, M., Rizzo, V. Participation of caveolae in beta1 integrin-mediated mechanotransduction. Biochem. Biophys. Res. Commun. 358, 626-631 (2007).
- Wang, X. L., Fu, A., Spiro, C., Lee, H. C. Proteomic Analysis of Vascular Endothelial Cells-Effects of Laminar Shear Stress and High Glucose. J. Proteomics. Bioinform. 2, 445-445 (2009).
- Elfervig, M. K., Minchew, J. T., Francke, E., Tsuzaki, M., Banes, A. J. IL-1beta sensitizes intervertebral disc annulus cells to fluid-induced shear stress. J. Cell. Biochem. 82, 290-298 (2001).
- Archambault, J. M., Elfervig-Wall, M. K., Tsuzaki, M., Herzog, W., Banes, A. J. Rabbit tendon cells produce MMP-3 in response to fluid flow without significant calcium transients. J. Biomech. 35, 303-309 (2002).
- Patton, J. T., Menter, D. G., Benson, D. M., Nicolson, G. L., McIntire, L. V. Computerized analysis of tumor cells flowing in a parallel plate chamber to determine their adhesion stabilization lag time. Cell. Motil. Cytoskeleton. 26, 88-98 (1993).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of Physiologic E-Selectin-Mediated Leukocyte Rolling on Microvascular Endothelium. J. Vis. Exp. (24), e1009-e1009 (2009).
- Kaper, H. J., Busscher, H. J., Norde, W. Characterization of poly(ethylene oxide) brushes on glass surfaces and adhesion of Staphylococcus epidermidis. J. Biomater. Sci. Polym. Ed. 14, 313-324 (2003).
- Bakker, D. P., Plaats, A. v. a. n. d. e. r., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Angelos, M. G. Dynamic adhesion of umbilical cord blood endothelial progenitor cells under laminar shear stress. Biophys. J. 99, 3545-3554 (2010).
- Baker, G. R., Sullam, P. M., Levin, J. A simple, fluorescent method to internally label platelets suitable for physiological measurements. Am. J. Hematol. 56, 17-25 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados